静脉注射用免疫球蛋白在儿童血液/肿瘤性疾病中应用的儿科专家共识
2021-04-19广东省医师协会儿科医师分会中国当代儿科杂志编辑部
广东省医师协会儿科医师分会 《中国当代儿科杂志》编辑部
免疫球蛋白是一种高度同源、与抗体分子类似的球蛋白,能在不同疾病及生理情况下影响免疫力。1952 年,人免疫球蛋白G(immunoglobulin G, IgG)首次用于治疗遗传性免疫球蛋白缺乏症;1981 年,由健康供血者血浆制备的静脉注射用免疫球蛋白(intravenous immunoglobulin, IVIG)首次用于治疗自身免疫性疾病[1]。目前,美国食品药品监督管理局已批准IVIG 的临床适应证有8 大类,约占IVIG 临床实际使用的一半左右。尽管IVIG在恶性血液肿瘤化疗、靶向治疗及造血干细胞移植中的应用越来越普遍,但国内外尚无儿童血液/肿瘤性疾病中IVIG 应用的临床指南或共识。为了提高临床医师对IVIG 的认识,提供规范的临床实践指导,广东省医师协会儿科医师分会和《中国当代儿科杂志》编辑部利用现有的循证医学证据,在征求国内专家意见的基础上,达成了IVIG 在儿童血液/肿瘤性疾病中应用的儿科专家共识。
本共识的制定主要基于目前国内外关于儿童血液/肿瘤性疾病中IVIG 应用的研究进展和相关研究数据,同时参考国外血液/肿瘤性疾病的治疗指南。在制定本共识的过程中遵循以下原则:(1)多学科(儿童血液、儿童肿瘤、新生儿、临床药学和统计学等学科)专业人员参与;(2)主要参考近20 年公开发表的中英文文献(截至2020年6 月)和处方资料;(3)根据文献或资料的可信等级(评判标准见表1),确定某一临床问题在本共识中的推荐等级(等级标准见表2)。

表1 证据水平的评价标准[2]

表2 推荐级别标准[2]
1 IVIG 的作用机制
IVIG 的作用机制还未完全清晰,目前提出的关于IVIG 作用机制都属于直接抗体作用或免疫调节的2 个主要类别[3],包括:(1)封闭单核巨噬细胞Fc 受体,阻断自身抗体与Fc 结合,使外周血细胞免遭自身免疫性破坏;(2)加速清除和中和循环中的自身抗体:IVIG 的提取来自于大量(3 000~10 000 名)健康人混合血浆,因而具有广谱抗正常人蛋白和抗独特性抗体的作用;免疫球蛋白的Fc 与B 细胞 FcγR 结合,可抑制B 细胞的克隆增生;大剂量IVIG 加速IgG 的分解代谢,清除致病性IgG;(3)调节细胞因子独特型网络:免疫球蛋白的Fab 含有多种抗炎症性和免疫调节性高亲和力抗体,能特异性结合白细胞介素(IL)1α、IL-2、IL-6、肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ),从而阻止细胞因子与相应受体结合,抑制细胞因子的生物学活性,抑制免疫细胞的增殖、成熟、活性,甚至诱导凋亡;(4)补体抑制:IgG 可与激活的C3b 和C4b 补体形成共价结合,干扰免疫复合物的形成和对靶细胞膜的溶解破坏,阻断补体复合物与巨噬细胞相结合,抑制巨噬细胞对自身组织的损伤;(5)IVIG 中的抗Fas 抗体可阻断Fas 配体介导的细胞凋亡,抑制过度炎症反应对自身组织的损伤;(6)清除细菌毒素和病毒:IVIG 中含有多种抗细菌毒素抗体,对细菌毒素含有的超抗原具有中和作用,可清除体内持续存在的病毒与细菌毒素。
2 临床应用
根据IVIG 的作用机制,其在儿童血液/肿瘤性疾病中的临床应用可分为免疫调节及抗炎、免疫替代、抗感染等三大部分。
2.1 免疫调节及抗炎
1980 年偶然观察到大剂量IVIG 在治疗川崎病和免疫性血小板减少症(immune thrombocytopenia,ITP)的确切疗效[4],从而发现了大剂量IVIG 的抗炎和免疫调节作用,随后迅速广泛地应用到各种自身免疫性和炎症性疾病。
2.1.1 ITP ITP 是一种获得性自身免疫性出血性疾病,儿童发病率为4/10 万~ 5/10 万,其特征在于自身抗体介导的血小板破坏和巨核细胞产板不足导致血小板计数低,其一线治疗是全身性糖皮质激素和IVIG[5-6]。ITP 是第一个使用IVIG 治疗的自身免疫性疾病,疗效同类固醇激素[7]。在活动性出血情况下,IVIG 可诱导血小板计数快速回升,迅速止血,1~3 d 开始反应,高峰持续2~7 d[8]。不同中心采用的IVIG 剂量和疗程不同。一项Meta 分析显示,低剂量IVIG(总量<2 g/kg)对比大剂量IVIG(总量>2 g/kg),在临床疗效及发展成慢性ITP 等方面无显著差异,且低剂量IVIG 不良反应小及花费少[9]。美国血液学会指南小组建议单剂量IVIG 0.8~1 g/kg 或短程糖皮质激素作为ITP 的一线治疗,但为了迅速提升血小板水平,两者可联用[10]。参照国际共识[5],对需要治疗的急性ITP 儿童患者,推荐一线治疗为单剂量IVIG 0.8~1.0 g/kg,或常规剂量0.4 g/(kg · d)×3~5 d,必要时可重复给药;对于出血患儿紧急治疗,推荐糖皮质激素联合IVIG 1 g/(kg · d)×2 d[11-12](推荐级别:IA)。
2.1.2 自身免疫性溶血性贫血 自身免疫性溶血性贫血(autoimmune hemolytic anemia, AIHA)是由于机体免疫功能紊乱、产生自身抗体、导致红细胞破坏加速(溶血)超过骨髓代偿时发生的贫血,一般分为继发性和原发性,也可依据自身抗体与红细胞结合所需的最适温度分为温抗体型、冷抗体型及阵发性冷性血红蛋白尿症。IgG 介导的温抗体型最常见,一线治疗是糖皮质激素,7%~85%的患者有效,二线治疗推荐利妥昔单抗(rituximab, RTX)治疗和脾切除[13]。国内指南缺乏IVIG 的推荐方案,治疗存在争议,不作为常规治疗[14]。早期研究显示AIHA 临床起效所需的IVIG 总量为5 g/kg[15]。荟萃研究显示54%的儿童患 者 对IVIG 0.4~0.5 g/(kg · d)×5 d 治 疗 有 反 应,大部分患者病情可缓解3 周以上,但有效率仍低于糖皮质激素和脾切除[16]。加拿大指南并不建议IVIG 作为急、慢性溶血的常规治疗,但是指出可用于危及生命的溶血或其他治疗无效的溶血[14]。2011 年英国指南推荐IVIG 用于血红蛋白<60 g/L的短期治疗、脾切除术前的临时措施[17]。综上,推荐仅在严重或快速溶血时,给予大剂量甲泼尼 龙 联 合 单 剂 量IVIG 2 g/kg 或 者0.5 g/(kg · d)×4 d 挽救治疗(推荐级别:ⅣB)。
2.1.3 噬血细胞综合征 噬血细胞综合征(hemophagocytic lymphohistiocytosis, HLH) 是 一类由原发性或继发性免疫异常导致的过度炎症反应综合征。IVIG 可通过多种抗炎机制抑制巨噬细胞的活性和减轻组织损伤,故可作为HLH 的辅助治疗,尤其是感染相关HLH 病程早期,部分患者对IVIG 单药或联合糖皮质激素反应良好[18-21]。一项比较儿童非家族性HLH 对大剂量IVIG 和HLH-2004 方案临床反应的研究,结果显示二者疗效差异无统计学意义[21],且采用IVIG 治疗可避免依托泊苷药物的不良反应[18-21]。因此,对常见感染诱发的HLH,推荐早期给予 IVIG 1 g/(kg · d)×2 d 联合地塞米松治疗;若病情无缓解,则采用HLH-1994方案(推荐级别:ⅣB)。
2.1.4 胎儿和新生儿溶血病 胎儿和新生儿溶血病(hemolytic disease of the fetus and newborn,HDFN)是由母体IgG 抗体胎盘转换导致胎儿和新生儿红细胞破坏所致,主要见于ABO、RhD 血型不合,本质上属于同种异体免疫性溶血性贫血,治疗主要包括光疗和换血。IVIG 治疗HDFN 的数据尚无定论[22],鉴于目前已有的临床试验数据和换血的风险,IVIG 已被建议作为新生儿同种免疫性溶血性疾病的替代治疗,以减少换血的需要。推荐HDFN 婴儿总胆红素水平在换血疗法阈值下20~30 g/L 以内,或者尽管采用强化光疗后其胆红素水平仍在上升,可给予IVIG 0.5~1 g/kg 持续2 h 输注,必要时12 h 后重复1 次(推荐级别:ⅣB)。
2.1.5 输血后紫癜 输血后紫癜(post-transfusion purpura, PTP)是一种极为罕见的输血反应,主要发生于孕期或输血后对外源性血小板抗原致敏后的女性,最常见的抗原是血小板抗原PLA1(HPA1a)[23]。临床上主要表现为输血后5~10 d 出现血小板持续减少,持续数日至数周,伴有瘀斑瘀点、活动性出血[24]。文献报道IVIG 的有效率可高达90%,通常 2 d 内起效,平均治疗4 d 后血小板计数回升至100×109/L[25-26]。推荐首选治疗是IVIG 0.4 g/(kg · d)×5 d,重度血小板减少者按IVIG 1 g/(kg · d)×2 d(推荐级别:ⅣB)。
2.1.6 移植物抗宿主病 移植物抗宿主病(graft-versus-host disease, GVHD)是造血干细胞移植常见的并发症。美国食品药品监督管理局批准IVIG 预 防GVHD 是 基 于Sullivan 等[27]在1990 年发表于《新英格兰医学杂志》的研究。在这项随机试验中,191 名给予IVIG 0.5 g/kg(移植第 -7 天至第90 天每周给予,然后每月直至第360 天止),与191 名未给予IVIG 的患者进行了比较,多变量分析显示对照组急性GVHD>2 级的风险增加。但后续研究显示,使用常规IVIG或巨细胞病毒(CMV)特异 IVIG(CMV-IVIG)不会导致急性GVHD 的风险降低或病死率降低[18]。2018 年荟萃分析提出预防性使用IVIG 对生存无显著影响,但对急性GVHD 和CMV 感染性疾病显示出积极的临床效果,对肝小静脉闭塞病和疾病复发则显示出负面效果[19]。基于上述证据,不推荐IVIG 用于GVHD 预防(推荐级别:IC)。
2.1.7 血栓性血小板减少性紫癜 血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura, TTP)是一种罕见的微血管性凝血病,通常在感染或其他免疫系统损伤后出现,特别是在ADAMTS13突变的患者中,治疗可采用血浆置换、输注新鲜冷冻血浆等。IVIG 的使用一直存在争议,不做常规推荐,但某些难治患者可能获益[11]。
2.1.8 获得性血友病 获得性血友病(acquired hemophilia, AH)是体内产生针对凝血因子Ⅷ(极少数是凝血因子Ⅸ)的特异性自身抗体而引起的凝血功能异常。AH 有导致全身性出血的风险,治疗药物包括糖皮质激素、环磷酰胺、环孢素和RTX。国际指南建议使用糖皮质激素或糖皮质激素联合环磷酰胺作为一线治疗,RTX 作为二线治疗[28]。对于免疫抑制方案无反应的患者,推荐给予IVIG 1 g/(kg · d)×2 d 或0.4 g/(kg · d)×5 d[29-30](推荐级别:ⅣB)。
2.2 替代治疗
IgG 替代治疗能显著减少感染次数并降低感染严重性,现被广泛应用于各种继发性免疫缺陷状态,尤其是低丙种球蛋白血症患者[31]。低丙种球蛋白血症的定义是:血清IgG 水平低于同年龄健康对照者平均值2 个标准差,或血清IgG<0.6 g/L[32]。根据严重程度将低丙种球蛋白血症分为3 类,即轻度:IgG 0.4~0.599 g/L;中度:IgG 0.2~0.399 g/L;重度:IgG 0~0.199 g/L[33]。
2.2.1 造血干细胞移植 造血干细胞移植(hematopoietic stem cell transplantation, HSCT)术后代表体液免疫的B 细胞恢复需要2 年左右时间,在此期间受者可能存在严重获得性低丙种球蛋白血症(血清IgG<4 g/L)[34]。因较多的临床研究及文献评价未发现IVIG 常规替代治疗明显受益的证据,目前指南不支持HSCT 术后常规应用IVIG[14,35]。但随着移植情况复杂化,单倍体和无关移植数量增多,强化的免疫抑制治疗,导致移植患者感染风险增加[36]。在欧洲,55%的移植中心在移植后使用IVIG 预防感染[14]。数据显示,维持HSCT 儿童血清IgG 水平>4 g/L 至术后6 个月,是一种预防病毒感染安全有效的方法[37]。推荐HSCT后患者每2 周测定IgG 谷浓度,IgG<4 g/L 开始IVIG 替代治疗,每3~4 周注射0.4~0.6 g/kg,若输注剂量不足维持该谷浓度,每增加0.1 g/kg 的IVIG大约提高谷浓度1.2 g/L,一般持续3~6 个月;对于持续存在低免疫球蛋白血症、慢性GVHD 及反复发作的鼻窦及肺部感染者,IVIG 替代治疗可维持至HSCT 后1 年以上(推荐级别:IA)。
2.2.2 RTX 治疗 RTX 是一种抗CD20 的单克隆抗体,常用于恶性血液肿瘤和自身免疫性疾病的治疗。RTX 能特异性地与细胞膜抗原CD20 结合,诱导 B 淋巴细胞耗竭的免疫反应,导致B 细胞功能障碍、低丙种球蛋白血症。低丙种球蛋白血症主要发生RTX 治疗后6 个月以内,感染风险增加的因素有恶性肿瘤基础病、RTX 疗程增加、IgG 水平低下超过6 个月、联合吗替麦考酚酯和嘌呤类似物[38-39]。211 例接受RTX 治疗的B 细胞淋巴瘤患者,38%出现低丙种球蛋白血症,6.6%的患者需要IVIG 控制感染,其中79%患者在接受2 个疗程以上RTX 后开始IVIG 治疗[33]。此外,有研究显示自身免疫性疾病中RTX 耗竭B 细胞,IVIG 可促进未成熟和幼稚浆细胞从骨髓迁移至外周血和病变组织的微环境中,分化为产生正常或生理性抗体的CD138+浆细胞,同时扩增调节性T 细胞和B 细胞,在恢复免疫平衡中发挥关键作用[40]。针对接受RTX 治疗后出现的中重度低丙种球蛋白血症患者(IgG<4 g/L),推荐在发生反复或严重感染时启动IVIG 替代治疗,每月注射IVIG 0.4~0.6 g/kg,突破性感染后增加剂量至0.8 g/kg,至自身IgG 恢复正常水平(推荐级别:ⅣB)。
2.2.3 CD19 嵌合抗原受体T 细胞治疗 针对B细胞CD19 嵌合抗原受体T 细胞(CAR-T)疗法是癌症免疫治疗的一个重要里程碑。CAR-T 细胞输入体内,至少6 个月无法检测到B 细胞[41]。急性淋巴细胞白血病患儿接受CAR-T 治疗后,43%的患儿出现了低丙种球蛋白血症,且治疗前患儿普遍处于免疫抑制状态,可能增加感染风险[42]。美国Memorial Sloan Kettering 癌症中心对接受CD19靶向CAR-T 细胞治疗的53 例急性淋巴细胞白血病成人患者的感染并发症进行回顾性分析,发现治疗后28 d 内感染发生率最高[43]。欧洲血液和骨髓移植学会及美国血液和骨髓移植学会建议,CAR-T治疗后的IVIG 替代治疗遵循X 连锁无丙种球蛋白血症原则[44]。因此,在CAR-T 细胞输注后前3 个月,每4 周检测1 次IgG 水平。推荐对IgG ≤4 g/L的患者启动预防性IVIG 替代治疗,即每月注射IVIG 0.4~0.5 g/kg;对持续低丙种球蛋白血症(IgG≤4 g/L)及严重、持续性或复发性细菌感染(尤其是鼻窦和肺部)的患者重启IVIG 替代治疗,若IgG 4~6 g/L 但治疗后仍存在严重或反复感染,同 样 需 要IVIG 治 疗[42]( 推 荐 级 别:ⅣB)。
2.2.4 恶性血液肿瘤性疾病 目前尚无广泛系统研究IVIG 用于预防儿童急性白血病和儿童恶性实体瘤相关感染或治疗的指南及推荐,亦不主张对急性髓系白血病或急性淋巴细胞白血病患者常规预防性使用IVIG。研究显示在接受化疗的急性白血病患儿中B 细胞免疫功能受损是明确的,大部分急性B 淋巴细胞白血病患儿接受强化诱导和维持化疗后,免疫球蛋白水平低下持续1 年左右,而且功能性免疫缺陷在治疗结束后可能继续维持6~12个月[45]。对急性白血病患者进行个体化评估,参照慢性淋巴细胞性白血病治疗原则[46],推荐每月注射IVIG 0.4~0.5 g/kg 以维持血清IgG>4~5 g/L,突破性感染时可调整至IgG>6~8 g/L(推荐级别:ⅡB)。
2.3 抗感染
2.3.1 CMV 感染 CMV 感染是异基因HSCT 术后严重的并发症之一,与急性和慢性GVHD 的风险增加有关[47-48]。目前CMV 感染的治疗措施包括免疫抑制剂减量、使用抗病毒药物和CMV 特异性T 细胞过继治疗等。既往系列病例报道证实大剂量IVIG 或高滴度CMV-IVIG 联合更昔洛韦治疗,可提高CMV 肺炎的免疫缺陷患者生存率[49-50]。目前IVIG 对CMV 感染的治疗存在争议,2017 欧洲白血病感染会议仅推荐IVIG 用于治疗CMV 肺炎[51]。遵循目前国际共识,针对CMV 肺炎,推荐抗病毒药联合高滴度的CMV-IVIG 0.15 g/kg,隔天1 次,治疗2 周,共7 次,然后每周1 次,共4 周;若无CMV-IVIG 可用,推荐标准化的IVIG 0.5 g/kg,疗程同CMV-IVIG[50-52](推荐级别:ⅠA)。
2.3.2 细小病毒B19 感染 细小病毒B19(human parvovirus B19, HPV B19)是一种常见的人类病原体,可感染类红细胞祖细胞并引起血液系统疾病,例如贫血和再生障碍性疾病。HPV B19 的感染率为4%~72%,自体干细胞移植发生率最低,而恶性血液肿瘤病中感染率最高[53-54]。感染后最常见的表现是贫血、发热、传染性红斑、关节痛,HSCT术后因免疫缺陷可发生慢性感染的症状,如纯红细胞再生障碍性贫血[55]。目前没有针对HPV B19的抗病毒药物,由于体液免疫通过IgG 抗体的中和作用在预防和根除HPV B19感染中起着重要作用,因此IVIG 被认为是这些免疫功能低下患者抵抗HPV B19 感染的可行选择。在一项回顾性研究中,10 名HPV B19 感染所致的纯红细胞再生障碍性贫血的患者接受IVIG 治疗,平均接受2.7 个IVIG疗程,每个疗程平均剂量为(1.3±0.5)g/kg,平均80 d 内9 人贫血纠正,随访1 年无复发[56]。根据已有的文献报道,对于未合并人类免疫缺陷病毒(HIV)感染的慢性感染患者,推荐免疫抑制剂减量和IVIG 治疗,0.4 g/(kg · d)×5 d[57](推荐级别:ⅣB);对于合并HIV 感染者,IVIG 方案为1~2 g/(kg · d)×2~5 d, 或0.4 g/(kg · d)×5~10 d( 推荐级别:ⅡⅠB)。
2.4 IVIG 在儿童血液/肿瘤性疾病中的应用汇总
综上所述,儿童血液/肿瘤性疾病由于疾病本身或治疗的因素,会出现继发性低丙种球蛋白血症、自身免疫功能异常、原发或继发性免疫功能低下等表现,因此IVIG 在血液病的免疫调节和抗炎治疗及肿瘤的化疗、靶向治疗及HSCT 后等的应用越来越普遍和重要。现将IVIG 在儿童血液/肿瘤性疾病中主要应用汇总如下(表3)。
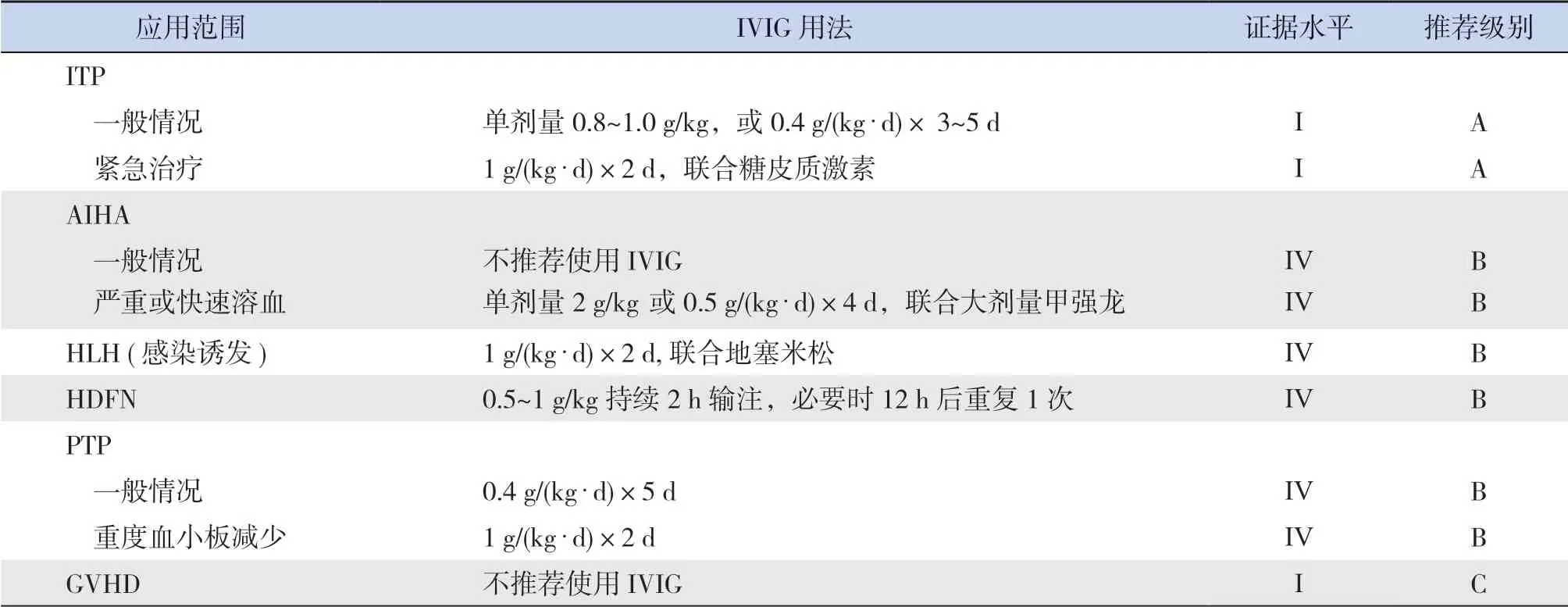
表3 IVIG 在儿童血液/肿瘤性疾病中的应用

续表3
3 IVIG 的不良反应
IVIG 安全性较高,大多数与IVIG 相关的不良反应是轻度和短暂的,总体不良反应发生率为5%~15%[58],严重的不良反应发生率为2%~6%[59]。不良反应的发生风险一般与IVIG 剂量及输注速度有关,在IgG 亚类缺陷和高IgM 综合征中发生率也相对较高。推荐初始输注速率0.01 mL/(kg · min) [5% IVIG 30 mg/(kg · h)] 维 持15~30 min,然后增加至0.02 mL/(kg · min),若耐受性良好,可调整至0.04 mL/(kg · min),最后调整至最大速度0.08 mL/(kg · min)[60-61]。
常见的不良反应包括头痛、潮红、胸闷、发热、寒战、肌痛、疲劳、呼吸困难、背痛、恶心、呕吐、腹泻、血压变化、心动过速和过敏反应。其中头痛是很常见的不良反应,通常在输注过程中或输注后2~3 d 内发生,轻者可予非甾体抗炎药止痛,严重者可用5-羟色胺受体激动剂(如舒马普坦)或糖皮质激素治疗或预防[62-63](推荐级别:ⅣB)。IVIG 治疗后出现的一过性无症状中性粒细胞减少,通常在输注后2~4 d 发生,2 周内恢复,一般无需治疗,可通过糖皮质激素预防[64-65](推荐级别:ⅢB)。
严重的不良反应有严重过敏反应、急性肾衰竭、血栓栓塞事件和无菌性脑膜炎。全身性过敏反应的罕见病例通常见于IgA 缺乏患者,但IgA 缺乏者不是IVIG 禁忌证[66]。对曾经发生严重过敏反应的患者,可检测抗IgA 抗体,若抗IgA 抗体滴度高(>1/1 000),IgG 替代治疗需谨慎应用[61](推荐级别:ⅣB)。肾功能损害首先表现为血尿素氮或肌酐升高,其次为少尿和肾功能衰竭,在大剂量输注后5~7 d 达到高峰[67]。已有肾功能损害患者,应缓慢输注IVIG,适当水化,避免使用含蔗糖的IVIG 产品,每日不超过0.5 g/kg 的措施预防肾衰竭发生(推荐级别:ⅢB)。血栓事件估计发生率为1%~16.9%[68-69],危险因素包括首次大剂量使用IVIG、口服避孕药、高龄、既往/目前血栓形成、既往有动脉粥样硬化疾病、高黏滞综合征、遗传性高凝状态、输注速度快[70],可采用预水化、速度低于50 mg/(kg · h)、低渗IVIG 产品(3%~6%)、预防性使用阿司匹林或低分子量肝素等措施降低高危患者的血栓发生率,已出现血栓并发症患者需接受抗血栓治疗(推荐级别:ⅢB)。
不同的IVIG制剂在浓度、稳定剂、钠离子浓度、渗透压、pH 值等参数方面有所不同,在临床应用过程中需注意潜在风险,选择合适的IVIG 产品进行治疗[61]:婴儿和限液患者需避免低浓度制剂;婴儿和心血管疾病患者应注意避免使用高钠含量的IVIG;含氨基酸的制剂在特定遗传代谢异常患者中需谨慎应用;使用麦芽糖或葡萄糖作为稳定剂的制剂不推荐用于糖尿病及肾损伤风险患者。
执 笔:刘四喜
制定专家(按姓氏笔画排序):马廉(深圳市儿童医院)、文飞球(深圳市儿童医院)、方建培(中山大学孙逸仙纪念医院)、江华(广州市妇女儿童医疗中心)、叶中绿(广东医科大学附属医院)、刘四喜(深圳市儿童医院)、吴学东(南方医科大学南方医院)、陈纯(中山大学附属第七医院)、杨丽华(南方医科大学珠江医院)、邹亚伟(广州医科大学附属第一医院)、罗学群(中山大学附属第一医院)、林广裕(汕头大学第二附属医院儿童医院)、林愈灯(广东省人民医院)、黎阳(中山大学孙逸仙纪念医院)
利益冲突声明:所有作者均声明不存在利益冲突。
