熊果酸通过调节miR-373-3p 对肺癌A549 细胞凋亡和迁移的影响
2021-04-19陈换换张小莉桑晓林冯龙于莹莹宋超杰李志慧
陈换换张小莉桑晓林冯 龙于莹莹宋超杰李志慧
(河南中医药大学,郑州 450046)
肺癌是发病率和死亡率增长最快,对人类健康和生命威胁最大的恶性肿瘤之一,病因与许多因素密切相关,包括环境污染、吸烟、饮酒、职业因素等。肺癌的生物学特点为:侵袭性强、复发率高、生长速度快,预后效果差。大多数患者在确诊时已发展至中晚期,多数已出现肿瘤的转移和局部侵犯。目前,抗肿瘤药物层出不穷,但肺癌患者五年生存率未显著增加。因此,寻找有效治疗方案,提高肺癌患者生存质量,是一个重要研究方向。越来越多的研究表明肺癌侵袭、增殖、转移的发生与microRNA(miRNA)密切相关。
miRNA 是长度为18 ~25 个核苷酸的内源性小分子非编码RNA,通过与目的基因mRNA3’端结合进而调控基因的蛋白表达,进而影响细胞增殖、分化、侵袭及凋亡的过程,参与疾病的发生发展[1]。miR-373 位于染色体带19q13.4 上,属于miR-371-372-373 家族,其前体 pre-miR-373 经过 Dicer 酶酶切后成为成熟的 miR-373-3p(又称 miR-373) 和miR-373-5p,自然界绝大对数以 miR-373-3p 存在[2]。据报道[3],miRNAs 在人类癌症中具有抑癌和致癌双重作用。研究表明miR-373 在胆管癌[4]、鼻咽癌[5]、肝癌[6]、肺腺癌[7]中对肿瘤细胞的凋亡、迁移和侵袭发挥重要调控作用。据报道[8],miR-373 在肺癌A549 细胞中低表达,过表达miR-373 可通过靶向TFIIB 相关因子2(BRF2)抑制A549 细胞增殖、迁移和侵袭。
熊果酸(ursolil alid,UA)为五环三萜类化合物,可抑制多种肿瘤细胞生长[9-12]。Chen 等[13]研究表明熊果酸可通过靶向miR-149-5p/MyD88 通路减弱非小细胞肺癌干性。李姝叶等[14]研究报道熊果酸可通过下调miRNA-21 作用于PTEN/PI3K/AKT 通路抑制肺癌A549 细胞迁移、增殖和侵袭。目前国内外尚无文献报导熊果酸调控肺癌A549 细胞的凋亡和迁移与miR-373-3p 表达有关。本研究旨在观察熊果酸是否通过调节miR-373-3p 影响肺癌A549细胞的凋亡和迁移,为肺癌治疗提供理论依据。
1 材料和方法
1.1 实验细胞
肺腺癌A549,购于中国典型培养物保藏中心。
1.2 主要试剂
熊果酸、化疗药物顺铂均购自美国Sigma 公司;细胞培养用培养基RPMI-1640 以及 BCA 试剂盒,均购于北京索莱宝科技有限公司;胎牛血清,购于德国 BI 公司; miR-373-3p 模拟物(miR-373-3p mimics)、无关对照(miR-373-3p scramble)、下游靶蛋白TXNIP 引物序列,均由上海吉玛公司合成;AnnexinⅤ- FITC/PI 双染,凋亡检测试剂盒,购于美国BD 公司;TRIzol 试剂和脂质体2000 购自美国Invitrogen 公司;TXNIP 和GAPDH 抗体均购于Santa Cruz 公司。引物核苷酸序列见表1。
1.3 实验方法
1.3.1 细胞培养
用含10%胎牛血清RPMI-1640 培养基培养肺癌A549 细胞。将置于37℃、5%CO2饱和湿度培养箱中,每隔1 d 换 1 次液。A549 细胞贴壁生长,当细胞汇合度达到约70%时,用胰蛋白酶消化、传代,用对数期细胞进行实验。

表1 引物的核苷酸序列Table 1 Nucleotide sequence of primer
1.3.2 细胞转染
转染前24 h,把浓度为 0.5×105/mL 的 A549 细胞均匀铺至6 孔板中,每孔加入2 mL RPMI-1640培养液;转染当日,细胞汇合度70%;根据Lip2000说明书进行细胞转染,用适量OptiMEM 无血清培养液稀释脂质体和mimics/scramble,室温孵育5 min后混合,静置20 min;将上述转染混合液分别加入相应6 孔板中;37℃,5% CO2继续培养 4 ~6 h;更换RPMI-1640 完全培养基,继续培养24 h。
1.3.3 MTT 法检测细胞活力
将浓度为4×105/mL 的A549 细胞均匀铺至96孔板中,每孔再补充100 μL RPMI-1640 完全培养基,培养至细胞贴壁后,分别将 20、40、60、80、100 mol/L 熊果酸加入对应96 孔板中,同浓度DMSO 溶剂作空白对照继续培养24 h;MTT 法检测时,每孔加入20 μL 检测试剂,避光孵育4 h;转染miR-373-3p mimics 组和miR-373-3p scramble 组的检测方法同上。检测前,吸除每孔内的细胞培养液,每孔再加入 100 μL MTT 试剂,测定每孔的 OD 值。每个浓度设置3 个复孔。
1.3.4 RT-PCR 检测 miR-373-3p 的表达
细胞转染加药24 h 后收集细胞,提取细胞总RNA;采用RT-PCR 法检测转染后细胞中miR-373-3p 表达水平变化。首先,将RNA 逆转录为 cDNA,并以cDNA 做为模板,U6 为反应过程的内参照,配制20 μL PCR 反应体系,反应步骤:96℃ 10 min,96℃ 20 s,60℃ 57 s,40 cycles。应用 2-ΔΔCT方法计算 miR-373-3p 的 相 对 表 达 量, ΔΔCT =(CTmiR-373-3p-CTU6)实验组-(CTmiR-373-3p-CTU6)对照组。
1.3.5 流式细胞术检测细胞凋亡
肺癌A549 在不同浓度的熊果酸作用下和转染miRNA-373 mimics、miRNA-373 scramble 的 A549 细胞24 h 后,分别收集各组细胞;用4℃ 预冷的PBS磷酸盐缓冲液洗涤细胞 5 遍。参照 Annexin VFITC/PI 双染试剂盒说明书:先用490 μL 缓冲液悬浮细胞,再加入 5 μL Annexin V-FITC 染液,混匀,避光染色15 min;再加入5 μL PI 染液,避光染色5 min。FCM 检测各组细胞的凋亡率。
1.3.6 Western blot 检测凋亡蛋白TXNIP 表达
收集转染miR-373-3p mimics 后的细胞提取总蛋白,BCA 法测定蛋白浓度。将蛋白样品与上样缓冲液混合均匀,95℃,10 min 进行蛋白变性;在10%SDS 聚丙烯酰胺凝胶,200 V 电压下进行蛋白电泳;湿转法将蛋白转移至醋酸纤维素膜,60 min;5%脱脂奶粉,1.5 h,封闭非特异性蛋白;TBST 缓冲液洗涤醋酸纤维素膜,洗涤 5 遍,每遍 10 min;加入TXNIP 一抗(1 ∶2000 稀释),4℃ 过夜;TBST 洗涤 5次,每遍 10 min; HRP 二抗(1 ∶500 稀释) 室温孵育2 h;TBST 洗 5 次,每遍 15 min。ECL 化学发光液显影,Bio-Rad ChemiDoc MP 凝胶成像分析系统扫描胶片。
1.3.7 细胞划痕实验
以0.5×105的细胞数将肺癌A549 细胞接种于6 孔板中,当细胞贴壁后,用10 μL 的小枪头在6 孔板底划痕,然后用PBS 清洗3 次,在显微镜下进行细胞拍照。然后将不同组别的细胞分别在24 h 和48 h 后继续拍照。细胞划痕愈合率(%)= (0 h 划痕宽度- 24 h/48 h 划痕宽度)/0 h 划痕宽度×100%。
1.4 统计学方法
采用SPSS 21.0 软件分析数据,统计数据首先进行正态齐性检测,对符合正态分布的数据用平均数±标准差(±s)进行描述;具备方差齐性时用单因素方差分析,当P<0.05 为差异有统计学意义。
2 结果
2.1 熊果酸对肺癌A549 细胞的活力的抑制效果
熊果酸用DMSO 稀释后,按照如下的浓度梯度作用于A549 细胞。MTT 检测结果显示:与初始浓度 0 μg/mL 相比,熊果酸药物浓度为 40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL 时,对肺癌 A549 细胞的抑制率明显升高(P<0.001),IC50值为60 μmol/L。见图1。
2.2 熊果酸能够显著升高A549 细胞中miRNA-373-3p 的表达
与转染 miRNA-373-3p scramble 组相比, 转染miRNA-373-3p mimic 后,A549 细胞中 miRNA-373-3p 表达显著升高(P< 0.05)。说明瞬时转染miRNA-373-3p mimic 能够明显提高 A549 细胞中miRNA-373-3p mimic 的表达。将 60 μmol/L 的 UA作用于转染miRNA-373-3p mimic 的A549 细胞,与单独 UA 组相比,24 h(16.787±3.109) 和 48 h(16.980±3.106),miRNA-373-3p 表达显著升高(P<0.05)。说明UA 能够使肺癌 A549 细胞内 miRNA-373-3p 的表达上调。见图2。
2.3 miRNA-373-3p 促进肺癌A549 细胞凋亡
流式细胞术分别检测miR-373-3p mimic+熊果酸组(46.20±5.970),miR-373-3p mimic 组(37.50±4.069),熊果酸组(29.10±4.281)以及miRNA-373-3p scramble 组(13.90±3.520)中 A549 细胞的凋亡情况。结果显示:miR-373-3p mimic+UA,miR-373-3p mimic 组,UA 组细胞凋亡均明显增加,并且与单独使用 UA 组和转染 miR-373-3p mimic 组相比,miR-373-3p mimic+UA 组细胞凋亡率明显增加,差异有统计学意义(P< 0.001)。见图3。

注:与 0 μg/mL 组相比,∗∗∗P<0.001。图1 熊果酸作用24 h 对肺癌细胞A549 的抑制作用Note.Compared with 0 μg/mL group,∗∗∗ P<0.001.Figure 1 Inhibitory effect of ursolic acid on lung cancer cell A549 for 24 h

注:A: miR-373-3p scramble 组;B: miR-373-3p mimic 组;C: UA组;D: miR-373-3pmimic+UA 组; 与 miR-373-3p scramble 组相比,∗P<0.05;与 UA 组相比,∗P<0.05。图2 各组细胞中miRNA-373-3p 的表达Note.A, miR-373-3p scramble group.B, miR-373-3p mimic group.C, UA group.D, miR-373-3p mimic+UA group.Compared with miR-373-3p scramble group, ∗P<0.05.Compared with UA group,∗P<0.05.Figure 2 Expression of miRNA-373-3P in each group
2.4 miRNA-373-3p 能够上调TXNIP 基因 mRNA和蛋白表达水平
与miR-373-3p scramble 组相比,miRNA-373-3p+UA 组,miRNA-373-3p 组以及 UA 组肺癌 A549 细胞中TXNIP 蛋白表达水平均明显升高(P<0.05),TXNIP 基因 mRNA 表达也明显升高(P<0.001)。提示:UA 可能通过调控miRNA-373-3p 的表达,作用于肺癌A549 细胞,从而促进凋亡蛋白相关基因TXNIP mRNA 和蛋白水平的表达。见图4,图5,图6。
2.5 miRNA-373-3p 抑制肺癌A549 细胞迁移
细胞划痕实验结果显示: 与 miR-373-3p scramble 组(65.12±3.29%)相比,UA 组(39.23±1.84%)、 miRNA-373-3p 组 (37.25 ± 3.31%) 和miRNA-373-3p+UA 组(34.33±2.08%)在 24 h 和 48 h 后,细胞划痕愈合率有不同程度的降低。差异有统计学意义(P<0.001)。结果表明 miR-373-3p 能够显著抑制肺癌A549 细胞的迁移。见图7。
3 讨论
miR-373 在多种肿瘤中均检测到异常表达,为癌基因或抑癌基因,影响肿瘤细胞的增殖、侵袭、凋亡等生物学,可作为肿瘤早期诊断、治疗靶点或预后监测的指标[15]。有研究[16]表明miR-373 在肝癌中发挥抗肿瘤作用,通过抑制Ras 相关蛋白Rab22a(一种癌蛋白)的表达及信号转导降低肿瘤细胞的增殖和侵袭能力。Huang 等[2]研究发现miR-373 在鼻咽癌中表达下调,通过下调靶基因膜相关环指蛋白5 抑制肿瘤细胞增殖、迁移和侵袭。Adi 等[17]发现miR-373 在肺腺癌组织中表达下调,但具体分子机制尚不清楚。
本研究发现miR-373-3p 在肺癌A549 细胞中低表达,通过流式检测转染 miRNA-373 mimics 的A549 细胞及细胞划痕实验发现,miR-373-3p 可促进肺癌A549 细胞凋亡并抑制细胞迁移,基于此,我们分析miR-373-3p 可能对肺癌A549 细胞的迁移、凋亡有一定调控作用。
熊果酸具有多种生物活性,如具有保肝、抗炎、抗肿瘤等[18-20]。研究发现[14]熊果酸通过下调PTEN/PI3K/AKT 通路下 miRNA-21 的表达,抑制肺癌A549 细胞增殖、迁移和侵袭。最新研究表明[13],熊果酸通过抑制miR-149-5p / MyD88 信号转导降低A549 细胞增殖、分化和转移。本研究发现熊果酸可抑制肺癌A549 细胞活力,显著提高A549 细胞中 miR-373-3p 的表达,此外,与单独熊果酸组和miRNA-373-3p mimic 组比,熊果酸作用于转染 miRNA-373-3p mimic 的 A549 细胞中miRNA-373-3p 表达较高,由此我们推测熊果酸可能通过调控miRNA 分子促进肺癌细胞凋亡并抑制其迁移。
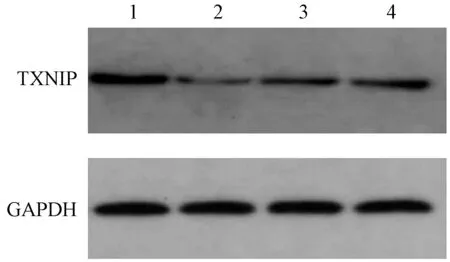
注:1:miRNA-373-3p+UA 组;2:miR-373-3p scramble 组;3:UA组;4:miRNA-373-3p 组。图4 miRNA-373-3p 对肺癌细胞A549 内凋亡蛋白TXNIP 的表达Note.1, miRNA-373-3p+UA group.2, miR-373-3p scramble group.3, UA group.4, miRNA-373-3p group.Figure 4 Expression of the apoptotic protein TXNIP in lung cancer cell A549 by miRNA-373-3P

注:A:miRNA-373-3p+UA 组;B:miR-373-3p scramble 组;C:UA 组;D:miRNA-373-3p 组。与 miR-373-3p scramble 组相比,∗P<0.05。图5 miRNA-373-3p 对肺癌细胞A549 TXNIP 蛋白表达量的影响Note.A, miRNA-373-3p + UA group.B, miR-373-3p scramble group.C, UA group.D, miRNA-373-3p group.Compared with miR-373-3p scramble group, ∗P<0.05.Figure 5 Effect of miRNA-373-3P on the expression of A549 TXNIP protein in lung cancer cells
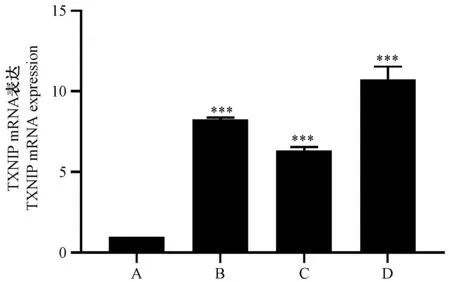
注:A:miR-373-3p scramble 组;B:miR-373-3p mimic 组;C:UA 组;D:miR-373-3pmimic+UA 组。与 miR-373-3p scramble 组相比,∗∗∗P<0.001。图6 TXNIP mRNA 表达的比较Note.A, miR-373-3p scramble group.B, miR-373-3p mimic group.C, UA group.D, miR-373-3p mimic+UA group.Compared with miR-373-3p scramble group,∗∗∗P<0.001.Figure 6 Comparison of TXNIP mRNA expression
研究表明硫氧还蛋白结合蛋白(TXNIP,thioredoxin-interacting protein)在肿瘤细胞中低表达,而且研究发现TXNIP 是潜在的抑癌基因[21],但其抑癌机制尚不明确。Chen 等[22]研究表明TXNIP 是miR-373 诱导上皮间质转化的靶基因,miR-373 通过miR-373-TXNIP-HIF1α-TWIST 信号转导通路促进乳腺癌细胞转移。研究表明[23]组蛋白脱乙酰基酶抑制剂OBP-801 可诱导TXNIP 的蛋白表达抑制肺癌细胞的生长。本课题在肺癌A549 细胞中转染了miR-373-3p 的模拟物,Real-time PCR 结果显示,肺癌A549 细胞miR-373-3p 表达量显著升高。经熊果酸作用后,Real-time PCR 结果显示TXNIP 的表达亦显著升高。因此,推测熊果酸可能通过促进miR-373-3p 诱导 TXNIP 的表达,从而抑制肺癌细胞生长。
综上所述,本课题初步研究显示熊果酸显著促进肺癌 A549 细胞凋亡并且抑制细胞迁移,其作用机制可能是通过上调miR-373-3p 表达抑制肺癌细胞迁移和侵袭,为熊果酸应用于肺癌的基础研究和临床治疗提供实验依据。

注:A:UA 组;B:miRNA-373-3p 组;C:miRNA-373-3p+UA 组;D:miR-373-3p scramble 组。图7 miRNA-373-3p 抑制肺癌A549 细胞的迁移Note.A, UA group.B, miRNA-373-3p group.C, miRNA-373-3p+UA group.D, miR-373-3p scramble group.Figure 7 miRNA-373-3p inhibits the migration of lung cancer A549 cells
