跑台运动对脑卒中后抑郁大鼠抑郁样行为、海马氧化应激及海马CA1 区BDNF 表达的影响
2021-04-19焦健华高珊珊
焦健华高珊珊
(广东理工学院体育系, 广东肇庆 526100)
脑卒中后抑郁症(post stroke depression, PSD)是指脑卒中后出现的以抑郁症状如兴趣丧失、快感缺乏、思维迟缓、情绪低落,甚至有自杀倾向的心境障碍性精神疾病,是脑卒中后常见的并发症之一,发病率占脑卒中患者的40%[1]。Kasahara 等[2]研究认为与单纯脑卒中患者比较,脑卒中后抑郁症患者可出现认知功能障碍、抑郁、沮丧或焦虑等症状,严重危害患者的生存质量使其神经功能的康复延缓,并且脑卒中后抑郁患者死亡的可能性要高出3.4 倍,因此PSD 的预防和治疗成为一个重要的研究领域。
越来越多的研究表明,自由基产生与抗自由基之间的不平衡和机体的抗氧化能力下降,可能是导致神经和精神疾病的病理学基础[3],然而脑氧化应激是否与脑卒中后抑郁行为有关,相关报道较少。海马是边缘系统学习记忆的关键部位,海马CA1 区即是缺血损伤的敏感脑区,也是应激反应的主要靶器官,既介导应激的神经内分泌反应,又参与情感反应等精神活动[4]。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)属于神经营养因子家族成员,广泛分布在海马、纹状体、皮层和杏仁核等部位,对中枢神经系统多种神经元的分化、增殖和成熟具有促进作用。近来研究认为,BDNF 在调节抑郁症等神经系统疾病的发病机制中发挥重要作用,与抑郁及焦虑等行为有关[5]。因此,BDNF可能在PSD 治疗中发挥关键作用。
临床研究发现,规律的运动锻炼可促进脑卒中后抑郁症患者的康复[6]。并且国内学者研究发现,跑台运动可通过增强前额叶皮质抗氧化能力改善睡眠剥夺大鼠抑郁样行为[7]。然而运动锻炼能否通过对抗脑卒中后抑郁症的海马氧化应激及调节海马CA1 区BDNF 的表达改善脑卒中后抑郁大鼠的行为学变化还有待探讨,因此本实验采用大脑中动脉栓塞术( middle cerebral artery occlusion,MCAO) 联合慢性不可预知性应激( chronic unpredictable mild stress, CUMS)建立大鼠 PSD 模型,观察长期跑台运动对PSD 大鼠行为学的影响以及确定这些影响是否与海马氧化应激水平及海马CA1 区BDNF 的变化有关,从分子学角度探讨PSD的发病机制,以期为临床治疗脑卒中后抑郁提供新的思路。
1 材料和方法
1.1 实验动物
3 月龄 SPF 级雄性 SD 大鼠 44 只,体重 230 ~250 g,由华南农业大学实验动物中心提供并饲养[SCXK(粤)2019-0048][SYXK(粤)2019-0136],大鼠饲养环境(12 h 昼:12 h 夜;室温(22±2)℃),整个实验过程中大鼠自由摄食和饮水(MCAO 术前禁食,慢性应激程序实施过程中禁水、禁食除外)。本研究中涉及动物的使用及操作按3R 原则给与动物人道关怀,并经学校实验动物管理伦理委员会批准(IACUC:20180925008)。
1.2 主要试剂与仪器
SOD、MDA 及CAT 检测试剂盒购自南京建成生物工程研究所;兔抗BDNF 多克隆抗体、生物素化羊抗兔IgG、SABC 及DAB 显色试剂盒购自武汉博士德生物有限公司;恒温培养箱(BPX52 型,常州诺基仪器有限公司产品);CX31 型光学显微镜(日本Olympus 公司);JD- 801 型形态学图像分析软件(江苏省捷达科技发展有限公司)。
1.3 实验方法
1.3.1 动物分组
大鼠购回后适应环境1 周后将44 只大鼠随机分为4 组:假手术组(sham,n=11)、卒中组(MCAO,middle cerebral artery occlusion,n=11)、PSD 组(大脑中动脉栓塞+慢性应激MCAO rats treated with CUMS,n=11)、PSD 运动组(PSD+E,PSD rats treated with exercise,n=11)。
1.3.2 大脑中动脉栓塞术
参照Kuts 等[8]方法颈内动脉线栓法制备大鼠MCAO 模型,腹腔注射(10%、350 mg/kg)麻醉大鼠后,大鼠颈部正中切开,镊子钝性分离颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),双重丝线结扎右侧ECA 远心端,在距ICA 分叉近心端0.8~1.0 cm 处斜剪一切口,将经多聚赖氨酸预先处理过的尼龙线圆钝端(直径0.26~0.28 mm)沿切口插入近心端,将尼龙线沿右侧ICA 走向缓慢推进18 ~20 mm 左右,直至尼龙线顶端有轻微阻力。随后,用双重丝线将尼龙线连同CCA 一同结扎,检查无活动性出血后逐层缝合。为了抗感染,每天给MCAO 术大鼠腹腔注射4 万单位青霉素以抗感染,连续注射3 d。
按照Longa 分级标准进行神经功能测定及评分,MCAO 术后24 h,出现大鼠不能完全伸展左侧前爪,提尾爬行时向对侧划圈,且神经功能评分大于1分,提示卒中大鼠模型制备成功。
1.3.3 卒中后抑郁模型(PSD)制备
在卒中模型制备成功饲养1 周后,给予大鼠CUMS[9]制备卒中后抑郁模型。应激刺激共7 种,包括 24 h 禁食、24 h 禁水、昼夜颠倒、5 min 4℃冷水强迫游泳、2 h 束缚应激、5 min 悬尾及20 min 电击足底,每天一种,每周应激顺序随机安排,同种刺激不连续出现,连续4 周。
1.3.4 跑台运动训练方案[10]
① MCAO 术后1 周,PSD 组及PSD 运动组大鼠接受4 周 CUMS 应激刺激;② PSD 运动组大鼠跑台训练前进行3 d 适应性训练,正式训练时,每天下午进行跑台运动,大鼠0 坡度跑台运动4 周,每周5 d、每天30 min,连续运动4 周。跑台运动速度:第1 天5 m/min,第2 天8 m/min,第3 天及以后12 m/min。为避免对大鼠造成不良应激,跑台运动时不使用电击装置驱赶大鼠,PSD 运动组大鼠跑台锻炼同时每天上午接受1 次CUMS 程序,为期4 周;③ 卒中组及假手术组大鼠在整个实验过程中不做任何干扰。
1.3.5 行为学测试
(1) 糖水偏爱实验(sucrose preference test,SPT)
参照Zeldetz 等[11]的方法,单笼饲养大鼠,两个相同的水瓶同时放置在笼中。测试的第1 天,两瓶均装有1%的蔗糖水,24 h 以后,一个瓶内装纯水,另一个瓶装l%的蔗糖水。大鼠被禁食禁水23 h后,进行 SPT 实验,给予大鼠相同体积的两瓶水:一瓶1%的蔗糖水,一瓶纯水。1 h 后,取走两水瓶并测量消耗水量,计算糖水偏爱率 [糖水消耗量/(糖水消耗量+纯水消耗量)×100%]评估大鼠的兴趣水平。
(2)强迫游泳实验(forced swimming test, FST)
FST 用于评估大鼠的绝望状态。测试时,大鼠被单独放在一个透明的塑料圆筒内(高50 cm,直径20 cm)水深 35 cm,水温(25±1)℃。大鼠强迫游泳6 min,两位观察者用秒表记录后4 min 内大鼠在水中的累积不动时间(判断标准:大鼠停止挣扎或呈漂浮状态,四肢动作轻微以保持大鼠头部在水面)。
1.3.6 海马自由基(SOD、CAT、MDA)测试
行为测试结束即刻称重后,大鼠经3% 戊巴比妥钠(80 mg/kg)腹腔注射麻醉后断头处死,打开颅腔将脑组织取出,迅速于冰盘上分离海马,加入4℃生理盐水用玻璃匀浆器制成10% 的海马组织匀浆,离心(转速4000 r/min,时间10 min),取上清液按试剂盒(由南京建成生物工程研究所提供)说明书测定海马超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase, CAT)活性及丙二醛(malondialdehyde, MDA)的含量。
1.3.7 海马CA1 区BDNF 取材与切片
大鼠经腹腔注射戊巴比妥钠(100 mg/kg)深度麻醉,打开胸腔,用4% 多聚甲醛150 mL 常规心脏灌注,开颅取出脑组织,30% 蔗糖溶液后固定。经常规的梯度乙醇脱水、二甲苯固定后浸蜡、石蜡包埋制成蜡块,然后将脑组织连续冠状切片,片厚5 μm,然后进行BDNF 免疫组织化学染色。将石蜡切片置于68℃烤箱中烘烤20 min,常规二甲苯脱蜡2 次,PBS液每5 分钟再冲洗2 次,切片入3% 甲醇双氧水液室温孵育30 min 消除内源性过氧化物酶的活性,37℃孵育1 h,随后滴加BDNF 血清第一抗体100 μL(兔抗大鼠,1 ∶50),4℃ 过夜,PBS 液每5 min漂洗 3 次,随后加入第二抗体50 μL(生物素标记的羊抗兔),37℃ 孵育2 h;接着DAB 室温显色15 min,清洗、贴片,常规梯度乙醇脱水、二甲苯透明,树胶封片。
1.3.8 图像分析
照大鼠脑立体定位图谱随机选取海马CA1 区相同区域的5 个视野,olympus 光学显微镜拍摄海马CA1 BDNF 的表达,利用形态学显微图像分析系统测量海马CA1 区BDNF(400 倍)阳性细胞数。
1.4 统计学方法
所测得的结果采用SPSS 18.0 统计软件包进行统计学分析,各组数据均以平均数±标准差(±s)表示,组间差异均采用单因素方差分析,以P<0.05为具有统计学意义,P<0.01 有显著性统计学意义。
2 结果
2.1 动物存活情况
实验共有4 只大鼠死亡。PSD 组及 PSD 运动组各死亡2 只,死亡原因为注射麻醉过量,造模中死亡及造模后疾病(脑部感染、出血)死亡。
2.2 强迫游泳实验结果
6 min 强迫游泳实验中,与假手术组比较,卒中组大鼠游泳不动时间显著延长(P<0.05);与假手术、卒中组大鼠比较,PSD 组大鼠游泳不动时间显著延长(P<0.01);经过4 周规律跑台运动,与PSD组比较,PSD 运动组大鼠游泳不动时间显著缩短(P<0.05),下降幅度为16%。见表1。
2.3 糖水偏爱实验结果
糖水偏爱实验中,与假手术组比较,卒中组大鼠糖水摄入量、糖水偏爱百分比及液体总消耗量均无显著差异(P>0.05);与假手术组、卒中组比较,PSD 组大鼠糖水摄入量及糖水偏爱百分比均显著减少(P<0.01),液体总消耗量无显著差异(P>0.05);而经过4 周规律跑台运动,与PSD 组比较,PSD 运动组大鼠糖水摄入量及糖水偏爱百分均显著增加(P<0.05,P<0.01),液体总消耗量两组之间无显著差异(P>0.05)。见表2。
2.4 海马自由基水平结果
与假手术组比较,卒中组大鼠海马组织中SOD及CAT 活性均显著下降(P<0.05),MDA 含量增加(P<0.05);与假手术组及卒中组比较,PSD 组大鼠海马组织中SOD 及CAT 活性均明显减弱,MDA 含量增加(P<0.01,P<0.05);经过4 周规律跑台运动,与PSD 组大鼠比较,PSD 运动组大鼠海马SOD及CAT 活性显著增强,MDA 含量显著下降(P<0.05)。见表3。
2.5 海马CA1 区BDNF 表达结果
PSD 组大鼠海马组织中BDNF 阳性细胞胞浆着色很浅,有的细胞呈空泡状。与假手术组比较,卒中组大鼠海马CA1 区BDNF 个数显著减少(P<0.01);与假手术组及卒中组比较,PSD 组大鼠海马CA1 区BDNF 个数显著减少(P<0.01);经过4 周规律跑台运动,与PSD 组大鼠比较,PSD 运动组大鼠海马CA1 区BDNF 个数显著增加(P<0.05)。见表4,图1。
表1 各组大鼠强迫游泳实验结果( ±s)Table 1 Results of forced swimming test in various group rats

表1 各组大鼠强迫游泳实验结果( ±s)Table 1 Results of forced swimming test in various group rats
注:与假手术组比较,ΔΔP<0.05,ΔP<0.05;与卒中组比较,▲▲P<0.01,▲P<0.05;PSD 运动组与 PSD 组比较,#P<0.05。下同。Note.Compared with sham group, ΔΔP<0.05, ΔP<0.05.Compared with MCAO group, ▲▲P<0.01, ▲P<0.05.PSD+E group compared with the PSD group, #P<0.05.The same as below.
分组Groups假手术组(n=11)Sham group卒中组(n=11)MCAO group PSD(n=9)PSD group PSD 运动组(n=9)PSD+exercise group不动时间(s)Immobility time 54.56±8.45 75.56±10.34Δ 114.79±33.45ΔΔ ▲▲ 96.45±15.67ΔΔ ▲#
表2 各组大鼠糖水偏爱实验结果( ±s)Table 2 Results of sucrose preference test in various group rats

表2 各组大鼠糖水偏爱实验结果( ±s)Table 2 Results of sucrose preference test in various group rats
分组Groups n 糖水摄入(mL)Sucrose intake糖水偏爱百分比(%)Sucrose preference ratio液体总消耗量(mL)Total intake假手术组Sham group 11 16.98±3.51 78.24±5.98 21.70±5.10卒中组MCAO group 11 14.65±5.34 72.88±3.56 20.10±3.72 PSD 组PSD group 9 8.30±2.31ΔΔ ▲▲ 41.61±7.21ΔΔ ▲▲ 20.43±4.21 PSD 运动组PSD+E group 9 10.89±3.23Δ ▲# 54.78±4.68Δ ▲## 19.81±4.32
表3 各组大鼠海马组织中SOD、CAT 活性及MDA 含量实验结果( ±s,n=6)Table 3 Results of SOD and CAT activities and MDA content in hippocampus in various group rats
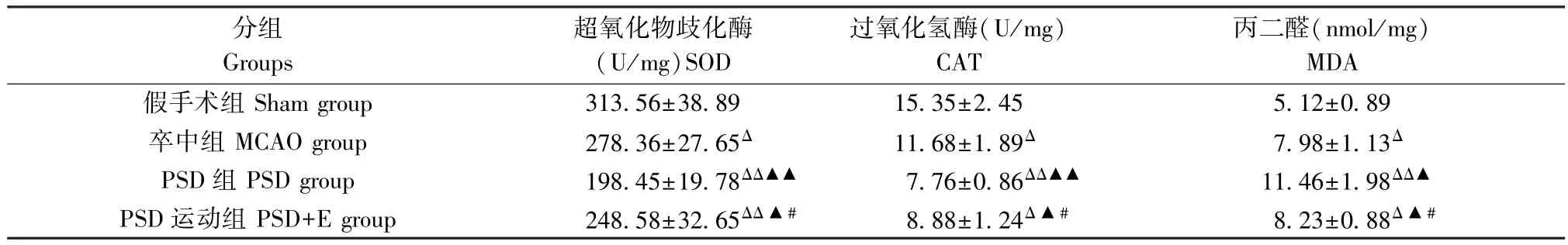
表3 各组大鼠海马组织中SOD、CAT 活性及MDA 含量实验结果( ±s,n=6)Table 3 Results of SOD and CAT activities and MDA content in hippocampus in various group rats
分组Groups超氧化物歧化酶(U/mg)SOD过氧化氢酶(U/mg)CAT丙二醛(nmol/mg)MDA假手术组 Sham group 313.56±38.89 15.35±2.45 5.12±0.89卒中组 MCAO group 278.36±27.65Δ 11.68±1.89Δ 7.98±1.13Δ PSD 组 PSD group 198.45±19.78ΔΔ▲▲ 7.76±0.86ΔΔ▲▲ 11.46±1.98ΔΔ▲PSD 运动组 PSD+E group 248.58±32.65ΔΔ ▲# 8.88±1.24Δ ▲# 8.23±0.88Δ ▲#
表4 各组大鼠海马CA1 区BDNF 表达结果( ±s)Table 4 Results of hippocampus CA1 BDNF expression in various group rats

表4 各组大鼠海马CA1 区BDNF 表达结果( ±s)Table 4 Results of hippocampus CA1 BDNF expression in various group rats
分组Groups n 细胞个数Number假手术组 Sham group 5 51.38±10.54卒中组 MCAO group 5 36.48±7.46ΔΔ PSD 组 PSD group 3 25.64±5.38ΔΔ ▲▲PSD 运动组 PSD+E group 3 34.67±9.64ΔΔ ▲#

注:冠状切面显示大鼠海马CA1 区BDNF 表达(箭头所指)。图1 海马CA1 区BDNF 免疫组化检测结果Note.Coronal sections showing the BDNF expression (arrows) in the hippocampus CA1 of the rats.Figure 1 Results of BDNF immumohistochemical staining in hippocampus CA1
3 讨论
研究认为,卒中后抑郁和焦虑是常见的临床表现,实际上,高达40%的中风幸存者会患焦虑及抑郁症[12]。PSD 大鼠模型的建立不同于单纯抑郁动物模型,必须具备与脑卒中相类似的脑血管缺血的病理基础,同时还要模拟抑郁症的探索活动减少、行为绝望等临床表现。本实验PSD 模型采用大脑中动脉结扎,导致大鼠脑血管缺血的病理改变与临床脑卒中比较接近,大鼠脑缺血后给予慢性不可预知的温和应激,较好的模拟了脑卒中后抑郁患者的病理状态。本实验结果发现,脑卒中大鼠接受28 d CUMS,糖水偏爱实验中大鼠糖水摄入量及糖水偏爱百分比均减少,强迫游泳实验中大鼠挣扎时间延长,提示脑卒中大鼠出现了脑卒中后抑郁症的核心症状快感缺乏及行为绝望。越来越多的证据表明体育锻炼可有效激活神经元从而防止应激引发的精神疾病的发病率,包括抑郁和焦虑[13]。本研究也证实,经过4 周规律的跑台运动,PSD 运动组大鼠强迫游泳实验中挣扎时间延长,不动时间缩短;糖水偏爱实验中大鼠糖水消耗量和糖水偏爱百分比显著增加,提示长期跑台运动可以在一定程度上可改善PSD 大鼠兴趣下降的表现,并能对抗PSD 大鼠的绝望及无助行为。
许多研究表明,急、慢性应激会增强大脑区域的氧化应激损伤,导致氧自由基形成,损害细胞蛋白质,引起DNA 损伤诱导脂质过氧化,导致中枢神经系统氧化应激损伤,与抑郁发生有一定的关系[14]。Ozcan 等[15]通过临床研究发现,与健康人比较,抑郁病人血清SOD 及CAT 活性显著下降。并且动物实验证实,CUMS 导致大鼠焦虑及抑郁样行为与大脑脂质过氧化代谢产物MDA 水平增高有关,因此认为CUMS 对大鼠情绪和行为的有害影响是通过氧化途径介导的[16]。本研究我们聚焦海马组织,结果显示PSD 降低了大鼠海马组织抗氧化防御机制,具体表现在PSD 大鼠海马组织SOD 及CAT活性下降,MDA 含量增加,以上海马组织抗氧化能力下降或许与PSD 大鼠抑郁样行为有关。考虑到有氧运动可以有效的调节不良情绪,而且研究报道有氧运动可以通过调节氧自由基的活性改善应激大鼠抑郁及焦虑行为[17]。本实验对PSD 大鼠进行4 周跑台运动干预,结果发现运动使PSD 大鼠的抗氧化活性酶SOD 及CAT 活性均有一定恢复,MDA含量下降,因此可以认为有氧运动可以通过增强海马组织抗氧化能力改善PSD 大鼠的兴趣下降及绝望无助等抑郁行为。
目前关于卒中患者脑损伤与PSD 发生关系的研究较多,有学者认为脑卒中后海马CA1 退行性病变导致海马功能受损,而海马其他区域如CA3 和齿状回(DG) 被认为对缺血应激具有抵抗性[18]。BDNF 为神经营养素家族的重要成员,在海马表达较多,对多种神经元具有促分化、增殖、营养和成熟的作用,是神经可塑性及神经生长的调节因子,且在脑卒中后抑郁症的发病机理中起重要作用[19]。因此,本研究聚焦海马CA1 区,结果发现,脑卒中大鼠经过28 d CUMS 海马CA1 区BDNF 阳性细胞数量明显低于假手术组及卒中组大鼠,提示BDNF 在脑卒中抑郁的发病中可能发挥了重要作用。Monteggia 等[20]通过强迫游泳及糖水偏爱实验证实小鼠 BDNF 敲除会增强小鼠的抑郁样行为,且BDNF 直接注入到中脑或海马区域会产生类似抗抑郁药的作用。因此,可以推测PSD 大鼠糖水偏爱实验中大鼠表现的奖赏反应下降及强迫游泳实验中表现的悲观、无助等抑郁行为与海马BDNF 的表达减弱有关。越来越多的证据表明,体育锻炼对情绪、压力反应及与压力相关的精神疾病,如抑郁症和焦虑症有很大的保护作用。Luo 等[21]通过强迫游泳实验、糖水偏爱实验及旷场实验发现,4 周跑台运动可改善PSD 大鼠抑郁行为。本研究得到相同结果,4 周跑台运动可增加PSD 大鼠糖水偏爱百分比、强迫游泳实验中挣扎时间延长,说明跑台运动可以改善PSD 大鼠的抑郁样行为。研究认为,抗抑郁药艾司西酞普兰对脑缺血大鼠的神经保护作用可能与海马CA1 区BDNF 增加及氧化应激的降低密切相关[22]。因此可以推测 4 周跑台运动改善PSD 大鼠的抑郁样行为可能与此运动增强海马组织抗氧化能力、上调海马CA1 区BDNF 表达从而对脑卒中抑郁大鼠起到保护作用有关,具体机制需进一步研究。
