西咪替丁对坏死性小肠结肠炎新生大鼠CaMKIV/CREM 通路及肠上皮完整性的影响
2021-04-19孙子梅林晓燕苏琴毕胜利
孙子梅林晓燕苏 琴毕胜利
(河北北方学院附属第二医院儿科,河北张家口 075100)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)属新生儿最常见亦是最严重的胃肠急症,起病急、病情重且预后差[1];其中肠道黏膜屏障受损导致肠上皮完整性遭到破坏,严重的氧化应激状态可增加肠黏膜通透性,引起炎症失衡、免疫紊乱、炎症水肿等,造成多器官衰竭[2],危害严重。因此,恢复肠上皮完整性对于缓解疾病至关重要。西咪替丁作为临床上治疗NEC 药物,可降低胃肠道酸度、维持肠道内环境,从而治疗NEC[3],对于改善肠黏膜具有极好疗效,但具体机制尚不明确。钙调蛋白依赖性蛋白激酶IV(CaMKIV)作为免疫调控因子,其激活可促进促炎细胞因子的表达和加重结肠炎的组织学特征[4];环磷酸腺苷反应元件调节蛋白(cyclic AMP response element modulator, CREM)作为CaMKIV 下游基因,在真核生物细胞核中普遍存在,与细胞生长、发育、分泌等多因素相关[5]。推测西咪替丁通过CaMKIV/CREM 通路缓解肠黏膜屏障。因此,建立 NEC 新生大鼠模型,西咪替丁、CaMKIV 抑制剂KN62 分别处理 NEC 新生大鼠,观察二者对NEC 新生大鼠的影响,从而初步探讨西咪替丁对NEC 新生大鼠的保护机制。
1 材料和方法
1.1 实验动物
5 只健康SD 孕鼠购自北京维通利华实验动物技术有限公司[SCXK(京)-2017-0033], 大鼠于我院进行适应性饲养[SYXK(京)-2018-0009],清洁级,自然分娩,同日出生体重>5 g 新生大鼠32 只为研究对象,雌雄不限。在温度(24±1)℃、12 h 光照/12 h 黑暗、通风良好的环境中自由饮水摄食,所有实验均经本院动物实验伦理委员会批准(18020052),每组8 只大鼠即可满足实验要求,且最大限度利用实验动物,即对同一动物采血、取肠组织实验,实验满足3R 原则。
1.2 主要试剂与仪器
西咪替丁注射液(上海第一制药厂,批号:1-1229-81,规格:0.2 g/2 mL);CaMKIV 抑制剂KN62(美国Sigma 公司,批号:S742201);异硫氰酸荧光素-葡聚糖(fluorescein isothiocyanate-Dextran,FITCDextran)40×103(美国 Chondrex 公司,货号:4009);苏木素-伊红(hematoxylin-easine, HE)染色试剂盒(武汉百浩天生物科技有限公司,货号:C0490);大鼠血小板活化因子(Platelet-activating factor, PAF)酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒(上海西唐生物科技有限公司,货号:F16500);大鼠肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒,一抗兔抗 CaMKIV、CREM、GAPDH(英国 abcam 公司,货号分别为:ab100785、ab3557、ab5803、ab181602)。缺氧箱(青岛艾普智能仪器有限公司,型号:XBS-08B);荧光分光光度计(北京吉天仪器有限公司,型号:Kylin S18);蛋白凝胶成像系统(上海Tanon 公司,型号:2500)。
1.3 实验方法
1.3.1 动物造模
实验分为对照组、模型组、西咪替丁组和CaMKIV抑制剂组,每组8 只。代乳参考文献[6]报道配制,所有新生大鼠口插管灌胃代乳,首次灌胃0.1 mL,4 h 灌胃一次,隔天增加0.1 mL,最大不超过0.3 mL。
除对照组外其余各组参考文献[7]建立NEC 新生大鼠模型,新出生1 d 大鼠置于纯氮气的缺氧箱中3 min后取出,立即置于100%氧气浓度的氧舱中3 min,然后立即置于4℃冰箱中刺激10 min,每日早9 点和晚9 点分别缺氧+复氧+冷刺激各一次,连续3 d。对照组置于保育箱中,温度 28℃ ~30℃,湿度45%~55%。每日处理后西咪替丁组根据人与大鼠体表面积换算[8]静脉注射30.5 mg/kg 西咪替丁[9],CaMKIV 抑制剂组插管灌胃0.72 mg/kg KN62[10],对照组和模型组静脉注射和灌胃生理盐水,连续3 d。
1.3.2 观察大鼠临床情况
实验结束禁食12 h,观察大鼠情况,包括活动量、反应状况、喂养情况等。
1.3.3 FITC-Dextran 示踪法检测肠道通透性
观察完大鼠临床情况后经胃灌入20 mg/mL FITC-Dextran(40 mg/kg),4 h 后断头取血,血液抗凝,3000 r/min 离心10 min,参考 FITC-Dextran 试剂盒,荧光分光光度计检测荧光强度,激发光波长480 nm,发射长光波520 nm。根据标准曲线计算样品浓度[11]。
1.3.4 HE 染色观察肠组织病理学变化
取盲部近端回肠组织,部分置于4%多聚甲醛中固定,部分置于-80℃冰箱保存。肠道经4%多聚甲醛固定24 h,梯度乙醇脱水、二甲苯透明等步骤后包埋切片,经苏木精染色、伊红复染后显微镜下观察肠组织形态。
参考Nadler 等[6]标准进行组织学评分,0 分时肠粘膜绒毛正常;1 分时黏膜下层或固有层出现轻度分离;2 分时黏膜下层或固有层出现中度分离,或黏膜下层和肌层出现水肿;3 分时黏膜下层或固有层出现重度分离,或黏膜下层和肌层出现严重水肿;4 分时肠壁全部坏死。组织学评分≥2 时为NEC。
1.3.5 ELISA 检测大鼠肠组织中 PAF、TNF-α 水平
-80℃冰箱中取部分肠组织,9 倍生理盐水制成匀浆液,4℃ 3000 r/min 离心20 min,取上清液,严格按照大鼠PAF、TNF-α ELISA 试剂盒检测肠组织中 PAF、TNF-α 水平。
1.3.6 蛋白免疫印迹检测大鼠肠组织中CaMKIV、CREM 蛋白水平
-80℃冰箱中取部分肠组织,手术剪剪碎后每管加1 mL 蛋白裂解液冰上研磨,冰上裂解20 min,4℃、13000 r/min 离心20 min,上清液即为肠组织总蛋白。凝胶电泳分离蛋白质,PVDF 膜280 mA、60 min 转膜,5%脱脂奶粉室温封闭 2 h,加入一抗CaMKIV、CREM、GAPDH 4℃孵育过夜,加入二抗室温孵育1 h。蛋白凝胶成像系统拍照和定量分析。
1.4 统计学方法
SPSS 22.0 软件进行统计学分析,非正态分布计量数据以中位数(四分位间距)表示,多组间比较采用Kruskal-WallisH检验,组间进一步两两比较采用Nemenyi 检验;正态分布计量数据均用平均数±标准差(±s)表示,多组间比较用单因素方差分析,组间两两比较采用SNK-q法。P<0.05 差异有统计学意义。
2 结果
2.1 西咪替丁对大鼠临床症状的影响
对照组活动正常,饲养正常,进食排便均正常,大便成形;模型组出现活动减少、反应迟钝现象,喂养时出现不耐受现象,大便形状改变;西咪替丁组和CaMKIV 抑制剂组较模型组活动量有所增加,但仍有反应迟钝现象,喂养状态缓和。
2.2 西咪替丁对大鼠肠道通透性影响
与对照组相比,模型组肠道FITC-Dextran 水平升高(P<0.05);与模型组相比,西咪替丁组、CaMKIV 抑制剂组肠道FITC-Dextran 水平降低(P<0.05)。(见表1)
2.3 西咪替丁对大鼠肠组织形态学影响
对照组大鼠肠壁色泽红润、富有弹性,显微镜下绒毛完整、排列整齐,肠壁结构正常;模型组肠壁充气扩张、弹性差,部分出现穿孔现象,显微镜下观察到黏膜下层或固有层分离严重,绒毛脱落、腺体紊乱;西咪替丁组和CaMKIV 抑制剂组肠壁充气扩张,但不严重,显微镜下观察黏膜下层或固有层部分分离,出现部分绒毛脱落现象。(图1)
表1 4 组大鼠肠道FITC-Dextran 水平比较( ±s,n=8)Table 1 Comparison of intestinal FITC-Dextran levels in 4 groups of rats
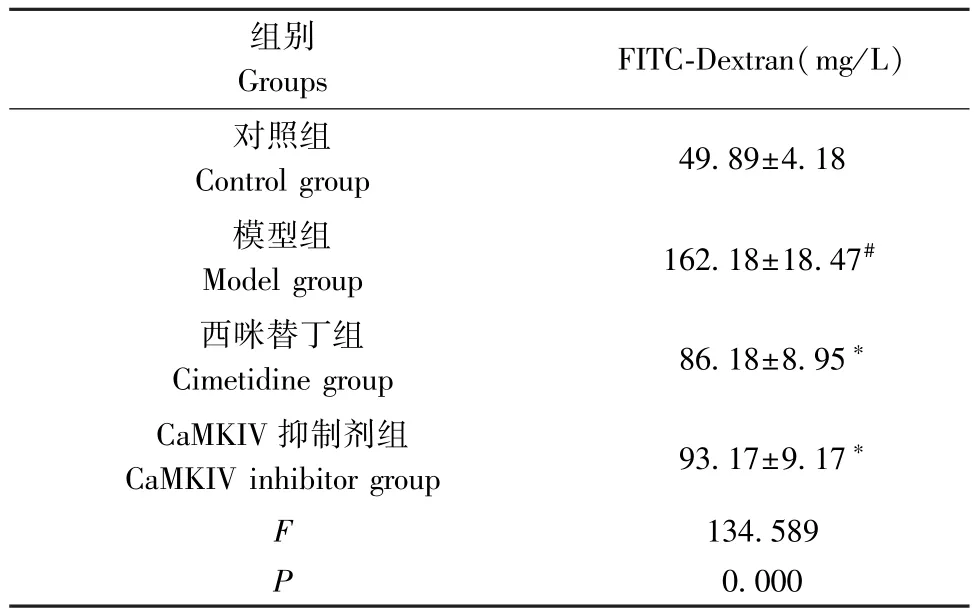
表1 4 组大鼠肠道FITC-Dextran 水平比较( ±s,n=8)Table 1 Comparison of intestinal FITC-Dextran levels in 4 groups of rats
注:与对照组相比,#P<0.05;与模型组相比,∗P<0.05。Note.Compared with the control group, #P<0.05.Compared with the model group, ∗P<0.05.
组别Groups FITC-Dextran(mg/L)对照组Control group 49.89±4.18模型组Model group 162.18±18.47#西咪替丁组Cimetidine group 86.18±8.95∗CaMKIV 抑制剂组CaMKIV inhibitor group 93.17±9.17∗F 134.589 P 0.000
与对照组相比,模型组大鼠肠组织组织学评分升高(P<0.05);与模型组相比,西咪替丁组、CaMKIV 抑制剂组大鼠肠组织组织学评分降低(P<0.05)。(表2)
2.4 西咪替丁对大鼠肠组织中PAF、TNF-α 水平的影响
与对照组相比,模型组肠组织中PAF、TNF-α 水平升高(P<0.05);与模型组相比,西咪替丁组、CaMKIV 抑制剂组肠组织中 PAF、TNF-α 水平降低(P<0.05)。(见表3)
2.5 西咪替丁对大鼠肠组织中CaMKIV、CREM蛋白水平的影响
与对照组相比,模型组肠组织中CaMKIV、CREM 蛋白水平升高(P<0.05);与模型组相比,西咪替丁组、 CaMKIV 抑制剂组肠组织中CaMKIV、CREM 蛋白水平降低(P<0.05)。(见图2、表4)
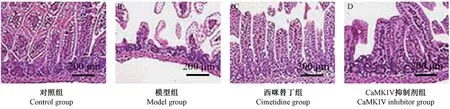
注:A:对照组;B:模型组;C:西咪替丁组;D:CaMKIV 抑制剂组。图1 4 组大鼠肠组织形态学变化Note.A, Control group.B, Model group.C, Cimetidine group.D, CaMKIV inhibitor group.Figure 1 Morphological changes of intestinal tissue in 4 groups of rats
表2 4 组大鼠肠组织组织学评分比较( ±s,n=8)Table 2 Comparison of intestinal histology scores of 4 groups of rats
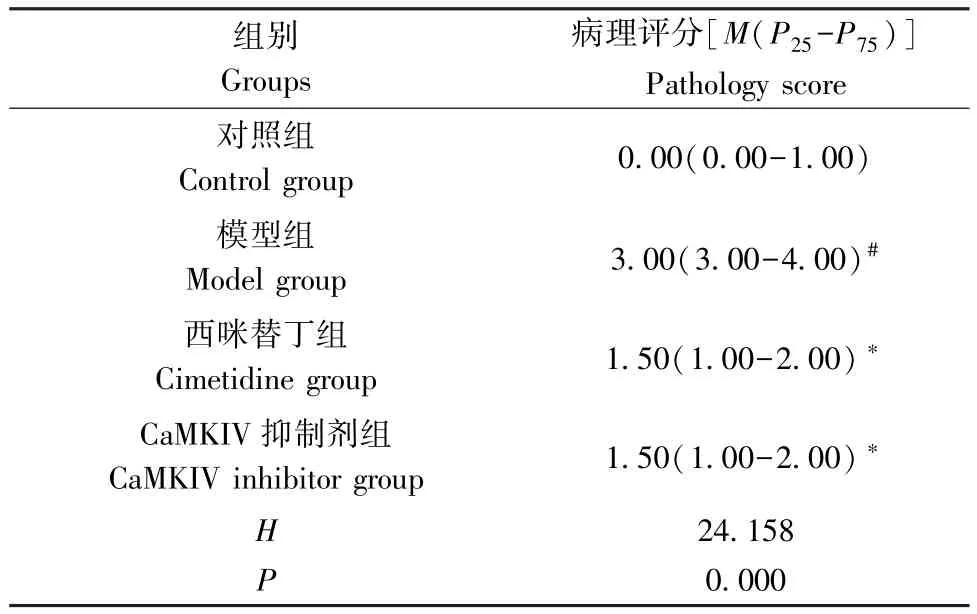
表2 4 组大鼠肠组织组织学评分比较( ±s,n=8)Table 2 Comparison of intestinal histology scores of 4 groups of rats
注:与对照组相比,#P<0.05;与模型组相比,∗P<0.05。Note.Compared with the control group, #P<0.05.Compared with the model group, ∗P<0.05.
组别Groups病理评分[M(P25-P75)]Pathology score对照组Control group 0.00(0.00-1.00)模型组Model group 3.00(3.00-4.00)#西咪替丁组Cimetidine group 1.50(1.00-2.00)∗CaMKIV 抑制剂组CaMKIV inhibitor group 1.50(1.00-2.00)∗H 24.158 P 0.000
表3 4 组大鼠肠组织中 PAF、TNF-α 水平比较( ±s,n=8)Table 3 Comparison of PAF and TNF-α levels in intestinal tissues of 4 groups of rats
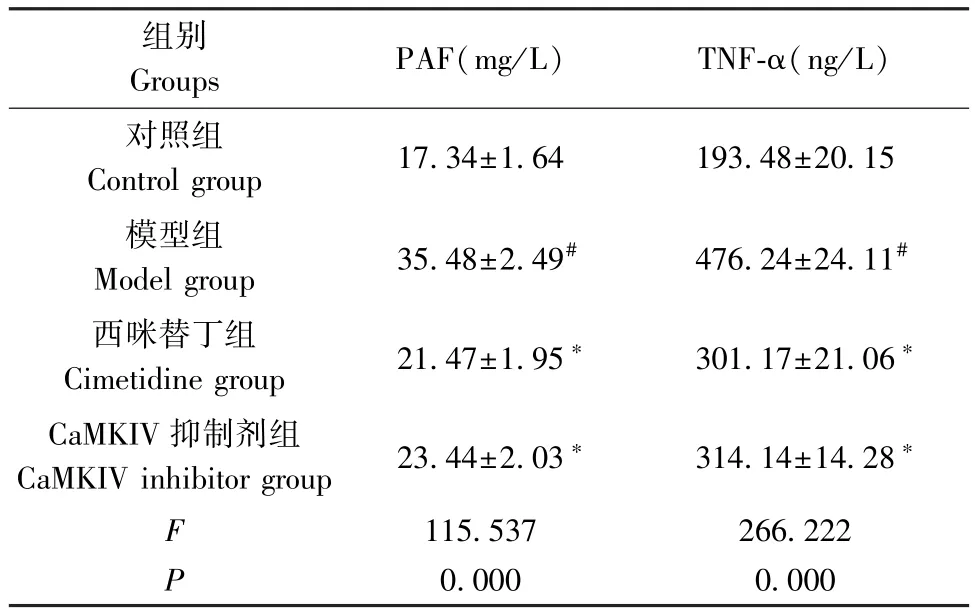
表3 4 组大鼠肠组织中 PAF、TNF-α 水平比较( ±s,n=8)Table 3 Comparison of PAF and TNF-α levels in intestinal tissues of 4 groups of rats
注:与对照组相比,#P<0.05;与模型组相比,∗P<0.05。Note.Compared with the control group, #P<0.05.Compared with the model group, ∗P<0.05.
组别Groups PAF(mg/L) TNF-α(ng/L)对照组Control group 17.34±1.64 193.48±20.15模型组Model group 35.48±2.49# 476.24±24.11#西咪替丁组Cimetidine group 21.47±1.95∗ 301.17±21.06∗CaMKIV 抑制剂组CaMKIV inhibitor group 23.44±2.03∗ 314.14±14.28∗F 115.537 266.222 P 0.000 0.000
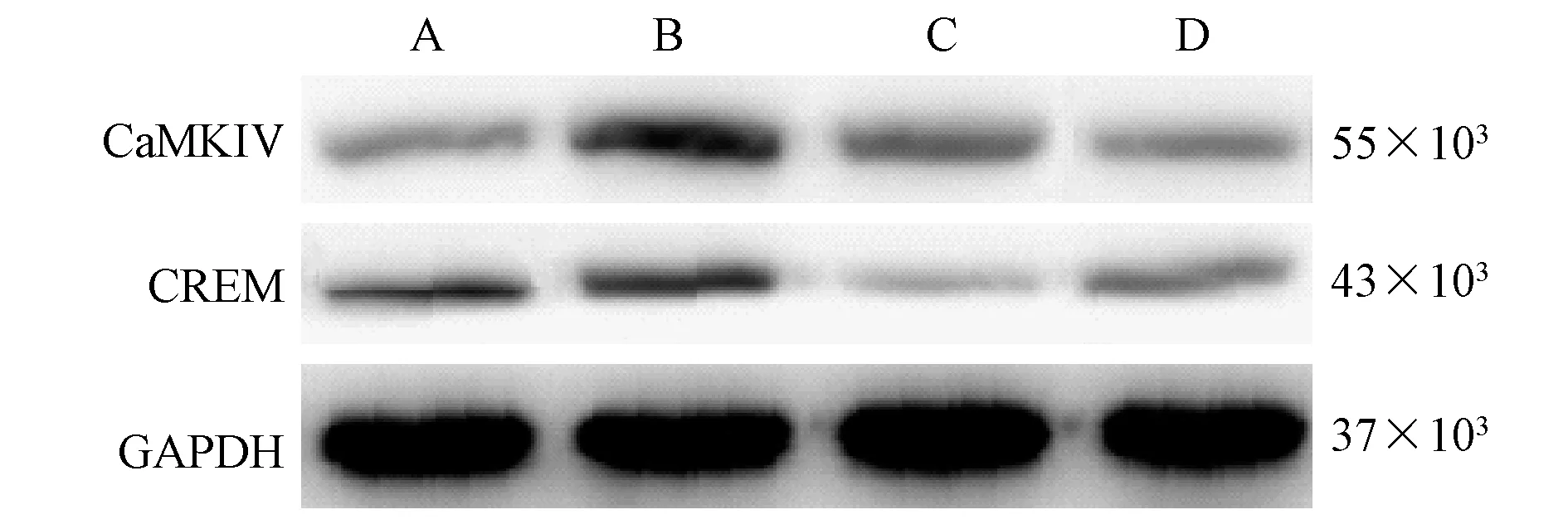
注:A:对照组;B:模型组;C:西咪替丁组;D:CaMKIV 抑制剂组。图2 4 组大鼠肠组织中CaMKIV、CREM 蛋白表达情况Note.A, Control group.B, Model group.C, Cimetidine group.D,CaMKIV inhibitor group.Figure 2 Expression of CaMKIV and CREM protein in intestinal tissues of 4 groups of rats
表4 4 组大鼠肠组织中CaMKIV、CREM 蛋白水平比较( ±s,n=8 )Table 4 Comparison of CaMKIV and CREM protein levels in intestinal tissues of 4 groups of rats
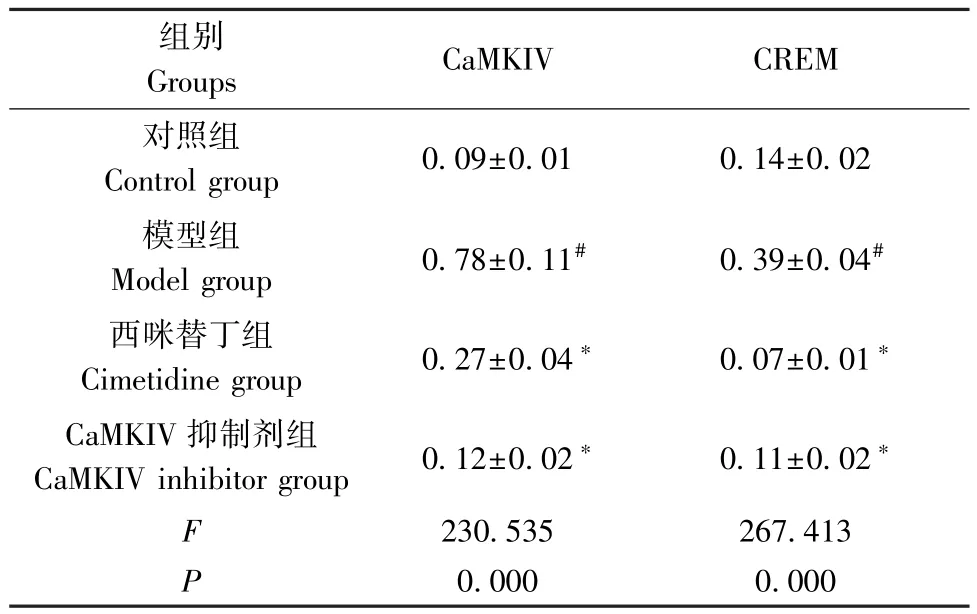
表4 4 组大鼠肠组织中CaMKIV、CREM 蛋白水平比较( ±s,n=8 )Table 4 Comparison of CaMKIV and CREM protein levels in intestinal tissues of 4 groups of rats
注:与对照组相比,#P<0.05;与模型组相比,∗P<0.05。Note.Compared with the control group, #P<0.05.Compared with the model group, ∗P<0.05.
组别Groups CaMKIV CREM对照组Control group 0.09±0.01 0.14±0.02模型组Model group 0.78±0.11# 0.39±0.04#西咪替丁组Cimetidine group 0.27±0.04∗ 0.07±0.01∗CaMKIV 抑制剂组CaMKIV inhibitor group 0.12±0.02∗ 0.11±0.02∗F 230.535 267.413 P 0.000 0.000
3 讨论
NEC 肠黏膜屏障受损可能引起细胞因子分泌异常、肠黏膜出现萎缩、通透性增加、肠道菌群改变等,导致炎症反复发作及加重,致使其功能受损,导致病情加重[12]。肠黏膜功能障碍与肠道免疫系统激活有关,肠黏膜免疫细胞诱发强烈的免疫应答产生大量的炎症因子,炎症因子激活通路,引发肠黏膜炎症反应;炎症因子过度释放不断积累,可导致毒性作用产生,产生自身免疫反应导致损伤和肠黏膜渗透性改变,形成恶性循环[13-14]。在本研究中发现,模型组新生大鼠活动减少、反应迟钝,喂养时出现不耐受现象,大便形状改变;肠壁充气扩张、弹性差,部分出现穿孔现象,显微镜下观察到黏膜下层或固有层分离严重,绒毛脱落、腺体紊乱;肠道FITC-Dextran 水平升高,提示NEC 大鼠从形态上观察活动量减少、且出现反应迟钝现象,饲养出现不耐受现象,肠道出现弹性差、通透性增大现象肠黏膜下层与固有层分离严重、绒毛损伤严重,不利于营养物质的吸收。西咪替丁可缓解肠黏膜刺激,加速绒毛修复;亦可产生炎症抑制剂,缓解肠黏膜水肿炎症现象;亦具有调控免疫功能和抗病毒作用,从而治疗NEC[15]。本研究发现,与模型组相比,西咪替丁组新生大鼠活动量、反应状态均有所缓解,虽然肠壁充气扩张但不严重,肠黏膜下层或固有层部分分离缓解,只出现部分绒毛脱落现象,提示西咪替丁可通过改善肠上皮结构缓解新生大鼠状态,从而实现对NEC 新生大鼠的保护。
PAF 和 TNF-α 是 NEC 中常见炎症因子,PAF可在炎症信号如吞噬作用、趋化性等条件下合成,在炎症反应中作为重要介质,可激活氧自由基释放、趋化嗜酸性粒细胞、TNF-α 等,引起血管扩张和通透性增加,参与胃肠粘膜损伤炎症过程,从而造成机体损伤[16];TNF-α 可受多因子刺激,与PAF 有类似的病理生理作用,可激活各类炎症因子、增加血管通透性、激活巨噬细胞和中性粒细胞释放大量蛋白酶和氧自由基,亦可刺激PAF 产生[17]。本研究发现,与对照组相比,模型组肠组织中PAF、TNF-α 水平升高,提示NEC 新生大鼠肠道组织中出现严重的炎症现象,可激活氧自由基释放、趋化嗜酸性粒细胞等,引起肠组织血管扩张和通透性增加,造成肠黏膜出现炎症损伤。
CaMKIV 作为钙离子通道主要成员之一,参与基因转录的调控过程,可调控多种生物学功能,包括神经信息传递、记忆过程,胚胎形成、发育过程,细胞增殖、凋亡过程、基因表达过程等,影响广泛[18],敲低CaMKIV 可选择性抑制促炎细胞因子、趋化因子的表达,并可消除分化的肌管中干扰素-γ诱导的CREM 的表达[19]。而 CREM 作为多条信号通路交汇点,其水平增高可导致细胞因子如TNF-α的异常表达、抑制细胞生长因子水平,抑制细胞分化、再生、损伤及修复功能,从而增加疾病风险[20]。本研究发现,与对照组相比,模型组肠组织中CaMKIV、CREM 蛋白水平升高,提示NEC 肠组织中CaMKIV 水平处于高水平状态,一方面 CaMKIV 可促进炎症因子PAF、TNF-α 的表达,增加肠道血管通透性、增加肠道巨噬细胞和中性粒细胞的释放,另一方面可作用于CREM,亦可直接诱导TNF-α 等表达,加重疾病进程。与模型组相比,西咪替丁组、CaMKIV 抑制剂组肠组织中CaMKIV、CREM 蛋白水平降低,提示西咪替丁与CaMKIV 抑制剂功能类似,均可抑制CaMKIV/CREM 通路的表达,从而降低肠黏膜炎症、肠血管通透性从而缓解疾病。
综上所述,西咪替丁可能抑制CaMKIV/CREM通路,减轻肠黏膜炎症反应、改善肠血管通透性,实现对NEC 肠上皮的保护。但西咪替丁成分复杂,亦可能通过别的通路实现对NEC 的保护,是本文进一步研究重点。
