基于高通量测序分析玉米黄酒微生物多样性
2021-04-19李永翔蒋海娇郭建华
李永翔,蒋海娇,郭建华
(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006)
我国黄酒历史悠久,是世界三大古酒之一,它主要以谷物(稻米、小米、玉米)为原料,利用曲药作为糖化发酵剂进行酿造,曲中所含微生物种类繁多,既有细菌,也有霉菌、酵母等[1]。因此,研究玉米黄酒在发酵过程中微生物群落结构及组成,能够帮助我们更好地揭示在发酵过程中菌群的结构变化,为今后分析微生物对于黄酒酒质的影响打下基础。
此前,有关微生物群落及其多样性的研究主要基于传统的微生物分离及纯培养技术、荧光定量 PCR技术[2]、变性梯度凝胶电泳技术(DGGE)[3]、末端限制性片段长度多态性分析技术(TRFLP)[4]等。但上述研究方法往往难以得到确切的微生物种类及其绝对含量。高通量测序技术作为新一代测序方法,在微生态领域有着广泛应用前景。聂志强等采用高通量测序技术对食醋酿造过程中的原核微生物群落结构进行了分析,发现醋酸发酵过程中醋酸菌和乳酸菌是优势细菌,而随着发酵的进行,醋酸菌的丰度不断增加,乳酸菌却在不断减少[5]。赵景龙等用MiSeq 高通量测序平台对清香型白酒发酵酒醅不同位点的细菌进行了分析,发现在不同位置酒醅中优势细菌相差较大,中心部位主要是Lactobacillaceae、Streptococcaceae 等厌氧或兼性厌氧细菌,靠近边沿处则以好氧细菌居多[6]。本研究采用高通量测序技术对玉米黄酒发酵各个阶段的群落结构及其变化规律进行研究,旨在为探索玉米黄酒酿制过程提供一定的理论依据,为后续研究提供参考。
1 实验部分
1.1 材料
玉米采用齐齐哈尔本地种植品种,酒曲(购自广西某地)。
1.2 方法
将干玉米脱胚破碎成直径为2~5 mm 的颗粒,然后在55~60 ℃的水浴下,用质量分数为0.15%~0.20%亚硫酸溶液浸泡50 h。蒸熟晾凉后接入曲种,前3 天在30 ℃下糖化发酵,之后投水在16 ℃条件下发酵,在发酵的第5 天进行密封发酵。分别在发酵0, 3, 6, 12, 18, 24 d 取样(下文样本标作0, 1, 2, 3, 4, 5),所有样品-80 ℃保存,后送往上海凌恩生物科技有限公司,对样品341F-806R 和ITS1F-ITS2R 区进行高通量测序,测序引物为341F,806R 以及ITS1F,ITS2F。引物序列为5’-CCTAYGGGRBGCASCAG-3’,5’- GGACTACNNGGGTATCTAAT-3’和5’-CTTGGTCATTTAGAGGAAGTAA-3’,5’-GCTGCGTTCTTCATCGATGC-3’。利用Illumina(MiSeq)平台对获得的序列进行归并分类。
根据测序结果进行多样性分析及组件样本差异,根据每个样本在各个分类水平下具体组成,分析不同发酵时期样本的群落组成及其动态变化,并找出可能对玉米黄酒品质有重要影响的菌群。
2 结果与讨论
2.1 OTU 聚类统计
通过高通量测序技术,在黄酒发酵各个阶段的稀疏曲线如图1 所示。
从图1 可以看出,随着测序量的增加,稀释曲线逐渐趋于平缓,说明测序数据量合理,更多的数据量只会产生少量新的OTU,这反映了目前测序数量已满足了样本的多样性。
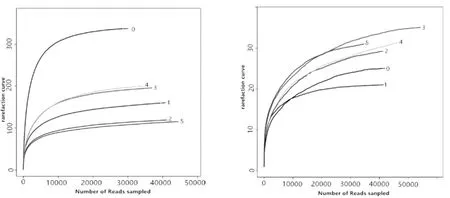
图1 黄酒发酵过程中细菌与真菌稀疏曲线
2.2 菌群多样性分析
使用Mothur 软件以97%相似度进行归并分析,利用得出的OTU 数进行多样性分析。从表1 中可以看出细菌Chao 值先下降,中期上升后再下降的趋势,显示出在发酵最初期时物种丰度最高,原因在于传统黄酒发酵工艺中,原料水并不需要灭菌操作,而且在前期搅拌过程中,器具及外界空气也带入了一部分微生物进入,随着发酵时间的持续,发酵产生的CO2使得微生物处于缺氧的环境,同时某些微生物代谢产生有机酸使pH 逐渐下降,酒精度逐渐上升,在这种不适宜微生物生长的条件下,会抑制绝大部分微生物的生长繁殖。Shannon 值的下降和Simpson 值的逐渐升高反映了群落的多样性越来越低。
从真菌中可以看出Chao1 值先上升后下降,说明了在发酵中期物种最为丰富。Shannon 值先上升后下降,Simpson 值先下降后上升,说明了中期真菌多样性较高,而在发酵末期菌群结构越发简单。原因在于发酵末期微生态环境变化使得真菌的繁殖受到了抑制,降低了物种的多样性。

表1 玉米黄酒发酵不同阶段的细菌(a)和真菌(b)Alpha 多样性
2.3 菌群结构及动态变化
2.3.1 门,属分类水平下的细菌群落结构
通过RDP Classifier 软件对OTU 物种比对注释显示,玉米黄酒发酵过程中的细菌主要属于6 个菌门,26 个属。
在门分类水平下,变形菌门(Proteobacteria)细菌在发酵的全过程下始终属于绝对优势菌群,其丰度占到整个菌群的66.49%~86.91%。虽然拟杆菌门(Bacteroidetes)是第二大菌门,但其平均占比仅有9.96%~13.03%。此外放线菌门(Actinobacteria)占比只有1.99%~10.83%,排在第三。这表明,在玉米黄酒发酵全过程中,细菌的群落结构高度不一。
在属分类水平下,细菌群落结构均一性同样很低。本次检测得到239 个菌属,但其中只有前26 个属的相对丰度大于整个菌群的1%。随着发酵的进行,贪噬菌属(Variovorax)、慢生根瘤菌属(Bradyrhizobium)、产氢菌属(Hydrobacter)、鞘氨醇单胞菌属(Sphingomonas)一直处于相对优势占比。而其他菌属在菌群占比均比较低,且在整体发酵过程中相对丰度变化不明显,说明发酵环境抑制了其生长,大部分的微生物不能在高酸度,高乙醇浓度及厌氧环境下生存而逐渐消亡。

图2 细菌在门水平(a)和属水平(b)群落组成丰度分布图
2.3.2 门,属分类水平下的真菌群落结构
对黄酒发酵液中的真菌群落进行鉴定分析,结果显示其真菌主要属于2 个菌门,4 个属。在门分类水平下,子囊菌门(Ascomycota)占据绝对优势,其相对丰度占比为97.43%~99.49%。担子菌门(Basidiomycota)占比0.35%~2.61%。这也与栾同青[9]的研究结果相似[7]。
在属分类水平下,曲霉属(Aspergillus)占比为18.09%~77.70%,塞伯林德纳氏酵母属(Cyberlindnera)占比为21.73%~75.35%,Kwoniella 属占比为0.23%~2.05%,威克汉姆酵母属(Wickerhamomyces)占比为0.01%~3.56%。曲霉菌属真菌在黄酒发酵过程中起到液化、糖化、蛋白质分解的效果,同时形成还原糖、氨基酸、多肽等[8]。酵母菌属在黄酒生产中产酯、产醇、产有机酸等风味物质,主要起生香作用[9]。
真菌的菌群结构简单是由多方面因素造成的,如酵母菌发酵产生的酒精会对自身和其他真菌有毒害作用,曲霉属代谢产生的有机酸也会使真菌的生长环境发生改变,使其不宜生长繁殖。

图3 真菌在门水平(a)和属水平(b)群落组成丰度分布图
3 结论
本次研究表明在发酵过程中细菌种类要比真菌丰富。对微生物相对丰度进行统计表明,变形菌门是黄酒发酵液中绝对优势细菌,还有其它菌属如拟杆菌门和放线菌门。而子囊菌门则是优势真菌,曲霉属和酵母属也被检测到。在属水平下贪噬菌属、慢生根瘤菌属、产氢菌属、鞘氨醇单胞菌属占比细菌属较高,而曲霉属、塞伯林德纳氏酵母在真菌属中占比较高。微生物直接影响着黄酒的品质和风格,因此针对微生物的研究将永不止步。
