剪切变稀水凝胶应用于内镜下胃黏膜下注射及剥离术的实验研究
2021-04-17赵黎黎范志宁
王 兰,王 敏,赵黎黎,范志宁,王 翔
0 引 言
内镜下黏膜切除术(endoscopic mucosal resection, EMR)、内镜下黏膜下剥离术(endoscopic submucosal dissection, ESD)已被广泛应用于消化道息肉、腺瘤及早癌的治疗[1-3]。随之衍生出的经黏膜下隧道内镜肿瘤切除术(submucosal tunneling endoscopic resection, STER)能够更微创、有效地切除黏膜下肿瘤[4]。与外科手术不同,内镜下操作从黏膜层出发寻找手术入路。由于消化道黏膜较薄,内镜操作时间长,因此内镜治疗中存在穿孔、出血、热损伤等风险[5]。良好的黏膜下注射液形成黏膜下液体垫,充分抬举病灶,可有效预防和减少内镜手术的并发症[6]。
海藻酸钠是一种天然高分子多糖,具有良好的增稠性、稳定性和生物相容性[7]。锂镁硅酸盐(laponite)是一种人工合成的来源于无机物的片状硅酸盐,它在搅拌下很容易分散于水中,形成透明无色的高黏度胶体分散液。Laponite具有良好的流变性能,即快速的剪切变稀,因此通常被用作流变学改性剂及增加剂[8-9]。Pang等[10]以这两种处理分合成了一种新型的剪切变稀水凝胶,并与等渗盐水进行对比,证明其可形成良好的黏膜下隆起,有希望成为辅助内镜下肠道息肉精准切除的新型材料。
在此基础上,本研究应用这两种组分进行浓度优化,以透明质酸钠作为对照,探索其用于胃部黏膜下注射的可行性及有效性,并进一步研究其辅助电刀黏膜下剥离术的有效性。
1 材料与方法
1.1 实验材料与试剂海藻酸钠(上海国药集团),Laponite-XLG(BYK公司),靛胭脂(上海麦克林公司),透明质酸钠(上海麦克林公司),等渗盐水(上海百特医疗用品有限公司)、新鲜离体猪胃,离体时间距实验时间不超过12 h。
1.2实验器械加热磁力搅拌器(IKA©C-MAG HS 7)、旋转流变仪(MCR302)、ZG30型高频电刀(威海众恒医疗设备有限公司)、扫描电镜(S-3400N)、Olympus公司23G镜下注射针、玻璃搅拌棒、注射器、常规手术器械、泡沫板、直尺、游标卡尺、计时器。
1.3实验方法
1.3.1 水凝胶的制备海藻酸钠粉剂中加入去离子水,置于加热磁力搅拌器40 ℃,1000 r/min搅拌1 h,直至白色固体消失,配置成0.2%的海藻酸钠水溶液作为原液。将不同剂量的laponite粉末加入原液中,滴入少量0.04%靛胭脂作为染色剂,用玻璃棒充分搅拌,得到laponite浓度为1%、2%、3%、4%、5%的水凝胶。用5 mL注射器对凝胶进行分装备用。
1.3.2水凝胶的扫描电镜将适量水凝胶置于-80℃冰箱冷冻过夜后,置于冷冻干燥机中,冷冻干燥24 h,取出后涂金,扫描电镜放大观察。
1.3.3水凝胶注射性及流变性能的测定用2 mL注射器抽取不同浓度的水凝胶,通过23G内镜下注射针注射,评估水凝胶的内镜下可注射性。使用旋转流变仪进行黏度测定、振荡时间扫描、振荡频率扫描及振荡应变扫描。将水凝胶置于流变仪上下两块板之间,将顶板降低至25 mm的间隙距离,并刮掉多余的凝胶,注意使凝胶在顶板和底板之间均匀。在不同应变力下测定了凝胶的黏度。在频率分别为6.3 rad /s 和0.5%的应变下进行振荡时间扫描。在固定应变力为0.5%的条件下行振荡频率扫描。以6.3 rad/ s为固定频率进行了振荡应变扫描。储能模量G′,又称为弹性模量,是指材料在发生形变时,由于弹性(可逆)形变而储存能量的大小,反映材料弹性大小;损耗模量G″,又称黏性模量,是指材料在发生形变时,由于黏性形变(不可逆)而损耗的能量大小,反映材料黏性大小。储能模量远大于损耗模量时,材料主要发生弹性形变,所以材料呈固态;损耗模量远大于储能模量时,材料主要发生黏性形变,所以材料呈液态;储能模量和损耗模量相当时,材料为半固态,凝胶即是一种典型半固态物质。
1.3.4离体猪胃黏膜下注射实验取新鲜离体猪胃,用大头针固定在泡沫板上,黏膜下分别注射2 mL的2%、3%、4%、5%的水凝胶,0.4%透明质酸钠和等渗盐水,重复5次操作。记录初始隆起高度。于注射后5、10、15、30、45、60、90、120 min分别测量黏膜隆起高度,并观察黏膜隆起随时间变化情况。所有实验均由同一人操作。
维持率=测量高度÷初始隆起高度×100%
1.3.5离体猪胃黏膜隆起-剥离实验取新鲜离体猪胃,用大头针固定在泡沫板上,贴上电极片,用游标卡尺标记直径为3 cm的范围,并用高频电刀在圆周标记至少8个点,在标记范围内黏膜下注射2%、3%、4%水凝胶,0.4%透明质酸钠和等渗盐水,至标记范围全部隆起后,利用高频电刀模拟ESD操作,将标记范围内黏膜完整剥离,记录剥离时间,每组重复3次。所有实验均有同一人操作。

2 结 果
2.1 水凝胶的制备与性能
2.1.1 水凝胶的合成及电镜1%浓度laponite,可得到透明、无色的胶体分散液。当浓度达到2%时,搅拌后静置片刻即成为凝胶。随着浓度的增高,在5%浓度时,搅拌后即刻形成高黏度凝胶。电镜图像显示水凝胶形成片层堆叠样结构。见图1 。
2.1.2水凝胶的可注射性不同浓度的水凝胶均可通过1、2、5 mL的注射针头注射,且可顺利通过23G内镜下注射针注射,注射后立刻转化为固态凝胶。但是,随着laponite浓度的增加,注射阻力逐渐增大。

图 1 水凝胶的扫描电镜图
2.1.3水凝胶的流变性能在laponite浓度2%~5%范围内,黏度测量显示凝胶的黏度随着浓度的增加而增加;随着剪切速率的增加,黏度逐渐下降。振荡测试表明,水凝胶的储存模量(G′)和损耗模量(G″)随浓度增加而增加。频率扫描显示,在频率0.1~100 rad/s 扫描过程中,水凝胶的G′值和G″值较为稳定,且G′大约是G″的10~20倍。上述结果说明形成了稳定的水凝胶。进一步进行了应变相关的振荡流变学实验,结果显示,在0.01~10左右的应变力下水凝胶表现为线性粘弹性,当超过临界应变力时,凝胶的G′随着应力的增加而减小,表明凝胶发生了凝胶-溶胶转变,而呈现液体状态。G′和GG″的交点则是由凝胶向液态的转变点。见图2。
2.2离体猪胃黏膜隆起效果评价
2.2.1 初始隆起高度在离体猪胃注射相同剂量的黏膜下注射剂(2 mL),2%~5%浓度水凝胶的初始隆起高度分别为[(8.70±0.57)、(9.60±0.89)、(10.10±0.74)、(9.50±1.41)mm],均大于等渗盐水[(5.20±0.76)mm]和透明质酸钠[(7.40±0.74)mm],差异有统计学意义(P<0.05)。 随着laponite浓度的增高,其平均隆起高度逐渐增加,当浓度增加至4%时,其平均隆起高度达到最大值,与2%浓度的隆起高度相比,差异有统计学意义(P<0.05)。
2.2.2离体猪胃黏膜隆起高度变化等渗盐水处理后黏膜隆起高度随时间变化最快,透明质酸钠次之,水凝胶最为缓慢、稳定。在60 min时,等渗盐水处理的隆起高度维持率不足25%,透明质酸组的隆起高度维持率约为46%,而不同浓度水凝胶(2%~5%)的隆起维持率高达72%~83%。即使在2 h后,最低浓度(2%)水凝胶组的隆起维持率仍然维持在70%以上。在5、10、15、30、45、60 min时,2%~5%水凝胶的黏膜隆起高度均明显高于同时间点等渗盐水和透明质酸钠(P<0.05)。
不同浓度水凝胶相比较,注射2%水凝胶黏膜2 h隆起高度[(6.20±0.84)mm]低于3%、4%和5%水凝胶[(7.70±0.45)、(8.40±0.84)、(7.80±1.30)mm],但差异无统计学意义(P>0.05)。见表1。
2.3离体猪胃黏膜隆起后电刀剥离效果评价注射2%、3%、4%水凝胶后隆起的平均剥离时间[(6.12±0.16)、(4.50±0.51)、(3.09±0.70)min]两两比较,差异有统计学意义(P<0.01),且均较等渗盐水[(7.97±0.42)min]和透明质酸钠[(6.92±0.39)min]明显减少(P<0.05)。
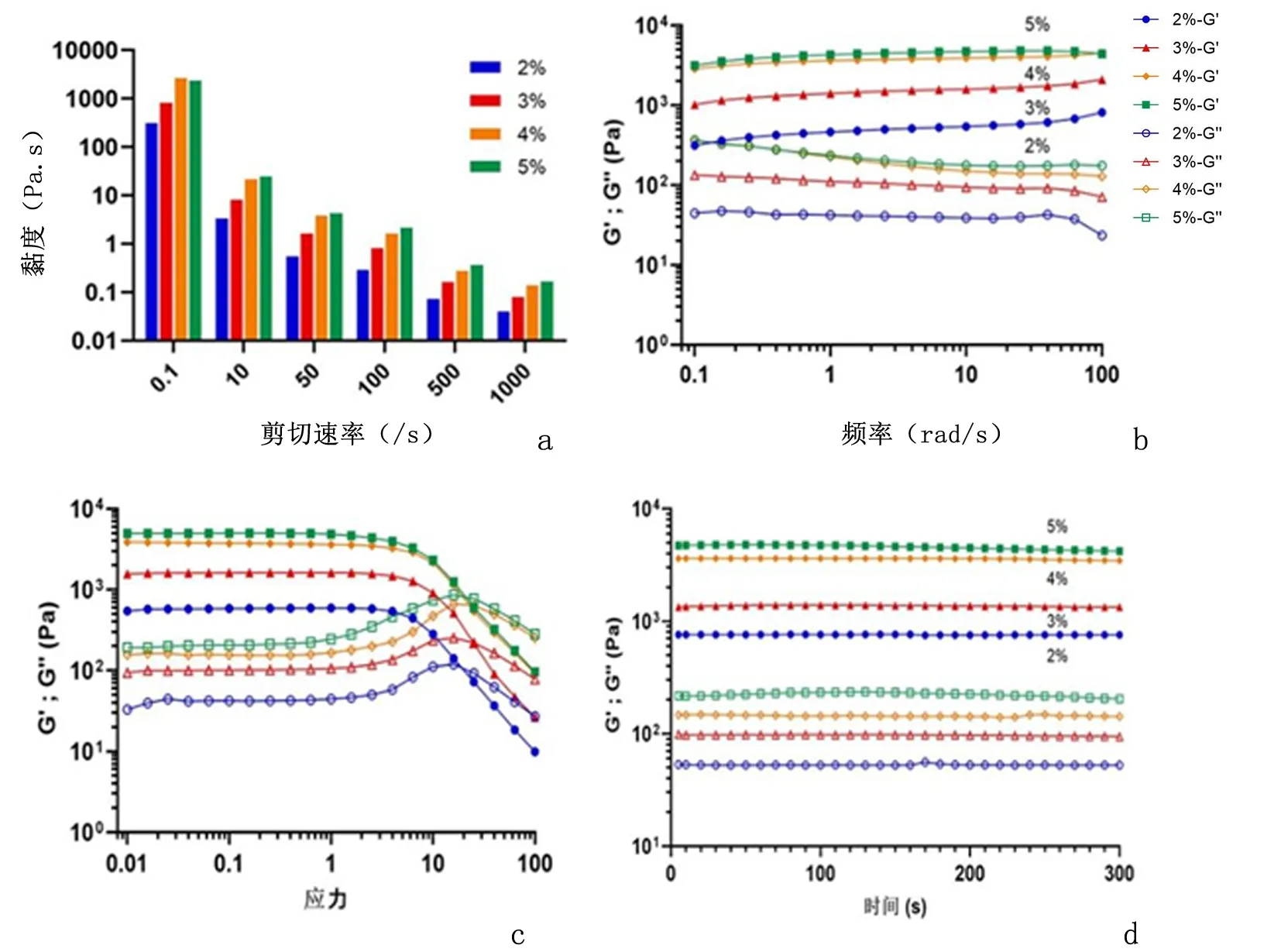
a:不同剪切速率下水凝胶的黏度值 ;b:水凝胶的振荡频率扫描,以0.5%应力扫描; c:水凝胶的振荡应变扫描,以6.3 rad/s扫描;d:水凝胶的振荡时间扫描,以0.5%应力和6.3 rad/s扫描

表 1 不同黏膜下注射剂黏膜隆起高度随时间的变化情况
3 讨 论
EMR、ESD等内镜下切除术可早期、微创地治疗消化道息肉、癌前病变及早癌,阻断其进一步发展成为消化道肿瘤。与EMR相比,ESD可应用于更大的黏膜病灶,将病变黏膜整块剥除,获得更完整的病理组织,其治疗效果与外科手术相当[11-13]。但是,在内镜操作中也存在出血、穿孔、热损伤等并发症[5]。因此各种类型的黏膜下注射液被提出且应用于临床实践。注射黏膜下注射液抬高病变将其与肌层分离,形成一个液体缓冲垫,从而减少热损伤、出血、穿孔等并发症;同时提高技术可行性,促进整块剥离[14-15]。黏膜下注射液对于大部分内镜切除术是必不可少的,尤其是分片EMR和ESD治疗,常常需要维持时间更久的黏膜下注射液[14-16]。ESGE指南指出,对于直径10 mm以上的息肉冷切除也建议黏膜下注射等渗盐水[17]。但是目前临床上使用何种黏膜下注射液效果更佳尚未达成一致共识。理想的黏膜下注射液应可提供较厚且维持时间久的黏膜下液体垫,易于注射,价格低廉,具有良好的生物相容性[6, 15]。
等渗盐水是目前临床上应用最为广泛地黏膜下注射液,其优点在于价格低廉,等渗无毒;缺点是可迅速被周围组织吸收,黏膜下液体垫薄且维持时间短,在手术操作过程中需反复大量注射[15]。其他黏膜下注射剂如高渗盐水、高渗葡萄糖、羟丙基甲基纤维素、透明质酸钠、自体血液、纤维蛋白原等均被临床应用研究,但是这些注射液依然存在生物相容性、安全性、维持时间的限制[18-22]。具体来说,高渗盐水、高渗葡萄糖的黏膜下液体垫在30 min内维持率不到50%[19];注射羟丙基甲基纤维素存在抗原反应风险,而且由于其高黏度,通过内镜下注射针阻力较大[19];透明质酸钠可刺激残留肿瘤细胞的生长[20];自体血液及纤维蛋白原可增加感染风险[21]。在本研究中,我们以临床应用较为广泛且效果优于等渗盐水的透明质酸钠作为对照组。
与等渗盐水相比,渗透压和黏度是其他液体溶液的关键缺点,高渗透压可能导致组织脱水和损伤,而黏度是通过长内镜通道给药困难的原因。水凝胶是一种具有较好吸水性及硬度的材料,可形成持久的黏膜下液体垫而不向周围组织扩散[23]。但是,传统的水凝胶通过化学键或物理作用力形成,通常不可通过内镜下注射针[24]。一些原位合成的水凝胶已被广泛应用于临床研究,但是由于需同时注射多种组分,对于内镜下注射仍然存在挑战。研究发现,laponite单晶体是一种表面带负电荷,周围带正电荷的八面体结构;因此将laponite在阴离子海藻酸盐溶液中分散时,由于正负电荷作用,形成了具有剪切变稀作用的凝胶,即在高剪切力作用下凝胶成为流体,剪切后快速恢复凝胶结构[9, 25]。这种剪切变稀性能,可辅助水凝胶经长内镜通道给药,且黏膜下注射后仍可形成持久的黏膜下垫。
Pang等[10]已利用该特性,合成了浓度为2~4 mg/mL的水凝胶,并与等渗盐水进行对比,应用于离体猪肠道黏膜下注射,结果表明其隆起效果及维持时间明显优于等渗盐水,可用于辅助肠道息肉的精准切除。但是,胃黏膜的厚度明显大于肠道黏膜,而且对于胃部>2 cm的病变,需要形成更持久稳定的黏膜下液体垫。因此,本研究利用这一特性,合成了浓度为20~50 mg/mL的水凝胶,通过对离体猪胃黏膜下注射不同浓度的水凝胶,观察黏膜下隆起的高度及随时间的变化发现,在60 min时,等渗盐水组的隆起高度维持率不足25%,透明质酸组的隆起高度维持率约为46%,而不同浓度水凝胶(2%~5%)的隆起维持率高达72%~83%。证明该水凝胶具有持久有效地隆起效果;且注射相同剂量的水凝胶与等渗盐水、透明质酸钠相比,隆起高度有明显优势,表明我们可能仅仅需要很少量的水凝胶即可获得持久有效的黏膜下液体垫,避免多次重复注射,也弥补了水凝胶价格高于等渗盐水的不足。
此外,我们认为内镜黏膜下注射材料一方面要具备良好的黏膜下隆起效果,另一方面需辅助电刀切割效率,只有同时满足这两方面因素,才可最终应用于实际临床内镜下治疗。目前临床上ESD常规使用的是单极刀,其原理是高频电流从电刀刀头导出,通过人体组织及粘液,再到达体表的接地垫,返回电流发生器。因此黏膜下注射剂需要有一定的导电率,从而不影响电刀切割效率。电导率测定发现等渗盐水的电导率约为6030 μs/cm,0.4%透明质酸钠为724 μs/cm,2%~5%水凝胶电导率分为为2242、3186、3656、4128 μs/cm。最后,我们使用单极电刀在离体猪胃上模拟ESD操作,我们发现注射水凝胶后形成的黏膜下垫可充分地将黏膜层及肌层分离,且不影响切割效率,明显缩短了ESD的操作时间。
本研究通过离体猪胃黏膜下注射及模拟ESD剥离术验证了剪切变稀水凝胶应用于胃部黏膜下注射的可行性及有效性。但是,本研究也存在一些不足之处:①随着laponite浓度的提高,水凝胶的黏度逐渐增大,注射阻力也会相应增大,因此,需要进一步阻力评估来确定合适的内镜下注射浓度;②本文中采用新鲜离体猪胃来进行实验研究,由于条件限制,未进行活体猪胃ESD术;③虽然laponite和海藻酸盐均具有良好的安全性及生物相容性,但是由于水凝胶的三维立体结构,可能会促进肿瘤细胞生长扩散,因此需要进一步动物实验长期观察其安全性和生物相容性。我们下一步将进行家兔以及活体猪实验,以进一步确定合适的水凝胶浓度,评估其在活体的黏膜下隆起效果及对ESD操作的影响,以及是否具有止血促愈合作用,观察其安全性及生物相容性。
