piRNAs在阿尔茨海默病患者脑中的差异表达
2021-04-17孙添怡仇文颖
孙添怡,刘 帆,仇文颖,马 超
(中国医学科学院基础医学研究所 北京协和医学院基础学院 人体解剖与组织胚胎学系,北京 100005)
阿尔茨海默病(Alzheimer’s disease, AD)是一种神经退行性疾病,起病隐匿,进展缓慢,患病率正逐年上升,目前缺乏有效的治疗手段[1-2]。piRNA(PIWI-Interacting RNA)是一种发现仅10余年的非编码小RNA,长度为24~32个核苷酸[3]。最初在小鼠和大鼠的生殖细胞中鉴定出piRNA与PIWI蛋白相互作用形成一种RNA诱导沉默复合物,在沉默转座过程、调节基因表达等方面发挥生物学功能[4-5]。研究发现piRNA在中枢神经系统中可能影响AD的核心病理生理过程,在β-淀粉样蛋白-42(amyloid β-protein 42, Aβ42)的异常生成、tau的分裂和翻译后标记、Aβ42和tau的清除受损等方面发挥作用[6]。基于前期研究成果,本实验选取经预测与AD相关性高的10个在人脑中表达的piRNA[7],比较AD组和对照组中这些piRNA及其相关mRNA的表达差异,从而探索与AD相关的piRNA。
1 材料与方法
1.1 材料
1.1.1 脑组织样本:本实验所用的人脑组织都来自中国医学科学院北京协和医学院的国家发育和功能人脑组织资源库(National Human Brain Bank For Development and Functions)。所有大脑样本均根据中国人脑组织库协作联盟2019年发布的中国人脑库标准化操作规程采集[8]。所有捐献者均已签署知情同意书。本研究由中国医学科学院基础医学研究所伦理委员会批准(批准文号:009-2014)。
1.1.2 试剂:Agilent RNA 6000 Kit(Agilent),snRNA cDNA Kit、snRNA PCR Kit、mRNA cDNA Kit、mRNA PCR Kit(北京康为世纪生物科技有限公司)。
1.2 方法
1.2.1 脑组织病理染色及评分和分组:按照NIH-AA发布的AD神经病理评估指南推荐的染色及评分方法[9],对脑组织石蜡切片进行ABC病理染色并评分,ABC病理染色包括Aβ染色、p-tau染色和Garvey银染染色。根据Aβ斑块、神经纤维缠结、神经炎性斑块分布及数量对19例人脑进行AD的ABC评分:“无(None,N)”“低(Low,L)”“中(Immediately,IM)”“高(High,H)”。染色后将样本分为两组,AD组10例,对照组9例。
1.2.2 Real-time PCR检测piRNA及相关mRNA:取冰冻保存的前额叶组织约200 mg加入1 mL Trizol试剂,研磨成匀浆后加入0.2 mL氯仿剧烈振荡,静置后12 000 r/min离心15 min,取上清加入0.5 mL异丙醇,12 000 r/min离心10 min后弃上清,向沉淀中加入1 mL 75%乙醇轻轻混匀,750 r/min离心5 min后弃上清,晾干RNA样本后加入适量无核酸酶水溶解得到RNA溶液。
根据Agilent RNA 6000合成试剂盒说明书组装芯片,将65 μL的胶和1 μL的染料混合,避光室温13 000 r/min离心10 min,将混合物按说明书吹入RNA芯片标记G的孔,RNA样品1 μL吹入样品孔中,DNA分子质量标准1 μL吹入ladder孔中。振荡后将芯片放入Agilent 2100生物分析仪中检测脑组织样本RNA完整性(RNA integrity number,RIN)。检测后得到合格样本13例,AD组6例,对照组7例进行后续实验。
根据snRNA cDNA试剂盒说明书把从人脑组织中提取的非编码小RNA加poly(A)尾,反转录合成cDNA。根据snRNA RT-qPCR试剂盒说明书进行real-time PCR(RT-qPCR)反应,反应体系:2×qPCR Mixture 10 μL、上游引物1 μL、下游引物1 μL、piRNA cDNA 3 μL、无核酸酶水稀释到20 μL。Biorad CFX96荧光定量PCR仪进行RT-qPCR反应,过程如下:预变性95 ℃ 10 min,变性95 ℃ 15 s,退火/延伸60 ℃ 1 min,变性、退火、延伸40个循环后停止反应。
根据mRNA cDNA试剂盒说明书把从人脑组织中提取的RNA反转录合成cDNA。根据mRNA RT-qPCR试剂盒说明书进行RT-qPCR反应,反应体系:SYBR Premix Ex TaqⅡ(2×)12 μL、上游引物(10 μmol/L)1 μL、 下游引物(10 μmol/L)1 μL、 cDNA 2 μL、无核酸酶水稀释到25 μL。Biorad CFX96荧光定量PCR仪进行RT-qPCR反应,过程如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火/延伸30 s,共进行30个循环后停止反应。引物序列见表1。
1.3 统计学分析
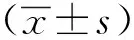
2 结果
2.1 人脑样本的筛选及RNA质量评价
经AD病理评分,染色例图(图1),评分结果及样本背景信息(表2)。
19例脑样本RNA浓度区间范围是245~1 080 mg/L,A260/280区间范围是1.83~2.28,RIN值区间范围是2.8~7.7(表3)。将RIN ≥6.0视为合格样本,其中13例脑组织标本合格,含AD组6例,对照组7例。琼脂糖凝胶电泳中13例合格样本RNA显示了清晰的条带(图2A,B),6例不合格样本条带不清晰(图2A,C)。

表1 Real-time PCR引物序列Table 1 Primers used for quantitative real-time PCR
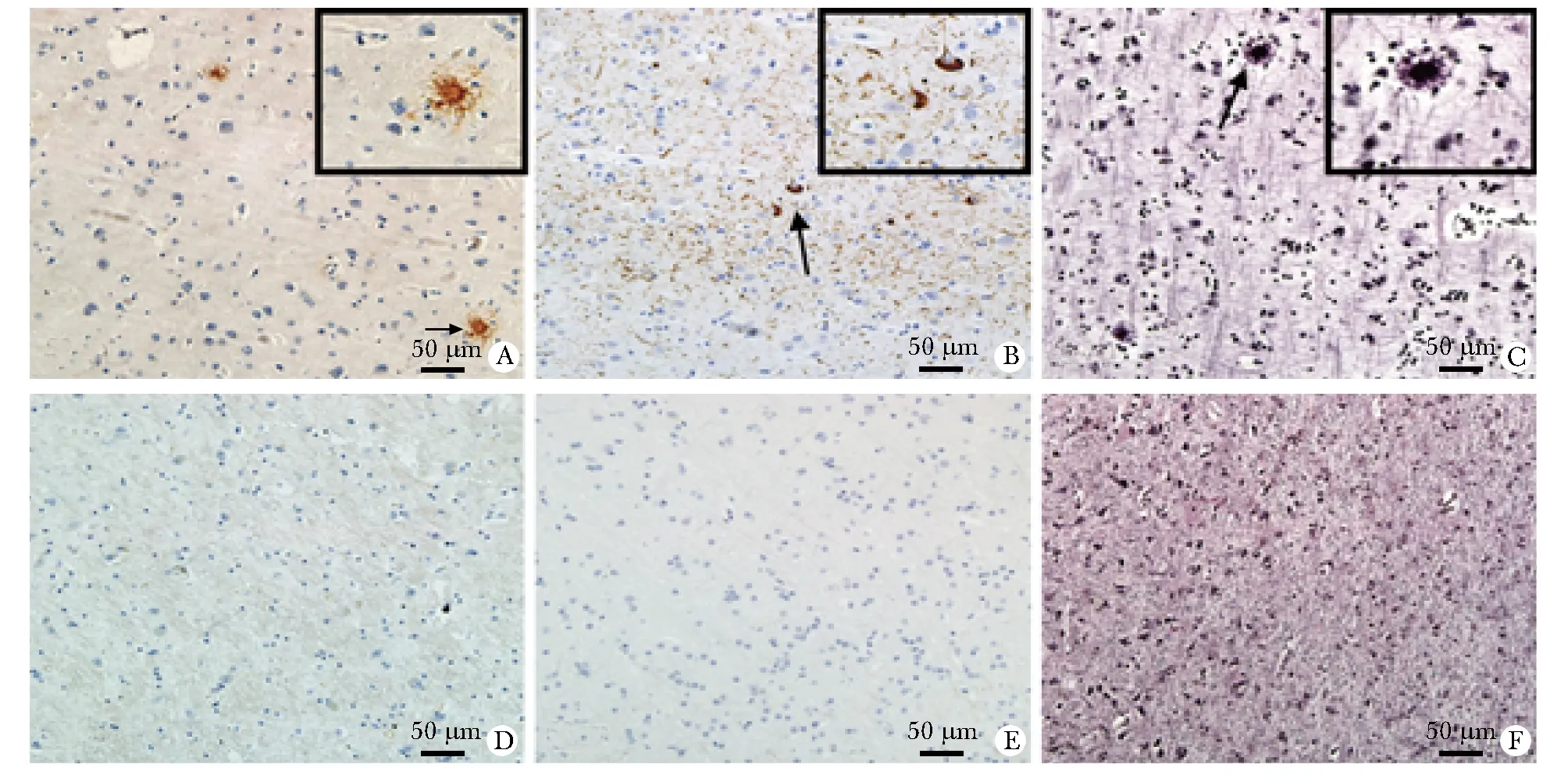
A.the arrow pointing at amyloid β deposits; B.the arrow pointing at neurofibrillary tangles; C.the arrow pointing at neuritic plaques; A-C.AD group; D-F.aging control group; A&D.Aβ staining; B&E.P-tau staining; C&F.garvey staining

表2 AD组及对照组详细样本信息

表3 AD及对照组RIN值检测结果

A.agarose gel electrophoresis detection, number 1 to 13 represented qualified samples, a to f represented unqualified samples(n=19); B.Kurtosis curve of RIN value of qualified sample; C.Kurtosis curve of RIN value of unqualified sample
2.2 piRNA在AD患者和对照人群脑组织中表达
选取的10个piRNA 均出现AD组表达量降低的趋势(表4),其中4个piRNA DQ597973、DQ576872、DQ597479和DQ600318在AD组表达量显著降低(P<0.05)(图3)。
2.3 DQ600318相关的mRNA LRRC37A3在AD患者和对照人群脑组织中表达
LRRC37A3在AD组为0.76±0.12,较对照组的1.47±0.42显著降低(P<0.01)(图4)。

表4 AD及对照组RT-qPCR检测结果
3 讨论
piRNA在人脑中含量丰富,可能是导致AD的危险因素之一,在小样本的筛选中已经发现其不可忽视的潜在作用[10]。本文对10个piRNA进行检测,均表现为AD组表达量降低,提示piRNA表达量降低可能与AD相关。其中有3个piRNA出现的变化趋势与参考文献相同,其余相反,产生原因可能是二者检测方法不同,文献中采用测序法而本文选择RT-qPCR法,并且人脑的个体差异较大,不同样本间差异明显,在增大样本量后可能得出可信度更高的结果。
大脑中piRNA的生物发生模式为核定位[11],位于基因内或来自基因间区域的piRNA可能调节邻近基因的mRNA稳定性和翻译[12]。研究确定的AD相关piRNA中,41%富集在蛋白质编码基因,表明这些piRNA序列是对蛋白质编码基因的补充或接近[7],这些piRNA极可能通过序列互补性来靶向调节邻近的基因[13]。其中DQ600318位于17号染色体60、325、632-60、325、657,LRRC37A3位于17号染色体62、850、486-62、914、903,二者在染色体上位置接近,推测LRRC37A3表达可能受DQ600318表达的调控。
DQ600318与LRRC37A3分别在TOMM40-rs2075650以及ApoE-rs4420638两个单核苷酸多态性(single nucleotide polymorphisms, SNP)出现明显差异[7]。欧洲人脑TOMM40-rs2075650可能增加AD的发病风险[14],而ApoEε 4又是公认的痴呆最大风险因子[15]。因此推测DQ600318和LRRC37A3可能是AD相关风险基因,对DQ600318的检测或许会是AD新的检测标记。

Independent sample t test, *P<0.05, **P<0.01compared with control group;AD group (n=6); control group (n=7); A.DQ600318(P<0.01); B.DQ597479; C.DQ597973; D.DQ576872

AD group (n=6); control group (n=7); A.DQ581610; B.DQ590835; C.DQ571669; D.DQ586404; E.DQ586113; F.DQ571030图4 无差异的6个piRNA在AD及对照组表达Fig 4 No significant differential expression was shown in 6 piRNAs compared with control
