结肠息肉样血管发育不良并大出血一例并治疗策略分析
2021-04-17郑会聪胡中伟肖艳华郭家伟詹远京郑啼婴
郑会聪,胡中伟,肖艳华,郭家伟,詹远京,郑啼婴
(广州市第八人民医院消化内科, 广东 广州 510515)
胃肠道血管发育不良(angiodysplasia polypoid,AD),又称为胃肠道动静脉血管畸形、血管扩张、毛细血管扩张等,一般指正常黏膜或黏膜下畸形静脉及毛细血管所发生的扩张性病变,是难治性或不明原因消化道出血的主要病因,约占51%,尤其见于老年人[1,2],具有反复、隐蔽等特征,再出血率达16.2%~30%[3,4]。病变多以下消化道为主,80%位于右半结肠,15%位于胃及小肠[5,6]。组织学上表现为鲜红色多量管腔扩张、增粗或迂曲的变形血管,管壁厚薄不均。内镜表现为单发或多发的平坦红色斑[1]。目前,AD的机制尚不完全明确,可能与先天性血管发育异常、获得性血管退行性病变、慢性血氧导致血管代偿性增生等多种因素有关。
息肉样的结肠AD非常罕见,其与一般AD的主要区别在于形态的异常;内镜下多表现为单发或多发长蒂病变,呈章鱼状,部分顶端呈瘤样,长度数毫米至数厘米不等,表面黏膜光滑,同周边黏膜一致,顶端可有糜烂,个别伴有活动性出血[7]。与一般AD不同,息肉样AD更多见于横结肠及乙状结肠,患者平均年龄更小。目前,国内外报道的息肉样结肠AD较少[8-22],本研究现对我院收治的1例患者进行报道,并结合国内外文献,对治疗策略进行分析。
1 病例报道
患者男,32岁,腹痛伴排暗红色血便4 h入院。既往无肝病、消化性溃疡等病史,无长期口服阿司匹林等药物史;无嗜酒史;无特殊家族史。入院时查体:血压123/79 mmHg(1 mmHg=0.133 kPa),心率84次/分,血红蛋白94 g/L;大便OB(+),予生长抑素及林格氏液等输注,灌肠后行急诊肠镜示肠腔见大量暗红色血迹,至结肠肝曲处见一约2.5 cm×1.5 cm大小的长蒂息肉,质软,表面黏膜光滑、发红,有紧绷感,息肉顶端糜烂,可见活动性渗血,符合息肉样AD内镜表现(图1);考虑到病变较大,且非乙状结肠或横结肠等常见部位,位置更深,直接镜下切除创口再出血风险大,且出血后再止血难度更大,遂予钛夹3枚夹闭息肉顶端及根部,观察无再出血(图2),遂退镜返回病房。1周后复查肠镜示肠腔黏膜光滑,肝曲见一约2.0 cm×1.0 cm大小息肉(较前缩小),质软,表面黏膜发红、肿胀,3枚钛夹仍存在(图3),遂再予钛夹3枚钳夹根部,观察数秒后可见息肉表面黏膜逐渐发紫,伴有黏膜下点状出血(图4);继续住院2 d后无不适出院。个月后再次入院复查肠镜示肝曲处息肉大小约1.5 cm×1.0 cm(较前缩小),表面呈分叶状、发白,活检钳触之质地明显变硬(图5),遂行高频电圈套切除,创面干结无渗血。术后第二天解黄色大便,术后3 d出院,追踪半年未再解血便。术后病理示肠黏膜慢性炎改变,固有层内淋巴组织增生,局部黏膜肌增生明显及扩张、迂曲血管(图6)。Masson染色可见大量胶原纤维增生(图7)。
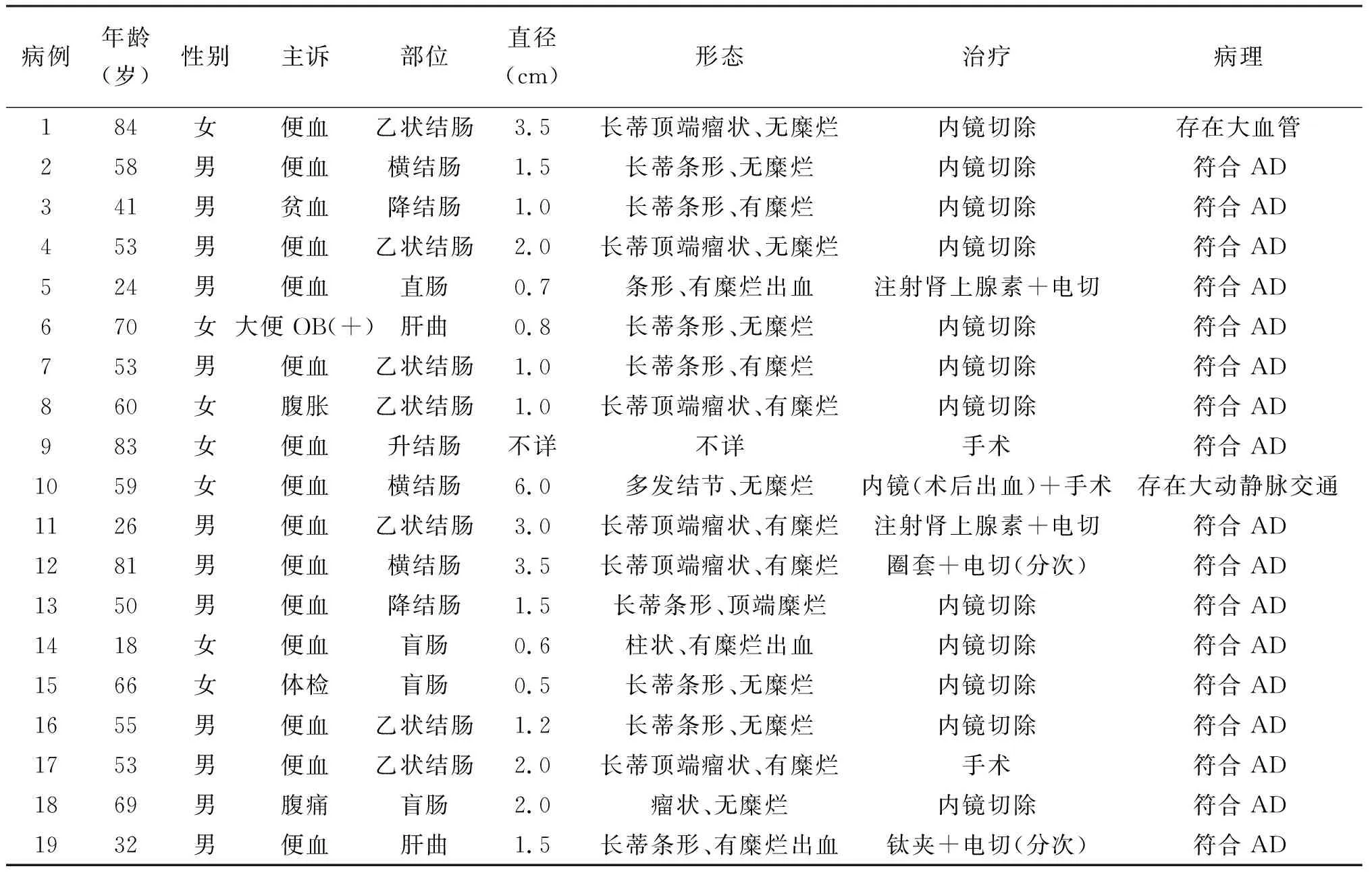
表1 19例结肠息肉样AD患者病历治资料

图1 肠镜示一长蒂息肉样病变,表面黏膜光滑,顶端糜烂,有渗血

图2 钛夹3枚分别夹闭病变根部及顶端后未再出血

图3 1周后复查肠镜提示病变较前缩小,黏膜明显充血
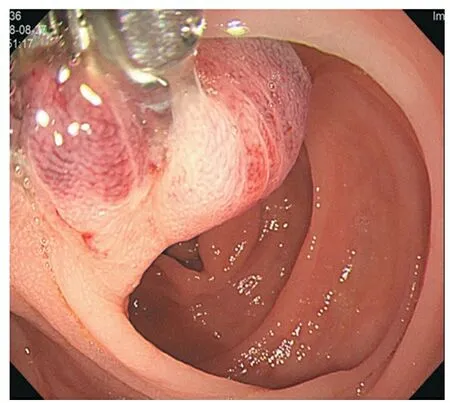
图4 再次予钛夹夹闭,观察数秒发现病变发紫,并见黏膜下出血

图5 1个月后复查肠镜示病变变短,质地变硬,稍呈分叶状
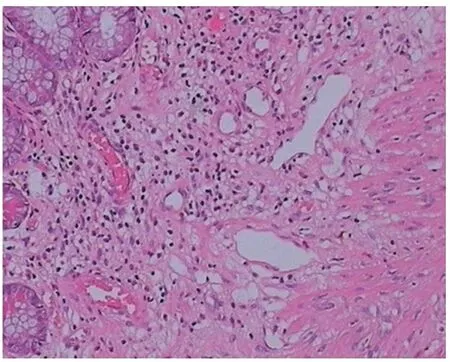
图6 病理检查示肠黏膜慢性炎改变,固有层内淋巴组织增生,局部可见扩张、迂曲的血管 HE×10
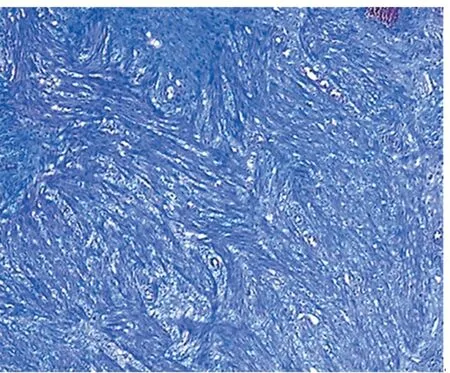
图7 Masson染色可见大量胶原纤维增生Masson×40
2 讨论
结肠息肉样AD是胃肠道血管发育不良中极为罕见的一种,常以便血为主要症状,青年到老年均可发病,病变好发于左半结肠,病理上表现为黏膜或黏膜下层多发畸形或扩张的小血管,个别存在大血管交通。我们对本研究中1例及国内外相关报道的18例病例(病例信息见表1)进行分析发现,患者中男12例,女7例;平均年龄54.5岁;位于乙状结肠最多,横结肠次之;最大直径为6.0 cm,最小直径0.5 cm;16例患者以便血为首发症状的;内镜下特征性的表现为病变呈多章鱼状,表面黏膜光滑,同周边黏膜,部分顶端呈瘤样,有糜烂或活动性渗血。
一般而言,根据内镜下表现诊断该疾病并不困难,主要的难点在于治疗选择,选择不同治疗方式的依据主要包括病变大小、病变位置、有无活动性出血等。对于病变较小或位于左半结肠的病变可行内镜下(注射肾上腺素)电切除;病变偏大但无活动性出血时可先用可分离套扎器结扎后再行内镜下切除;位于右半结肠(肝曲或以上)且较大可考虑行外科手术治疗;上述报道中有3例行外科手术切除,其中1例(直径较大、位于横结肠)是内镜下切除后大出血追加手术[14],另外2例因病变太大直接行手术切除[13,22],术后病理检查提示这3例病变中有2例黏膜下存在大血管或大动静脉交通。这提示我们对于较大病变要考虑存在大血管可能,镜下直接切除需谨慎。另15例行内镜治疗,大部分病变偏小内镜下直接切除,2例镜下有活动性出血,但直径均<0.6 cm,其中1例直接切除,1例注射肾上腺素后切除,术后均未出现大出血[11,15],1例在可分离圈套器套扎后择期再行内镜下切除,术后无大出血[12-16]。术后病理检查均提示黏膜层或黏膜下层扩张或迂曲畸形血管(符合AD病理表现)。
我院收治的该例患者(病例19)病变从内镜下观察为典型息肉样AD表现,但位置在肝曲,不是好发部位,偏大,有活动性出血,不排除存在大血管可能性,如直接行内镜下切除,出血风险大,且出血后内镜处理难度比左半结肠大,故治疗上与其他病例有所不同。首先,处理原则上先以止血为目的,予钛夹夹闭出血点及根部,效果好,未再大量出血。1周后复查肠镜病变已较前稍缩小,顶端已无明显糜烂,故再次予钛夹夹闭根部,观察数秒可见病变表面变紫,黏膜下见出血点,提示病变血供丰富、存在大血管可能性,钛夹封闭后导致病变出现淤血及黏膜淤血性出血。1个月后再次复查肠镜,可见息肉表面已呈分叶状、发白、变硬、变小,从病理上分析,钛夹持续夹闭封闭血管,使血管管腔变小或者堵塞,导致息肉缺血缺氧,继而引起慢性缺血性炎症、间质纤维组织增生等病理变化,最终出现淤血性硬化[23],再次行电切除时大大降低出血风险,也避免行外科手术治疗。最后的病理结果可见黏膜下扩张、迂曲血管(AD表现),另见淋巴组织增生,Masson染色提示大量胶原纤维增生,符合慢性缺血性炎、淤血性硬化改变。
