医用臭氧对膝骨关节炎患者疼痛程度、关节功能及血清NO、SOD、MDA的影响
2021-04-16史丽璞王旭郇稳
史丽璞 王旭 郇稳
【摘 要】目的:探讨医用臭氧关节腔注射对膝骨关节炎患者疼痛程度、关节功能及血清一氧化氮(NO)、超氧化物歧化酶(SOD)、丙二醛(MDA)水平的影响。方法:将80例膝骨关节炎患者随机分为治疗组和对照组,每组40例。治疗组采用医用臭氧关节腔内注射治疗,对照组采用玻璃酸钠关节腔内注射治疗。2组均每周治疗1次,5次为1个疗程。比较2组患者治疗前、治疗结束后1周膝关节疼痛视觉模拟评分法(VAS)评分、西安大略和麦克马斯特大学骨关节炎指数(WOMAC)评分、Lysholm评分,以及NO、SOD、MDA水平。结果:治疗后,2组VAS评分、WOMAC评分、Lysholm评分较治疗前均有改善(P < 0.05);治疗组VAS评分低于对照组,差异有统计学意义(P < 0.05);WOMAC评分及Lysholm评分与对照组比较,差异无统计学意义(P > 0.05)。治疗组NO、MDA、SOD水平较治疗前均有改善(P < 0.05);对照组各指标与治疗前比较,差异无统计学意义(P > 0.05)。治疗组NO、MDA水平低于对照组,SOD水平高于对照组,差异有统计学意义(P < 0.05)。结论:医用臭氧关节腔注射能够显著改善膝骨關节炎患者的疼痛及关节功能,其机制可能与医用臭氧增强膝骨关节炎患者抗氧化酶活力,清除过多自由基有关。
【关键词】 骨关节炎,膝;医用臭氧;氧化应激;疼痛;关节功能;一氧化氮;超氧化物歧化酶;丙二醛
骨关节炎(osteoarthritis,OA)是最常见的关节疾病,以关节软骨的变性、破坏及骨质增生为主要特征。其中,膝骨关节炎(knee osteoarthritis,KOA)的发病率在所有OA中居首位[1]。KOA发病原因复杂,年龄、肥胖、创伤,以及生化、遗传等因素都与其发病关系密切[2]。近年来大量研究证实,氧化应激在KOA的发生、发展中发挥着重要作用[3]。目前,KOA的早期治疗主要包括口服药物及关节腔注射等。尽管方法众多,但疗效难以肯定,存在较多争议。医用臭氧是低浓度臭氧和氧气的混合物,在疼痛、骨关节领域均有广泛应用。有学者发现,接受过医用臭氧治疗后,KOA患者可有不同程度的疼痛缓解和膝关节功能的改善[4-5]。动物模型实验证实,医用臭氧治疗可改变OA动物体内氧化应激水平[6]。本研究拟从临床方面初步观察医用臭氧对KOA患者的疼痛程度、关节功能及氧化应激指标的影响,为医用臭氧治疗KOA提供新的研究思路。
1 临床资料
1.1 一般资料 选取2018年1月至2019年6月在郑州人民医院风湿免疫科就诊的初治KOA患者80例,均以单侧膝关节纳入观察(若双膝发病,选病重一侧),按照随机数字表法分为治疗组和对照组,每组40例。治疗组男25例,女15例;年龄51~75岁,平均(58.91±5.92)岁;病程1~12年,平均(5.31±2.93)年;单膝发病24例,双膝发病16例;X线Kellgren-Lawrence(K-L)分级Ⅰ级13例,Ⅱ级18例,Ⅲ级9例。对照组男23例,女17例;年龄50~73岁,平均(57.14±5.57)岁;病程0.5~14年,平均(4.92±3.01)年;单膝发病26例,双膝发病14例;K-L分级Ⅰ级12例,Ⅱ级20例,Ⅲ级8例。2组患者在性别、年龄、病程、发病部位、X线分级等方面比较,差异无统计学意义(P > 0.05),具有可比性。本研究程序符合郑州人民医院人体试验委员会制定的伦理学标准并得到批准。
1.2 诊断标准 按照美国风湿病学会(ACR)1995年制订的KOA分类标准。
1.3 纳入标准 ①符合上述诊断标准;②试验开始前,疼痛持续15 d以上;③K-L分级Ⅰ~Ⅲ级;④患者自愿且签署知情同意书。
1.4 排除标准 ①继发性OA或其他类型的关节炎患者;②试验前进行过各种关节腔内治疗者;③试验前1个月内口服或外用过糖皮质激素、非甾体抗炎药及其他止痛药物者;④试验前3个月内服用过缓解OA症状的改善病情抗风湿药者;⑤合并甲状腺功能亢进、G-6PD缺乏的患者;⑥严重心肺功能不全、严重肾功能不全(血肌酐升高 > 1.5倍正常值上限)、肝功能损害(转氨酶 > 1.5倍正常值上限)者;⑦有明显血液学指标检查异常者。
2 方 法
2.1 治疗方法
2.1.1 治疗组 采用医用臭氧关节腔内注射治疗。患者仰卧位,膝关节稍屈;局部皮肤常规消毒后,以膝髌骨外侧中部为进针点,用质量分数为0.5%的利多卡因局部麻醉后,选择7号针穿刺入关节腔,注入质量分数为30 μg·mL-1的医用臭氧20 mL。每周治疗1次,5次为1个疗程。臭氧通过臭氧发生器(德国赫尔曼臭氧机)产生。
2.1.2 对照组 采用玻璃酸钠(东博士伦福瑞达制药有限公司,国药准字H10960136,规格2 mL∶20 mg)2 mL关节腔内注射,进针部位、体位均与治疗组相同,每周治疗1次,5次为1个疗程。
2.2 观察指标 治疗前及治疗结束后1周采用疼痛视觉模拟评分法(VAS)评分、西安大略和麦克马斯特大学骨关节炎指数(WOMAC)评分、Lysholm膝关节功能评分(0~100分)对2组患膝疼痛及功能情况进行评价。记录治疗过程中2组所有不良事件,包括临床表现、出现时间、持续时间和转归。
2.3 检测方法 治疗前及治疗结束后1周采集2组
患者外周静脉血2 mL,置于离心机以2500 r·min-1离心10 min,离心半径10 cm,收集血清,-80 ℃保存。用硝酸还原酶法测定2组一氧化氮(NO)含量,比色法测定超氧化物歧化酶(SOD)活性,硫代巴比妥酸检测血清丙二醛(MDA)水平,具体操作按照试剂盒(南京建成生物工程研究所)说明书进行。
2.4 统计学方法 采用SPSS 18.0软件进行统计分析。计量资料以表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。以
P < 0.05为差异有统计学意义。
3 结 果
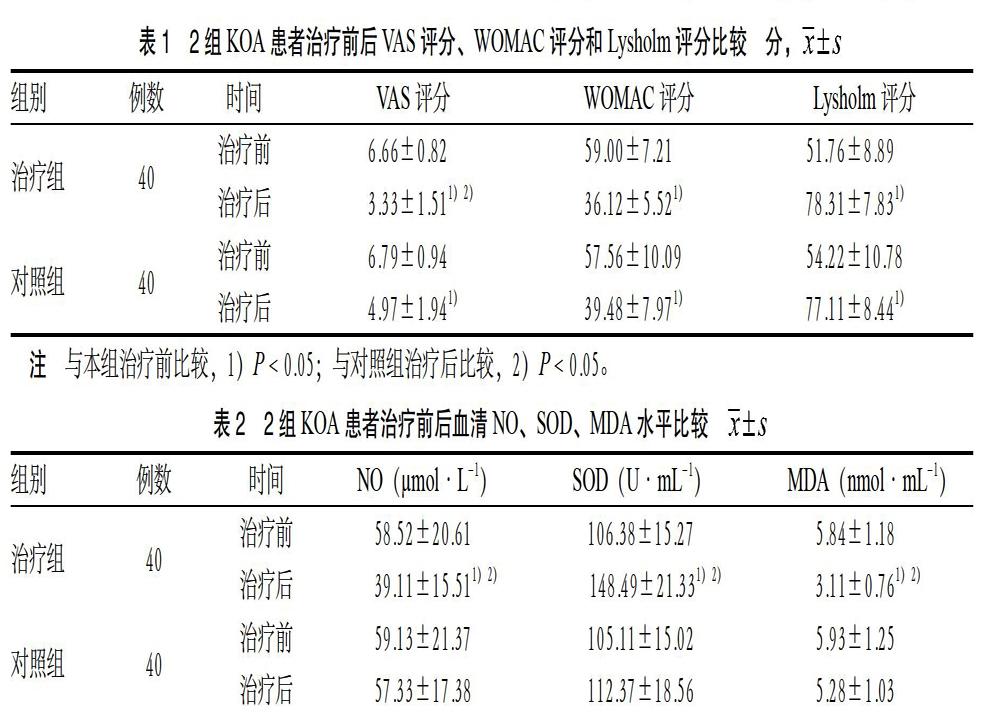
3.1 2组患者治疗前后VAS评分、WOMAC评分和Lysholm评分比较 治疗后,2组VAS评分、WOMAC评分均较治疗前降低,Lysholm评分较治疗前升高,差异有统计学意义(P < 0.05)。治疗后,治疗组VAS评分低于对照组,差异有统计学意义(P < 0.05);2组WOMAC评分及Lysholm评分比较,差异无统计学意义(P > 0.05)。见表1。
3.2 2组患者治疗前后血清NO、SOD、MDA水平比较 治疗后,治疗组SOD较治疗前上升,NO和MDA较治疗前下降,差异有统计学意义(P < 0.05)。
对照组治疗前后NO、SOD、MDA水平比较,差异无统计学意义(P > 0.05)。治疗后,治疗组血清NO、MDA水平低于对照组,SOD水平高于对照组,差异有统计学意义(P < 0.05)。见表2。
3.3 不良反应 2组主要不良反应是注射后膝关节轻微肿胀和疼痛,均可耐受,大多持续数分钟至数小时,逐渐减轻至最终消失,未给予特殊处理。均未观察到皮疹、栓塞、休克等全身不良事件发生。
4 討 论
KOA因较高的发病率及致残率越来越引起临床的关注。对于早中期KOA,治疗方法主要包括非药物治疗及药物治疗,其中药物治疗主要包括控制症状药物、改善病情抗风湿药及软骨保护剂。玻璃酸钠是一种高分子量多糖,广泛分布于人和动物各组织的细胞外基质。多项研究证实,关节腔内注射玻璃酸钠对于缓解患者疼痛、改善关节功能等具有良好疗效,适用于非甾体抗炎药和镇痛药疗效欠佳的患者[7]。然而,玻璃酸钠价格偏贵,起效较慢,限制了其在临床中的应用。医用臭氧目前在医学中的应用尚存在争议,但由于其价廉、方便、无明显不良反应且有良好的抗炎镇痛作用,临床应用日益增多。目前,医用臭氧在疼痛、关节疾病的临床疗效和安全性方面已有较多研究证实。LE?N等[8]
将60例RA患者分为甲氨蝶呤组、甲氨蝶呤联合医用臭氧治疗组,发现甲氨蝶呤联合医用臭氧治疗组患者疼痛评分及疾病活动度明显低于甲氨蝶呤组,且无明显不良反应。LI等[9]研究发现,医用臭氧治疗能够显著降低痛风患者的VAS评分。荟萃分析显示,对于腰椎间盘突出症患者,臭氧治疗后疼痛和功能结局与经手术椎间盘切除术治疗相似,且并发症发生率更低[10]。
本研究发现,治疗后治疗组VAS评分、WOMAC评分均较治疗前显著降低,Lysholm评分较治疗前显著升高,提示医用臭氧关节腔注射能够显著缓解KOA患者关节疼痛,改善关节功能,与既往研究结果相一致[11]。治疗后治疗组VAS评分明显低于对照组,提示臭氧治疗对于缓解KOA疼痛较对照组起效更快。本研究发现,治疗后治疗组WOMAC评分和Lysholm评分与对照组比较,差异无统计学意义(P ﹥ 0.05),提示医用臭氧改善关节功能的短期疗效与玻璃酸钠相当。医用臭氧在疼痛改善方面更优,但在关节功能改善方面并不优于对照组,考虑与玻璃酸钠较强的机械润滑作用有关。
KOA的产生机制之一是体内自由基的增多导致关节软骨的退变。NO是一种高活性自由基,具有抑制软骨细胞增殖、基质合成,促进软骨细胞凋亡等作用[12]。SOD是体内清除超氧阴离子自由基的重要抗氧化酶,其含量的高低可间接反映机体清除氧自由基的能力。MDA为脂质过氧化产物,其活性高低间接反映机体细胞受自由基攻击的程度。研究证实,KOA患者血清和关节液中SOD水平降低,MDA、NO水平升高[13-14]。姚旌等[6]对KOA动物模型研究发现,与模型组比较,医用臭氧治疗组血浆中SOD水平显著升高,NO、MDA水平明显降低,且关节软骨病变较轻。本研究发现,医用臭氧治疗后患者SOD水平上升,NO、MDA水平下降。治疗后治疗组血清NO、MDA水平低于对照组,SOD水平高于对照组。此结果与动物模型结果相一致,提示医用臭氧可能通过促进SOD等抗氧化酶的增加,清除过多自由基,减轻自由基对关节软骨进一步损害,进而抑制KOA的进展。
本研究存在一定的局限性,首先,仅观察了治疗结束后1周患者的症状及血清学改变,未对医用臭氧的远期疗效进行评估,将在今后进一步深入研究。其次,关节液中相关指标的变化可能更加敏感,但由于部分患者关节液难以抽取,本研究没有同时对关节液中相关氧化应激指标进行检测。
综上所述,医用臭氧关节腔注射能够显著改善早中期KOA患者的疼痛及关节功能,其机制可能与臭氧增强KOA患者抗氧化酶活力,清除过多自由基有关。
参考文献
[1] ZHANG Y,JORDAN JM.Epidemiology of osteoarthritis[J].Clin Geriatr Med,2010,26(3):355-369.
[2] 中华中医药学会.骨关节炎[J].风湿病与关节炎,2013,2(2):71-72.
[3] ALTINDAG O,EREL O,AKSOY N,et al.Increased oxidative stress and its relation with collagen metabolism in knee osteoarthritis[J].Rheumatol Int,2007,27(4):339-344.
[4] 胡永召,徐通,阮志华,等.骨髓水肿区减压联合臭氧治疗膝骨关节炎31例临床观察[J].风湿病与关节炎,2020,9(6):17-20.
[5] HASHEMI M,JALILI P,MENNATI S,et al.The effects of prolotherapy with hypertonic dextrose versus prolozone(intraarticular ozone)in patients with knee osteoarthritis[J].Anesth Pain Med,2015,5(5):e27585.
[6] 姚旌,韋玲,王林.关节腔注射臭氧对兔膝骨关节炎模型血浆自由基的影响[J].中国疼痛医学杂志,2012,18(6):328-330.
[7] 中国医师协会骨科医师分会运动医学专业委员会.玻璃酸钠在骨科和运动医学相关疾病中的应用专家共识(2017年修订版)[J].中国医学前沿杂志(电子版),2017,11(9):5-13.
[8] LE?N FERNANDEZ OS,VIEBAHN-HAENSLER R,CABREJA GL,et al.Medical ozone increases methotrexate clinical response and improves cellular redox balance in patients with rheumatoid arthritis[J].Eur J Pharmacol,2016,15(20):313-318.
[9] LI LY,NI JX.Efficacy and safety of ozonated autohemotherapy in patients with hyperuricemia and gout:a phase I pilot study[J].Exp Ther Med,2014,8(5):1423-1427.
[10] STEPPAN J,MEADERS T,MUTO M,et al.A metaanalysis of the effectiveness and safety of ozone treatments for herniated lumbar discs[J].J Vasc Interv Radiol,2010,21(4):534-548.
[11] GIOMBINI A,MENOTTI F,DI CESARE A,et al.Comparison between intrarticular injection of hyaluronic acid,oxygen ozone,and the combination of both in the treatment of knee osteoarthrosis[J].J Biol Regul Homeost Agents,2016,30(2):621-625.
[12] ABRAMSON SB.Osteoarthritis and nitric oxide[J].Osteoarthritis Cartilage,2008,16(2):S15-S20.
[13] SURAPANENI KM,VENKATARAMANA G.Status of lipid peroxidation,glutathione,ascorbic acid,vitamin E and antioxidant enzymes in patients with osteoarthritis[J].Indian J Med Sci,2007,61(1):9-14.
[14] MANEESH M,JAYALEKSHMI H,SUMA T,et al.Evidence for oxidative stress in osteoarthritis[J].Indian J Clin Biochem,2005,20(1):129-130.
收稿日期:2020-08-21;修回日期:2020-10-07
