WTAP在肝母细胞瘤增殖和进展中的作用*
2021-04-16孙贵凤刘丽张梦梅RameshBhandari梁龙孙奋勇
孙贵凤 刘丽 张梦梅 Ramesh Bhandari 梁龙 孙奋勇
肝母细胞瘤(hepatoblastoma,HB)是一种罕见的肿瘤,每百万儿童中只有不到2 例儿童患病,患病儿童主要是3 岁以下,但这是最常见的小儿肝肿瘤之一[1]。目前研究认为肝母细胞瘤的发病因素主要包括:贝-威德曼综合征、家族性腺瘤息肉病、早产、低出生体质量(<1 500 g)、治疗不孕症受孕后、母体在怀孕期间发生过高血压、母体羊水过多、母体先兆子痫、母亲吸烟和母体孕前体质量指数高[2-4]、儿童早年接触乙型肝炎或患有慢性胆汁淤积性肝病(如胆道闭锁)[5]、氧气治疗、某些药物(速尿)、放疗、增塑剂和全胃肠外营养(TPN)[6]。肝母细胞瘤最常见的遗传突变是Wnt 信号通路异常导致β-catenin 的积累[7]。目前,肝母细胞瘤的治疗包括化疗、手术切除和肝移植,患者的5年总生存率约为80%[8]。
大约90%的肝母细胞瘤患者血清中的AFP 升高,目前AFP 被认为是最重要的肝母细胞瘤诊断标志物[9]。然而AFP在婴儿时期会生理性升高,在其他疾病如肝炎、肝硬化、血管内皮瘤、肝癌、生殖细胞肿瘤,睾丸肿瘤和胆囊癌中,AFP浓度也会升高。此外,预后较差的肝母细胞瘤患者通常伴随着极低的血清AFP 水平[10]。所以血清AFP 作为肝母细胞瘤诊断标志物具有一定的局限性。另外在免疫组织化学法用于肝母细胞瘤亚型的诊断和分类的指标CPS1、GPC3、β-catenin、INI1等也缺乏特异性[11],因此,发现更多的生物标志物是十分迫切的,这有助于肝母细胞瘤的早发现、早诊断、早治疗。
WTAP 是Wilms 肿瘤抑制因子1 相关蛋白,参与肿瘤发生的N6-甲基转移酶复合物的重要组成部分[12],最初在拟南芥和酵母中鉴定出两个WTAP同源物作为METTL3 同源物的伴侣蛋白。WTAP 缺乏保守的催化甲基化结构域,本身不具有甲基化活性,与METTL3-METTL14 异二聚体相互作用,共同参与m6A 修饰调控[13]。本研究旨在探讨RNA 甲基化酶WTAP在肝母细胞瘤中的表达和生物学功能,为肝母细胞瘤诊治开拓新的靶点。
1 材料与方法
1.1 肝母细胞瘤标本
收集2016年8月至2020年6月同济大学附属第十人民医院行手术治疗的肝母细胞瘤患者的肿瘤组织和正常对照组织13 对,手术前患者未行放化疗等治疗,该研究经过医院伦理委员会批准,获得所有患者知情同意。
细胞系及主要试剂:人肝母细胞瘤细胞系(Huh6、HepG2)、人正常肝细胞系(QSG-7701,HL-7702)和HEK293T 均购买自中国科学院典型培养物保藏委员会细胞库。DMEM 培养基、Opti-MEM 培养基、RPM 1640 培养基、胎牛血清、青链霉素双抗均购自美国Gibco 公司;α-MEM 培养基购自美国Hyclone公司;胰酶购自美国Corning 公司;Lipofecting 2000、TRIzol RNA 抽提试剂和嘌呤霉素均购自美国Invitro⁃gen公司;siRNA购自上海吉玛基因公司;WTAP 过表达载体购自美国General Biosystems 公司,Western blot及IP细胞裂解液和CCK8试剂盒购自中国碧云天生物科技有限公司;TaKaRa 逆转录试剂盒购自日本宝日医生物技术有限公司;Kapa 实时荧光定量PCR试剂盒购自美国KAPA Biosystems 公司;抗体购自美国Abcam 公司;引物购自中国生工生物工程(上海)股份有限公司;Annexin V-FITC凋亡检测试剂盒购自美国eBioscience公司。
1.2 方法
1.2.1 细胞培养 Huh6 细胞、HEK293T 细胞和HL-7702 细胞用含有10%胎牛血清和1%青链霉素双抗的DMEM 培养基培养,HepG2 细胞使用含有10%胎牛血清和1%青链霉素双抗的MEM 培养基培养,QSG-7701细胞使用含有10%胎牛血清和1%青链霉素双抗的RPM 1640 培养基培养,培养的环境为37℃、5%CO2、饱和湿度。
1.2.2 细胞转染和稳定过表达细胞系生成 将1.5×105个Huh6细胞和1.2×105个HepG2细胞接种于6孔板中培养过夜,转染前将培养基更换为Opti-MEM培养基,使用Lipofectamine 2000 将WTAP 的小干扰RNA(si⁃WTAP- 1:5'- GCAAGAGUGUACUACUCAA- 3',si⁃WTAP-2:5'-GCCCAACUGAGAUCAACAA-3')转染至细胞,转染后继续培养48 h或72 h以待分析。将WTAP过表达载体与包装载体(PsPAX2,pMD2.G)共转染到HEK293T细胞中,分别在24、48和72 h收集慢病毒颗粒,并在聚乙烯下直接感染HepG2和Huh6细胞12~24 h,然后使用2 μg/mL嘌呤霉素处理阳性转染的HepG2和Huh6细胞7~10天。
1.2.3 RNA的逆转录和实时荧光定量PCR 使用TRIzol试剂提取细胞的总RNA,然后通过微量分光光度计NanoDrop2000进行RNA定量,按照TaKaRa逆转录试剂盒的说明书将200~500 ng抽提的RNA转化为cDNA。设计目的基因及内参基因引物,引物序列见表1。用灭菌ddH2O稀释引物,使引物终浓度为10 uM;在冰上依次加入下列试剂至ABI 7900HT仪器配套96孔板;10 μL SYBR;0.4 μL Rox reference Dye;上游引物(F)为0.4 μL;下游引物(R)为0.4 μL;模板(cDNA)为2 μL;去离子水为6.8 μL;在qPCR仪上设置扩增程序,扩增条件为95℃3 min,循环1次,95℃3 s和60℃30 s循环40次;结果采用2-ΔΔCt法进行分析。
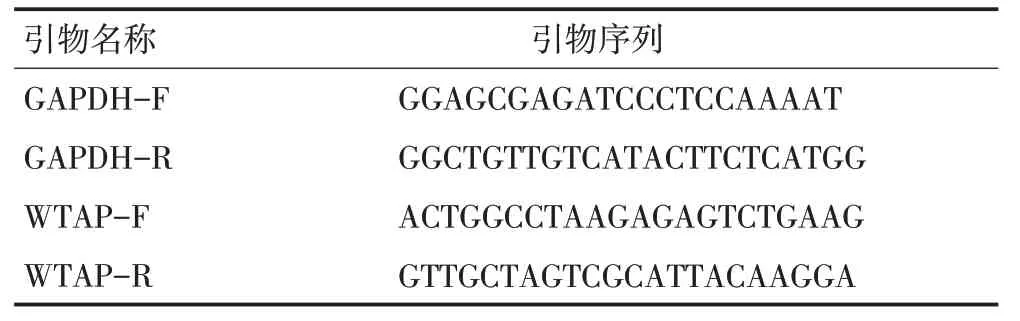
表1 引物序列
1.2.4 蛋白免疫印迹 将细胞用Western blot及IP细胞裂解液在冰上充分裂解,提取细胞总蛋白,随后用BCA法进行蛋白定量,蛋白样品与6×SDS上样缓冲液以5:1 的体积混合,100℃煮沸10 min;按照蛋白定量结果进行聚丙烯酰胺凝胶电泳,然后将蛋白转膜到NC膜上,用5%的脱脂牛奶进行封闭,封闭完成后孵育过夜,洗膜后孵育带有荧光素二抗,洗膜后将NC膜蛋白面朝下放入Odyssey仪器上扫描条带。
1.2.5 CCK8 实验 首先制备单细胞悬液并计数,按照每孔1 000 个细胞将细胞接种于含有200 μL 完全培养基的96孔板中,设置5个复孔,放于细胞培养箱中培养,根据不同细胞的生长快慢设置不同的时间点检测细胞的增殖活性。具体操作是吸弃完全培养基,每孔加入100 μL 用培养基稀释的10 倍CCK8 溶液,放入细胞培养箱中孵育2.5 h,然后用多功能酶标仪检测细胞450 nm处的吸光度值,连续检测数天后,绘制细胞生长曲线。
1.2.6 克隆形成实验 取对数生长期的细胞,用胰酶消化,用完全培养基终止后吹打成单个细胞并进行细胞计数,按每孔1 000个细胞的密度接种在12孔板中,轻轻晃动使细胞分散均匀,放入培养箱中培养,当培养皿中出现肉眼可见的克隆时,即可终止培养,然后用多聚甲醛固定细胞,1%的结晶紫染液对细胞进行染色,然后用自来水缓慢洗去染色液,晾干后在显微镜低倍镜下计数大于10个细胞的克隆数。
1.2.7 凋亡实验 用不含EDTA的胰酶消化细胞,消化完全后用含有血清的培养基终止消化,收集细胞,按照Annexin V-FITC 凋亡检测试剂盒操作对细胞进行避光染色,用流式细胞仪检测细胞凋亡。
1.2.8 裸鼠皮下成瘤实验 首先构建HUH6/lv-shNC和HUH6/lv-shWTAP稳定细胞株然后扩增细胞,消化细胞后,收集细胞沉淀,用PBS 重悬,对细胞悬液计数;选择体积、周龄、大小相似的5周龄10只裸鼠,用剪脚趾的方法进行标记,在裸鼠右侧腹股沟上方接种1×107个Huh6/lv-shNC细胞,左侧腹股沟上方接种1×107个Huh6/lv-shWTAP细胞。待移植瘤长成后,隔天测量移植瘤的体积,移植瘤体积=0.52×长×宽2,20天后人性化处死裸鼠,剖离肿瘤拍照,并对肿瘤进行称重。对移植瘤组织进行免疫组化染色,并对400倍镜视野中的染色结果进行阳性细胞计数。该研究经过医院伦理委员会批准。
1.3 统计学分析
采用GraphPad Prism 7.0 软件进行统计学分析,两组间比较采用t检验,所有的实验均重复3 次。P<0.05视为差异具有统计学意义。
2 结果
2.1 WTAP在肝母细胞瘤组织和细胞系中高表达
在13 对肝母细胞瘤临床标本、人肝母细胞瘤细胞系(Huh6、HepG2)、人正常肝细胞系(QSG-7701,HL-7702)运用荧光定量PCR检测了WTAP的表达情况,结果发现与正常组织相比WTAP在肝母细胞瘤组织中显著高表达(P=0.000 7,图1A);WTAP 在QSG-7701 细胞和HL-7702 细胞间表达无显著性差异(P=0.122 0),与QSG-7701细胞相比Huh6细胞(P=0.000 2)和HepG2细胞(P=0.003 0)中的WTAP 表达水平显著升高,与HL-7702 细胞相比,Huh6 细胞(P<0.000 1)和HepG2细胞(P=0.003 5)中的WTAP 表达水平也显著升高(图1B)。
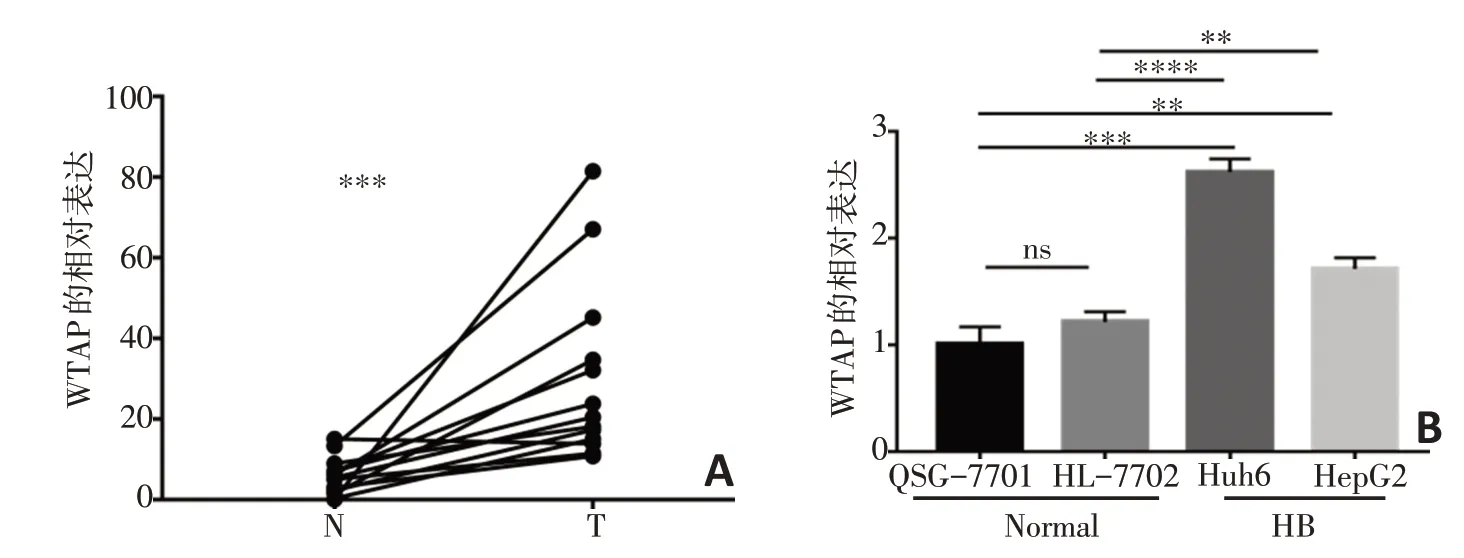
图1 WTAP 在肝母细胞瘤组织和细胞系中高表达
2.2 在肝母细胞瘤细胞系中成功敲减和过表达WTAP
使用荧光定量PCR和Western blot的方法分别检测转染WTAP siRNA 的细胞和稳定过表达WTAP 细胞的敲减和过表达效率,结果显示WTAP 在HepG2细胞(siWTAP-1:P<0.000 1,siWTAP-2:P<0.000 1,图2A)和Huh6细胞(siWTAP-1:P=0.000 3,siWTAP-2:P=0.000 2,图2B)中成功敲减;WTAP 在HepG2 细胞中过表达倍数为(10.64±0.365)倍,在Huh6 细胞中过表达倍数为(15.64±0.433 6)倍,WTAP在HepG2细胞(P<0.000 1,图2C)和Huh6细胞(P<0.000 1,图2D)中成功过表达。
2.3 WTAP影响肝母细胞瘤细胞的增殖活性
在肝母细胞瘤细胞系Huh6 细胞和HepG2 细胞中分别敲减和过表达WTAP,然后运用CCK8 增殖实验检测敲减和过表达WTAP 基因后两株细胞的增殖活性,Huh6 细胞MOCK 组在450 nm 处的光吸收值(1.046±0.0170 6)显著高于siWTAP-1 组的0.55±0.011 87(P<0.000 1)和siWTAP-2组的0.373 3±0.010 94(P<0.000 1,图3A);HepG2细胞MOCK组在450 nm处光吸收值的1.124±0.045 66显著高于siWTAP-1组的0.648 4±0.016 41(P=0.000 6)和siWTAP-2 组的0.531 7±0.005 16(P=0.000 2,图3B);Huh6 细胞Con⁃trol 组450nm 处光吸收值的0.748 4±0.016 41 显著低于WTAP 过表达组的1.224±0.015 97(P<0.000 1,图3C);HepG2 细胞Control 组450 nm 处光吸 收 值的0.848 4±0.016 41 显著低于WTAP 过表达组的1.324±0.015 97(P<0.000 1,图3D)。说明敲减WTAP显著抑制了肝母细胞瘤细胞的增殖活性,过表达WTAP显著增强了肝母细胞瘤细胞的增殖活性。

图2 肝母细胞瘤细胞系中成功敲减和过表达WTAP
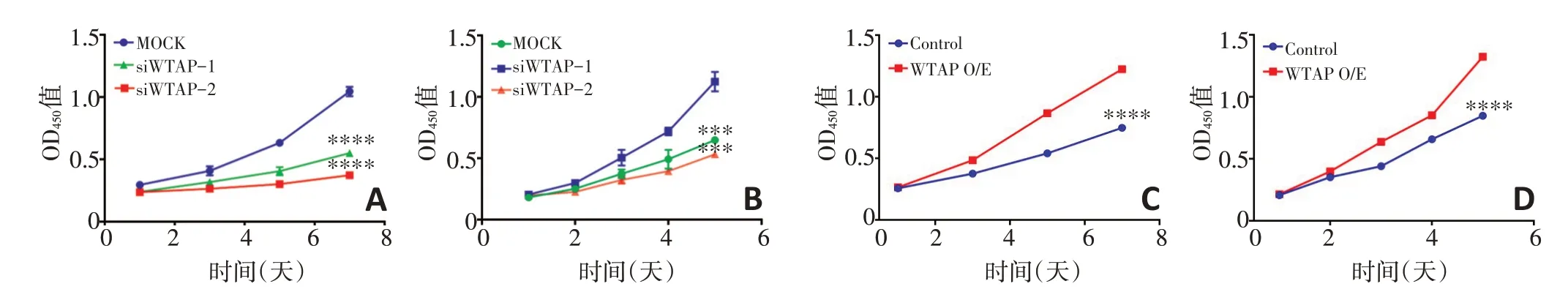
图3 WTAP影响肝母细胞瘤细胞的增殖活性
2.4 WTAP影响肝母细胞瘤细胞的克隆形成能力
在肝母细胞瘤细胞系Huh6细胞和HepG2细胞中分别敲减和过表达WTAP,然后使用克隆形成实验检测两株细胞的克隆形成能力,结果显示Huh6细胞MOCK组克隆形成数目306.7±4.41显著高于siWTAP-1组的188±3.215(P<0.000 1)和siWTAP-2组的150.7±4.485(P<0.000 1),HepG2细胞MOCK组的克隆形成数目227.3±3.712显著高于siWTAP-1组的106.7±4.41(P<0.000 1)和siWTAP-2组89.33±2.333(P<0.000 1,图4A),表明敲减WTAP显著抑制了肝母细胞瘤细胞的克隆形成能力;Huh6细胞Control组的克隆形成数目280±5.774显著低于WTAP过表达组的508.3±10.14(P<0.000 1),HepG2细胞Control组的克隆形成数目122.3±4.333显著低于WTAP过表达组的226±5.196(P=0.000 1,图4B),表明过表达WTAP显著增强了肝母细胞瘤细胞的克隆形成能力。
2.5 敲减WTAP诱导肝母细胞瘤细胞凋亡
在肝母细胞瘤细胞系Huh6 细胞和HepG2 细胞中分别敲减WTAP,使用流式细胞术检测细胞凋亡,结果显示Huh6细胞MOCK组的凋亡细胞百分比(10.93±0.260 3)%显著低于siWTAP-1组[(16.43±0.633 3)%,P=0.001 3]和siWTAP-2 组[(20.27±0.753 5)%,P=0.000 3,图5A,B],HepG2 细胞MOCK 组的凋亡细胞百分比(4.733±0.176 4)%显著低于siWTAP-1 组[(14.33±0.272 8)%,P<0.000 1]和siWTAP-2 组[(15.33±0.272 8)%,P<0.000 1,图5A,C],表明敲减WTAP会显著促进肝母细胞瘤细胞凋亡。
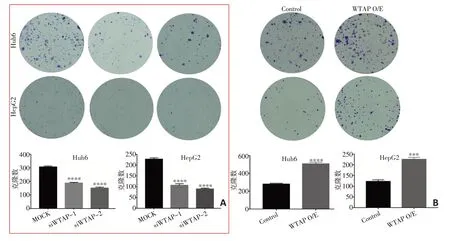
图4 WTAP影响肝母细胞瘤细胞的克隆形成能力
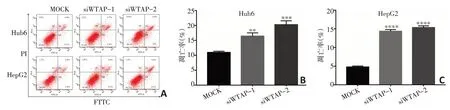
图5 敲减WTAP诱导肝母细胞瘤细胞凋亡
2.6 敲减WTAP抑制肝母细胞瘤细胞体内成瘤能力
在Huh6细胞中构建的WTAP稳定敲减细胞株运用qPCR实验进行敲减效率验证,结果表明WTAP被成功敲减(P<0.000 1,图6C);采用Western blot检测移植瘤中WTAP蛋白表达情况,再次表明WTAP成功敲减(图6D);WTAP稳定敲减细胞株形成的移植瘤的体积(701±82.31)mm3相对对照组(200.2±31.59)mm3显著减小(P=0.000 1,图6A、6B、6E);WTAP稳定敲减细胞株形成的移植瘤的重量(0.636 8±0.083 91)g相对对照组(0.135 6±0.033 29)g显著减少(P<0.000 1,图6F);对移植瘤组织进行增殖相关分子指标Ki67的免疫组化染色(图6G),WTAP稳定敲减细胞株形成的移植瘤的Ki-67阳性细胞数(108±13.05)显著少于对照组[(406±14.73),P=0.000 1,图6H],说明敲减WTAP抑制了肝母细胞瘤细胞体内成瘤能力。
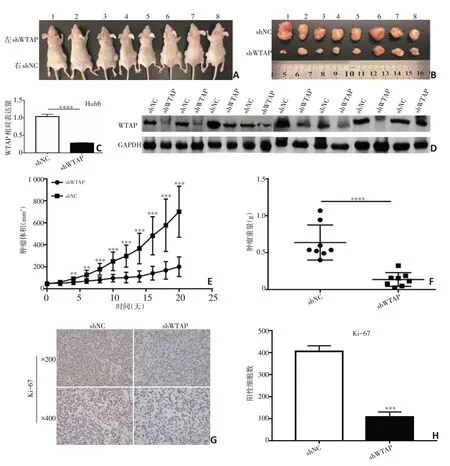
图6 敲减WTAP抑制肝母细胞瘤细胞体内成瘤能力
3 讨论
尽管肝母细胞瘤是一种罕见的肿瘤,但近年来其年发病率有所增加,约占儿童期所有恶性肝肿瘤的80%,所有儿科癌症的1%[14-15]。由于其起病隐匿,进展迅速,缺乏好的早期的诊断标志物,导致许多患者预后较差[16],因此寻找关于肝母细胞瘤的新的诊疗靶点至关重要。
在编码RNA 和各种非编码RNA 中已经鉴定出超过100 种类型的细胞RNA 修饰。N6-甲基腺苷(m6A)是真核生物mRNA 上最普遍和最丰富的转录后RNA 修饰。mRNA 的m6A 修饰是动态可逆的,主要由甲基化酶、去甲基化酶和m6A 识别蛋白所调控[17]。m6A 修饰有助于实现多种基本的细胞功能,例如mRNA的剪接、核转运、mRNA稳定性、翻译效率和microRNA 发生,这意味着m6A修饰与许多人类疾病有关[18]。目前研究已发现m6A在许多正常生物过程中发挥着重要的作用,如组织发育、干细胞自我更新和分化、热休克或DNA损伤应答等。此外,m6A修饰与癌症的发生、发展和药物应答的关系也十分密切[19-20]。
WTAP 作为一种重要的甲基转移酶介导m6A 的发生,在许多肿瘤中发挥着重要的功能。如WTAP可能涉及WTAP-HBS1L/FAM76A轴作为促进卵巢癌进展的致癌因子[21];WTAP在急性髓系白血病中通过调节MYCmRNA 的m6A 水平影响MYC mRNA 的稳定性,在急性髓系白血病细胞中敲减WTAP可延长细胞中MYC mRNA 的半衰期,WTAP 的高表达预示着急性髓系白血病的不良预后[22];WTAP是胃癌生存率的独立预测因子,在胃癌中WTAP高表达提示患者预后不良[23];WTAP 在肝癌中明显上调,并且介导m6A 修饰通过HuR-ETS1-p21/p27轴促进了肝癌的发展[24]。
本研究发现WTAP 在肝母细胞瘤临床标本和细胞系中高表达,进一步研究发现WTAP在肝母细胞瘤细胞中具有重要的生物学功能,在体外发挥着促进细胞增殖、抑制细胞凋亡的作用,在体内也发挥着促进肿瘤细胞生长的功能,说明抑制WTAP可以抑制肝母细胞瘤细胞增殖并促进细胞凋亡,提示WTAP可能是肝母细胞瘤治疗的潜在作用靶点。已有研究表明,在血管平滑肌细胞中,过表达WTAP 抑制了双调蛋白和Bcl-2 的表达,双调蛋白和Bcl-2 是WT1 的重要靶点,WTAP 通过WTAP-WT1 轴影响了平滑肌细胞的增殖[25];在人的脐静脉内皮细胞中,据报道WTAP通过稳定细胞周期蛋白A2 mRNA来调节细胞增殖[26];WTAP的过表达可以促进角质形成细胞的增殖,可能与cyclinA2 和CDK2 的上调有关[27]。据报道,WTAP 的丰度随着血管平滑肌细胞的增生而降低,而随着重塑的消退和平滑肌细胞积累的终止而增加,可能是由WTAP 激活细胞凋亡的能力介导的。通过促进WTAP 的降解,IGF-1 改变了生存因子sur⁃vivin 的pre-mRNA 剪接程序,从而降低了促凋亡的survivin-2B 的表达,并增加了抗凋亡的survivin 的表达,这些发现表明了WTAP 可以通过调节pre-mRNA的可变剪接来调节细胞凋亡[28]。本研究并未对WTAP发挥的促进肝母细胞瘤细胞增殖抑制、肝母细胞瘤细胞凋亡的具体机制进行深入探讨,但提示了WTAP 有望成为诊断和治疗肝母细胞瘤的重要生物标志物,为继续探究WTAP在肝母细胞瘤中的深入作用机制奠定了基础。
