光声成像在关节炎性病变中的潜在临床应用价值
2021-04-16赵辰阳朱庆莉齐振红姜玉新
赵辰阳,朱庆莉,张 睿,齐振红,杨 萌,姜玉新
中国医学科学院 北京协和医学院 北京协和医院超声医学科,北京 100730
近年来,关节炎性疾病的发病率在全球范围内显著增长。其中,以慢性非创伤性关节炎性疾病增长较为明显,包括骨关节炎(osteoarthritis,OA)和类风湿关节炎(rheumatoid arthritis,RA)两大类。关节慢性炎性病变是最常见的非外伤性活动受限和致残原因[1-2]。研究表明,早期药物治疗可有效防止关节炎性病变恶化,并在一定程度上减少其后期功能受限和残疾的发生[3]。然而,早期关节炎性病变的临床症状并不显著,常规影像学检查的诊断灵敏度欠佳,难以对关节炎进行治疗指导及预后预测。新型成像技术可对小关节进行高分辨率成像,实现对关节炎性疾病的诊断及预后评估,有助于临床诊疗前移,精准指导治疗,改善患者的整体预后。本文重点介绍光声成像(photoacoustic imaging, PAI)技术在关节炎性疾病中应用的可行性及其潜在临床价值。
1 关节炎性疾病常用的影像学评价方法
目前慢性关节炎常用的影像学诊断评估方法包括X线、CT、MRI及超声,上述成像技术多用于评估OA及RA受损关节。关节炎的影像学特征基于其病理学改变而产生,如OA病变关节的关节间隙狭窄、软骨下硬化和软组织骨化,RA病变关节内的滑膜炎性病变(增厚及充血)、肌腱及周围组织炎性病变、滑囊炎性病变及骨质侵蚀等。X线对于诊断骨损伤有较高的准确度,1987年美国风湿病学会制定的RA指南认为X线是诊断RA的影像学金标准,并对其作出评级[4]。但因X线分辨率不高而限制了其在关节炎性疾病早期诊断中的应用。CT作为一种辅助检查手段,通过多层面显像,可显示受损关节的软骨下损害、软组织钙化及骨侵蚀。MRI对软组织具有较高的分辨率,是关节炎性疾病广泛应用的影像诊断方法,通过多序列多层面关节组织成像,可显示关节炎的早期改变,且注射增强造影剂后可进一步增加其灵敏度[5]。高频超声可显示炎性关节周围组织的改变,包括滑膜炎、腱鞘炎、腱周炎、滑囊炎等,还可评估关节炎性疾病中常出现的关节腔积液及骨质侵蚀特征,灰阶超声的半定量评分评估炎性活动度也在部分研究中得到了应用。随着多普勒技术的广泛应用,超声在关节炎性疾病中的诊断价值提高,通过显示关节炎性区域的血流情况,采用半定量评估方式对疾病活动度进行评估[6]。
近年来,随着影像学技术的发展,新型光学成像技术陆续应用于临床,包括弥散性光成像(diffuse optical imaging, DOI)、荧光及生物荧光成像,为关节炎性疾病的早期诊断带来了新的曙光[7-8]。多波长DOI可计算氧合血红蛋白和非氧合血红蛋含量,以提示病变关节的功能改变,如充血、新生血管形成及缺氧等。超声造影(contrast-enhanced ultrasound,CEUS)是近年来临床推广的超声新技术之一,研究证明CEUS可对滑膜炎性病变进行探查,并定量/半定量评价疾病活动度及开展关节炎分子成像[9]。
常规及新型影像学技术可进行关节形态学、微血管及功能成像,对关节病变诊断有较好的准确度和灵敏度,但尚无可同时实现无创性形态学、微血管及功能成像,又兼具较高小关节成像分辨率的影像学方法。而PAI可实现同一影像平台上无创高分辨率小关节成像及结构与功能的定量分析,具有潜在的临床应用价值。
2 光声成像技术原理与成像系统
PAI是一种新型无创性光学成像技术,其原理为光声效应,即在可调节范围内将光信号转换为声信号进行成像。光声效应最早于1886年由Alexander Graham Bell 提出,当组织被短脉冲波长的激光照射后内部温度上升,产生热弹性膨胀,在此过程中产生一段宽频带的超声波;该段超声波可被配置有压电元件的超声探头接收,通过图像重建及处理后,声信号被转换为光声图像[10]。PAI结合了光显像和超声成像的优点,在反映组织光学特性的同时,达到较高的显像深度和空间分辨率。典型的光声系统主要由激光发射仪器、光传输线路及超声信号接收处理器组成,主要仪器类型包括光声计算机断层成像(photoacoustic computed tomography, PACT)、光声显微成像(photoacoustic microscopy, PAM)及光声内镜成像(photoacoustic endoscopy, PAE)[11]。其中,PACT是较为成熟的PAI技术,通过改变探头排列方式或旋转模式及复杂的图像处理后可将光声信号转化为2D及3D图像[12]。
通过内源性光显像剂,如氧合血红蛋白、脱氧血红蛋白、黑色素、水和脂质等,PAI可同时实现解剖学成像和功能成像。利用多波长PAI显示氧合血红蛋白及脱氧血红蛋白,可计算血氧饱和度等反映组织功能的参数[13]。搭载特异性分子的外源性光显像剂,如吲哚菁绿、纳米金颗粒、单壁纳米碳管等,可实现分子PAI[14]。
3 光声成像技术在关节成像中的发展
PAI具有较高的空间分辨率和显像深度,适用于关节成像,特别是小关节。PAI不仅显示关节解剖学结构,还可对其功能参数进行定量测定,具有较好的临床转化前景。近10年来,随着PAI技术的发展,其在关节成像中的研究逐渐增多。
3.1 光声计算机断层成像
近年来,国外研究团队开发了针对关节成像的PACT系统及相应动物模型,并开展了临床前实/试验(表1)。2006年,密歇根大学研究团队最先开发了专门用于关节成像的3D PACT系统,并在鼠尾关节动物模型及人体(尸体)上进行了试验[15]。该系统利用宽频超声探头绕关节进行弓形旋转,经处理后生成3D图像,可清晰显示关节周围组织(如皮肤、脂肪、肌肉、血管、滑膜等),并可反映组织内血红蛋白分布情况[16]。研究者应用该系统定量测定关节炎模型大鼠踝关节内的光声信号,发现其局部光声信号增强[17]。佛罗里达大学研究团队同期也研发了定量3D PACT PAI系统,并进行了关节模型和人体在体试验[18-20],发现光声三维关节成像与MRI图像具有一致性。该团队在后期研究中采用半环形超声探头列阵对系统进行改进,使其更适用于人体关节成像[21]。van Es等[22]设计了配有半环形超声探头列阵的PACT系统,对人体手指关节、血管进行显像,发现其可清晰显示指间关节周围的甲床、皮肤及皮下软组织层血管,且与组织学相符合。Ermilov等[23]开发了针对关节微血管成像的PACT系统,通过360°旋转实现三维显像,对关节微血管具有较高的分辨率,同时可通过快速PAI显示小血管的温度调节反应。
上述研究表明,PACT可较好地显示关节周围组织的形态结构,可显示普通超声难以显示的关节内软骨和骨,对微血管和新生血管的显示率较高,这一特点对关节疾病具有重要诊断价值。
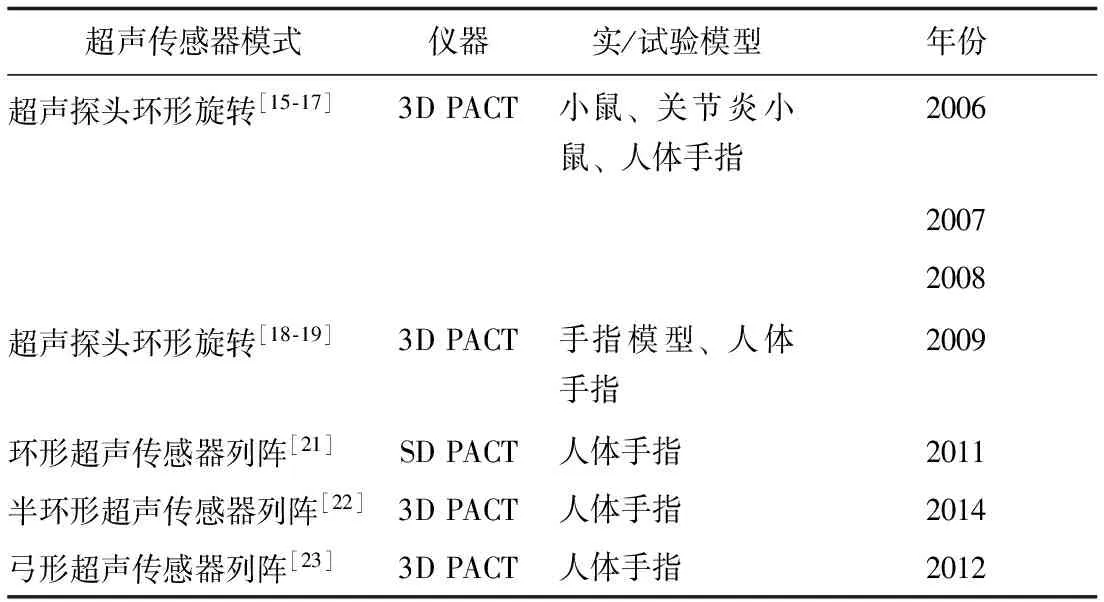
表 1 光声计算机断层成像相关研究结果
3.2 双模态光声/超声成像系统
光声信号和超声信号均由超声传感器(探头)接收,经图像后处理后可同时得到两种成像方式的显像结果,并使光声图像叠加在灰阶超声图像上,实现双模态光声/超声(photoacoustic/ultrasound, PA/US)成像,是现阶段常见的成像系统之一。双模态PA/US成像系统通过多波段PACT和超声成像,获取目标组织解剖功能信息,此种多模态成像方法也是现阶段关节PAI研究的热点,相关研究见表2。

表 2 双模态PA/US成像系统相关研究
有研究将PACT和超声计算机断层成像(ultrasound tomography,USCT)整合至同一影像平台,形成PACT/USCT双模态成像系统,结合光声信号和灰阶超声图像,对人体手指局部结构具有更清晰的认识,可达到诊断疾病的目的[24-25]。目前,较常见的光声与超声成像结合方法则是构建一体化的双模态PA/US成像系统。
由于超声影像检查的高性价比和便携性,其在世界范围内得以广泛应用,而独立PAI系统因体积较大、设计复杂、价格昂贵,其临床应用受到一定限制。为使光声技术进一步向临床转化,研究人员将光声技术整合于商品化超声影像系统,构建了新型一体化双模态PA/US成像系统。这种双模态成像系统将光声信号整合至超声灰阶图像,利用超声灰阶图像指导光声信号的定性分析和定量评估,在实现PAI的基础上同时兼具商品化超声影像系统稳定性的优点。Wang等[26]首先将PAI技术整合于商用超声仪器,并应用此双模态成像系统对关节炎模型小鼠的踝关节进行1064 nm和532 nm双波长检查,可在炎性病变区域内探测到显著升高的光声信号[27],接受靶向药物治疗后,关节炎小鼠的光声信号出现明显下降[28]。该团队在此基础上进一步对双模态PA/US成像系统进行了适于人体关节成像的改造,并获得了清晰的人体手指关节光声图像[29]。
将光传输系统进一步整合至超声探头,形成一体化便携式PA/US探头,更符合临床医生的使用习惯,便于临床转化及推广应用,目前已成为多功能PA/US成像系统的研究重点。Daoudi[30]等将光传输设施整合至超声探头内,开发出一种简便的光声系统超声探头,可同时获取清晰的超声及光声图像。为进一步证实其临床潜在应用价值,研究者开展了相关临床前研究,发现关节炎区域光声信号显著增强[31]。密歇根大学研究团队在此基础上开发了具有手持光声探头的双模态PA/US成像系统,并应用该系统对关节炎患者和健康对照组的手指关节进行580 nm单波长显像和532 nm、1064 nm双波长显像,发现关节炎患者的血流及血氧饱和度与健康对照组存在显著差异[32],证实其可对充血、缺氧等炎性关节功能改变进行定量诊断[33]。该团队进一步使用LED作为双模态PA/US成像系统光源,成功获取高信噪比的PA/US实时整合图像,可显示最大直径为5 mm的手指微血管,并获取手指关节的血氧定量结果,该研究成果对PAI在关节炎中的临床应用推广具有较大价值[34]。
自2015年起,北京协和医院超声医学科研究团队和北京大学、深圳迈瑞生物医疗电子股份有限公司合作,致力于开发配置手持光声探头的PA/US多功能影像一体化平台,将光声系统部分整合至临床应用的高端超声成像探头(L9-3U, 深圳迈瑞生物医疗电子股份有限公司),应用该仪器可同时检测光声和超声信号,并获得光声与超声的叠加图像,该影像平台已成功开展了甲状腺结节和乳腺结节诊断的临床前期研究[35]。目前,该团队进一步开展了RA的临床研究,发现多模态PA/US对小关节内滑膜组织微血管有较好地显示,且与临床评分具有较好的相关性,可对RA患者的小关节进行全面评价,有望在疾病活动度、随访及预后预测等方面发挥临床应用价值。
3.3 结合超声及其他医学影像技术的多重成像系统
PAI技术还可与光散射断层成像技术(diffused optical tomography, DOT)整合至同一影像平台。Xi等[36]将PACT和DOT整合于一体化成像平台,利用探头列阵接收光声信号,并通过有限元图像重建程序处理弥散光信号,从而同时获取PACT和DOT成像,并进行图像叠加融合。研究表明,人体关节周围组织和骨骼可被PACT和DOT显示,该系统可应用于关节炎症的评估[36]。
4 外源性光声造影剂在关节成像中的应用
在开发关节PAI仪器的基础上,研究者采用外源性光声造影剂,将关节PAI技术的应用扩展到了分子成像水平。一项研究将抗肿瘤坏死因子结合在外源性光声造影剂纳米金颗粒上,注射至关节炎模型小鼠的尾关节,在600 nm波长下进行PAI,发现其关节内信号强度明显高于未注射造影剂的对照组[37]。
半萘酚罗丹荧(Seminaphthorhodafluor,SNARF-5F)是一种特殊的pH灵敏度染料,可与纳米探针结合检测局部组织pH值,该分子探针亦可用于关节PAI[38]。将分子探针复合物注射至关节局部组织后,可计算光声信号、检测组织局部pH值,对关节炎性疾病有一定的辅助诊断价值。
在外源性光声造影剂近红外区荧光团标记树枝状聚甘油聚阴离子硫酸, 形成L-选择素/P-选择素(L-selectin/P-selectin)特异性复合物,可靶向监测炎性反应。将该炎症特异性探针局部注射至关节炎模型小鼠的膝关节及踝关节进行PAI,发现其光声信号强度明显高于健康小鼠,且与增强MRI及组织学结果相一致[39]。
另有研究发现,用于治疗OA的抗炎药氯法齐明(Clofazimine,CFZ)在450 nm时光吸收系数较高,亦可用于PAI。CFZ 在巨噬细胞内聚集,可用于指导细胞特异性诊断和治疗的监测。光声显微成像技术证实CFZ可应用于光声分子成像,并进一步在双模态PA/US成像系统上对注射CFZ的模型、动物模型及尸体手指关节进行显像,均可得到满意的光声信号,提示PAI技术可用于CFZ治疗OA的药物监测[40]。
5 小结与展望
PAI技术是一种新型、无创性医学影像学检测手段,其在关节成像中的应用价值已被相关研究证实,在关节炎性疾病的诊断、疗效监测等方面具有临床应用前景,其中PAI仪器与手持式超声探头的结合是未来临床转化型成像设备的重要研究方向。
作为一种新型影像学技术,PAI的图像分辨率尚低于目前临床常用的高度完善的影像学手段,未来尚需进一步优化改进、提高信噪比和分辨率,并消除伪像[41-42]。目前PAI技术在关节炎性疾病中应用的临床研究较少,且多数研究尚处于起步阶段,纳入病例数较少,对其临床价值论证不足。此外,将PAI技术与其他影像技术进行对比研究尚有欠缺,尚未对其优劣性作出评价。对于PAI技术测定血氧饱和度的功能成像,仍需进一步扩大样本量验证其对关节炎性疾病的诊断价值。
作者贡献:赵辰阳负责文献检索、文章撰写及修订;杨萌、朱庆莉、齐振红、姜玉新负责文章修订;张睿负责文献检索及文章修订。
利益冲突:无
