基于网络药理学和分子对接研究太子参抗心肌缺血的作用机制
2021-04-16滕力庆周涛王晓江维克
滕力庆,周涛,王晓,江维克*
(1. 贵州中医药大学,贵州 贵阳 550312;2.齐鲁工业大学(山东省科学院) 山东省分析测试中心,山东 济南 250014)
心肌缺血(myocardial ischemia)是指心脏中血液灌注不足导致其供氧减少及心肌能量代谢异常的一种病理状态[1]。多种因素可致心肌缺血,其中较常见的发病原因为冠状动脉对心肌的供血、供氧不足[2]。由于心肌缺血发病病因及机制的复杂性,临床上常采用综合手段进行治疗。中药具有多成分、多靶点及多通路的协同调控作用,在心肌缺血治疗中的应用逐渐增多。
太子参为石竹科植物孩儿参Pseudostellariaheterophylla(Miq.)Pax ex Pax et Hoffm.的干燥块根,其性甘、微苦,平。归脾、肺经,具有补气健脾、生津润肺的功效[3]。2015版《中国药典》记载太子参具有益气健脾、生津润肺的作用[4]。现代药理研究表明:太子参多糖具有心肌保护作用,能够促进氧自由基清除,减轻心肌损伤及预防心率失常[5];太子参皂苷可通过抗氧化应激及抑制细胞凋亡保护心肌细胞,减轻氧化损伤[6]。
中药网络药理学是基于系统生物学理论,从整体调控角度分析单味中药或中药复方药效作用机制的一种方法[7]。现有研究对太子参抗心肌缺血的机制仅涉及抗氧化应激、抑制心肌细胞凋亡及促进血管新生[8]层面,因此,其具体作用机制有待深入挖掘。为此,本研究应用网络药理学和分子对接的方法探讨太子参抗心肌缺血的分子作用机制,并将其关键靶点与活性成分进行分子对接验证,为太子参抗心肌缺血作用机制的研究提供基础。
1 材料与方法
1.1 太子参活性成分的筛选及对应靶点预测
以“太子参”为关键词,通过检索中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)数据库(http://tcmspw.com/tcmsp.php)获取太子参的活性化合物基本信息,利用口服生物利用度(oral bioavailablility,OB)≥30%和药物类药性(drug-likeness,DL)≥0.18进行筛选,同时查阅文献补充未纳入的成分。应用TCMSP、Pubmed(https://pubmed.ncbi.nlm.nih.gov/)及SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)预测所得活性成分对应的靶蛋白,借助uniprot数据库(https://www.uniprot.org/)将靶点蛋白规范成相应的基因名。
1.2 心肌缺血相关靶点的检索及太子参抗心肌缺血关键靶点作用网络构建
以“myocardial ischemia”为关键词,通过检索Pubmed、ctd(http://ctdbase.org/)、DrugBank(https://www.drugbank.ca/)及Genecards(https://www.genecards.org/)等数据库筛选心肌缺血作用靶点,将所得靶点去除重复项后获得心肌缺血相关靶点。
将1.1节所得太子参活性成分对应靶点与心肌缺血相关靶点借助OmicShare(http://www.omicshare.com/tools/)网站取交集,获取太子参抗心肌缺血的作用靶点。将交集靶点通过STRING(https://string-db.org/)数据库构建蛋白质-蛋白质相互作用网络(protein-protein interaction,PPI),设置最小相互作用得分(interaction score >0.7),获取太子参抗心肌缺血核心靶点网络。
1.3 GO功能及Pathway富集分析
将1.2节所得交集靶点数据借助WebGestalt数据库(http://www.webgestalt.org/)进行基因本体( gene ontology,GO)功能富集分析,其中GO功能包括细胞组分(cell component,CC)、生物过程(biological processes,BP)及分子功能(molecular function,MF)。使用Cytoscape软件中的ClueGo插件对交集靶点进行Pathway富集分析,选取基因数排名前10的通路,通过OmicShare网站绘制气泡图。
1.4 分子对接
采用AutoDock Tools 1.5.6软件对太子参抗心肌缺血关键靶点PPI网络中度值(degree)前3的靶点蛋白与入血活性成分进行分子对接验证。通过TCMSP数据库获取化合物的三维结构,借助RCSB PDB网站获取靶点蛋白的三维结构。通过AutoDock Tools对上述蛋白受体和配体进行常规处理,借助其插件Autogrid获得对接活性位点,进行分子对接,获取化合物与靶点蛋白对接结合能,使用PyMOL 2.4.0软件将对接结果进行可视化分析。
2 结果
2.1 太子参活性成分的筛选及对应靶点预测
共筛选获得太子参活性成分8个,分别为角鲨烯(Supraene)、刺槐素(Acacetin)、蒙花甙(Linarin)、β-谷甾醇(beta-sitosterol)、木犀草素(Luteolin)、蒲公英萜醇(Taraxerol)、仙人掌甾醇(Schottenol)及亚油酸甘油酯(1-Monolinolein),预测获得靶点251个,其活性成分的基本信息见表1。
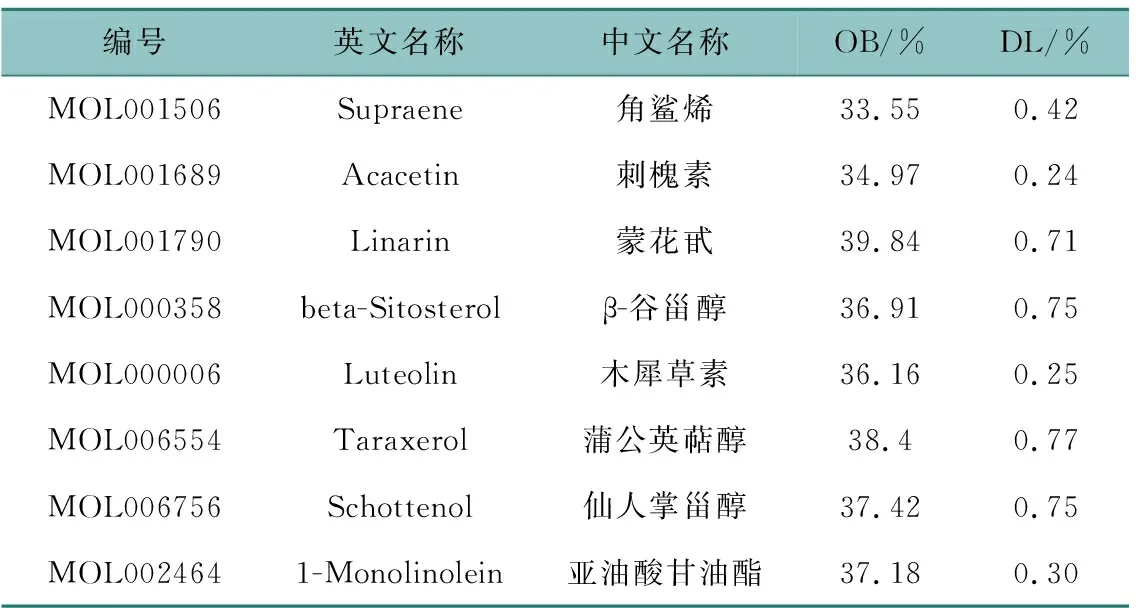
表1 太子参活性成分基本信息
2.2 心肌缺血相关靶点的检索及太子参抗心肌缺血关键靶点作用网络构建
通过检索Pubmed、CTD、DrugBank及Genecards等数据库获得心肌缺血相关靶点548个。
通过Venn软件将太子参活性成分对应靶点与心肌缺血相关靶点取交集,获取太子参抗心肌缺血的作用靶点(图1)。将交集靶点通过STRING网站构建PPI网络(图2),靶点与靶点之间的关系达278条,节点越大表示其在网络中的作用越大。设置最小相互作用得分,获得太子参抗心肌缺血核心靶点28个(表2)。将28个核心靶点及与之对应的活性成分信息导入Cytoscape软件中,选择工具栏下的“NetworkAnalyzer”进行网络分析,获取目标基因的度值。其中目标基因为节点,一个节点的度值表示网络中与该节点相连的全部路线条数。
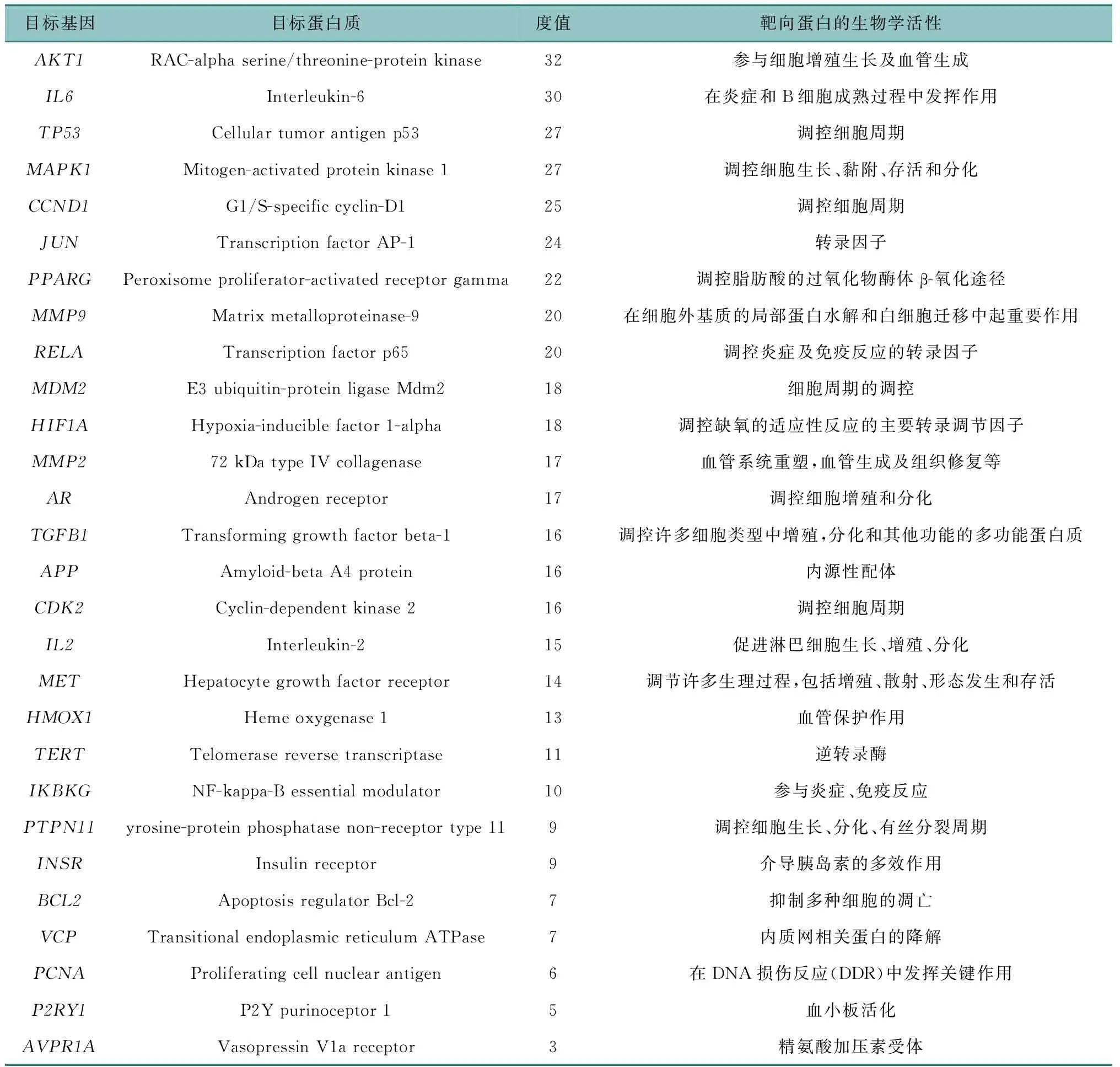
表2 太子参抗心肌缺血核心靶点信息表
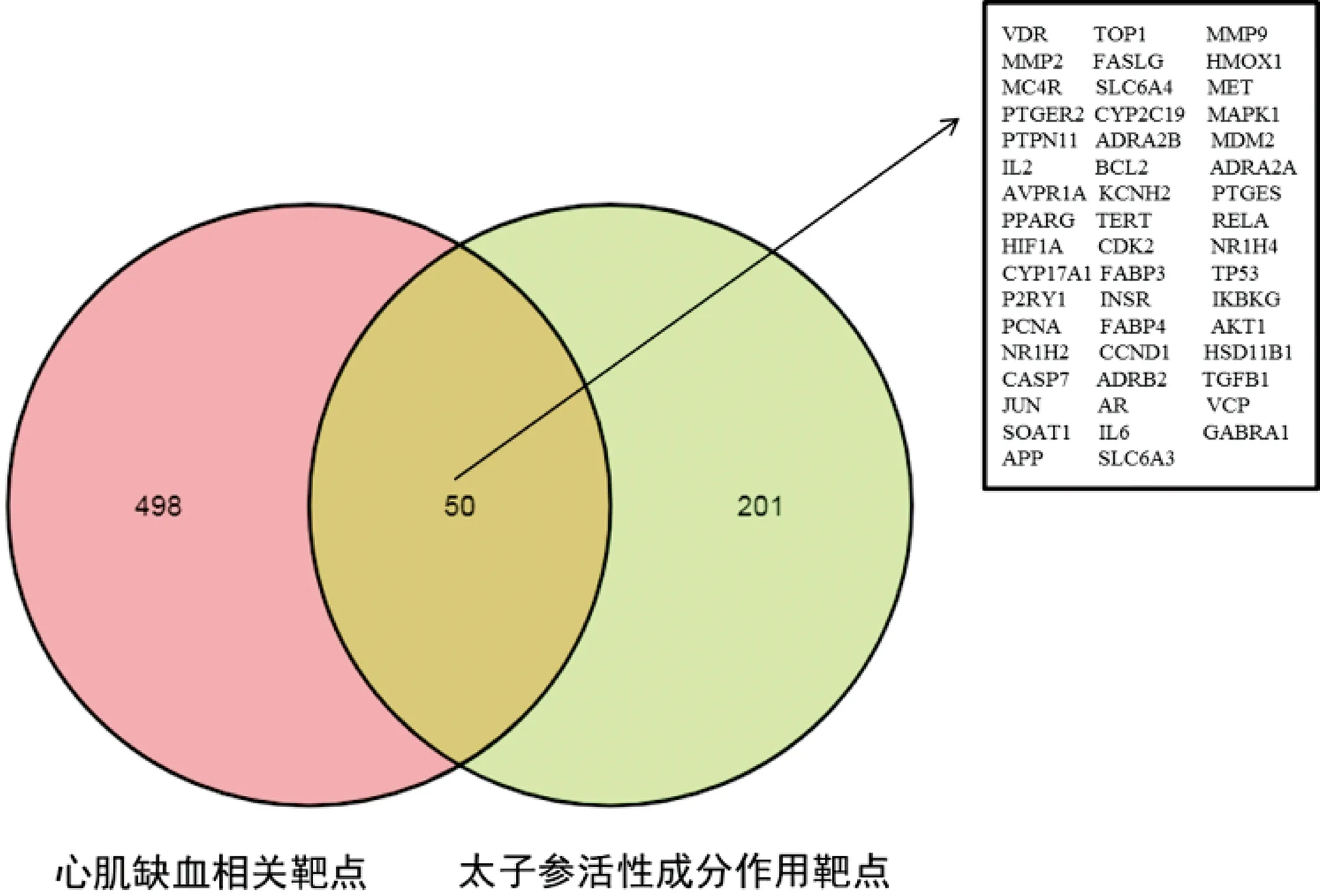
图1 太子参活性成分作用靶点与心肌缺血相关靶点Venn图Fig.1 Venn diagram of targets of active components of Pseudostellariae Radix and targets related to myocardial ischemia
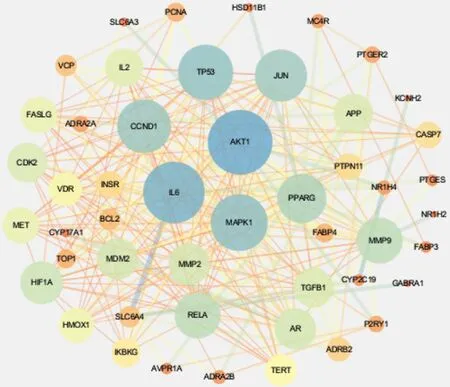
图2 太子参抗心肌缺血关键靶点PPI网络Fig.2 PPI network of key targets of Pseudostellariae Radix against myocardial ischemia
2.3 GO功能及Pathway富集分析
将太子参抗心肌缺血关键靶点借助WEB-based Gene SeT AnaLysis Toolkit进行GO富集分析(图3),表明太子参抗心肌缺血主要参与细胞凋亡、血管新生及炎症反应等生物学过程,其中BP富集基因数量较大的有生物调控、代谢过程、刺激反应及多细胞生物过程;CC富集基因数量较大的有细胞核、细胞膜、腔上包膜及蛋白质复合体;MF富集基因数量较大的有蛋白质结合、离子结合、核酸结合及分子传递活性。利用Cytoscape软件中的ClueGo插件对交集靶点进行Pathway富集分析,基因数排名前10位的信号通路见图4。太子参抗心肌缺血的通路主要涉及MyD88-independent TLR4 cascade(非依赖MyD88的TLR4信号传导通路)、MyD88:Mal cascade initiated on plasma membrane(MyD88:质膜上启动的MAL级联)、Activated TLR4 signalling(激活的TLR4信号通路)、Toll Like Receptor 4 (TLR4) Cascade(Toll样受体4(TLR4)级联)及Intrinsic Pathway for Apoptosis(细胞凋亡的内在途径),相关基因包括JUN、MAPK1、IKBKG、PTPN11及RELA等。Pathway分析会对每个有差异基因存在的pathway返回一个P值,小的P值表示差异基因在该Pathway 中出现了富集(表3)。

表3 太子参抗心肌缺血关键靶点Pathway富集分析相关基因

图3 太子参抗心肌缺血关键靶点GO富集分析Fig.3 GO enrichment analysis of key targets of Pseudostellariae Radix against myocardial ischemia
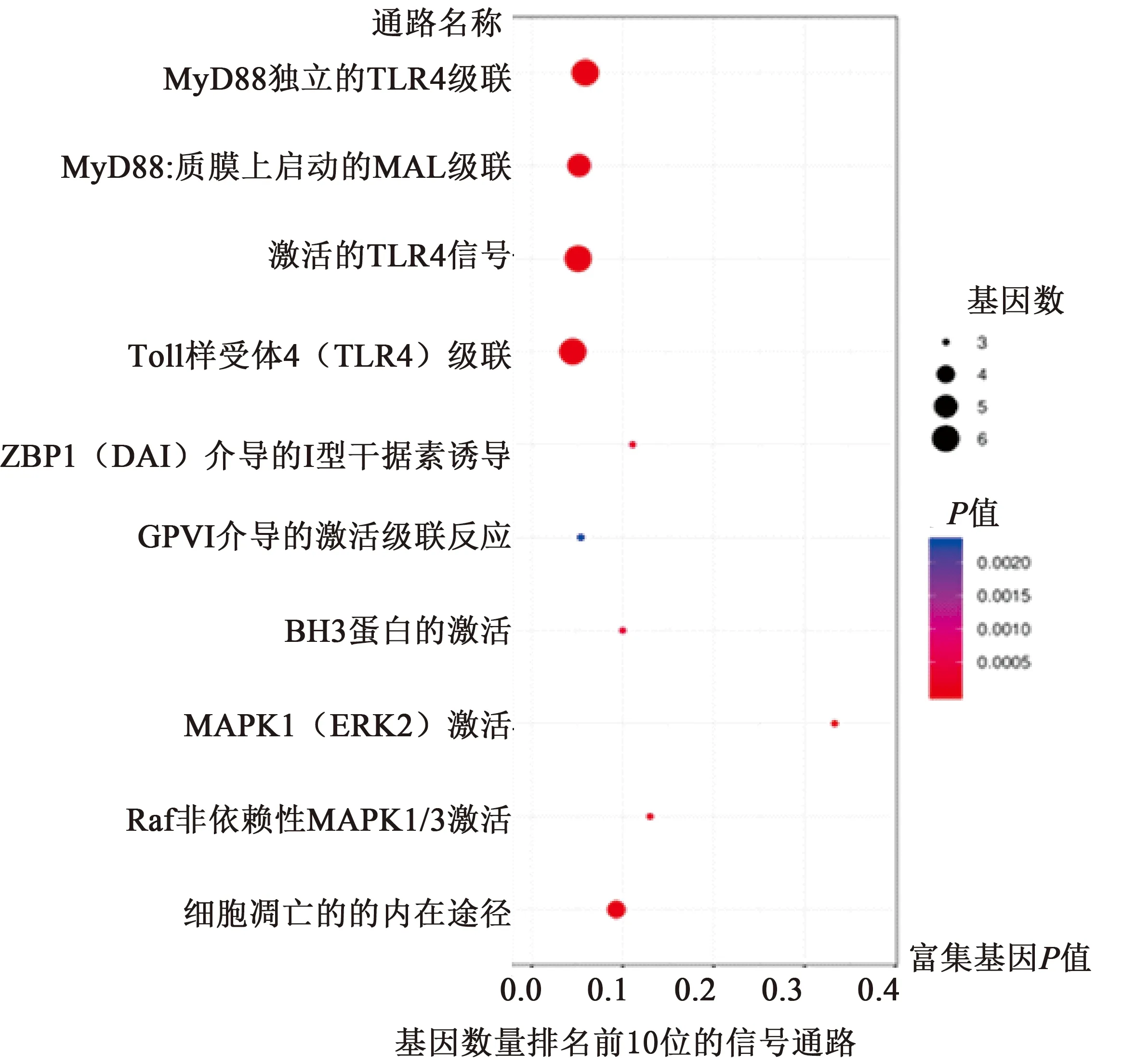
图4 太子参抗心肌缺血关键靶点Pathway富集分析Fig.4 Pathway enrichment analysis of key targets of Pseudostellariae Radix against myocardial ischemia
2.4 分子对接
选取太子参抗心肌缺血关键靶点PPI网络中度值排名前3位的靶点(AKT1、IL6、MAPK1、TP53)与太子参活性化合物进行分子对接验证,结果见表4。若结合能小于0,表明配体分子均能和受体蛋白自发地结合,结合能越小对接越好。其中,蒲公英萜醇(Taraxerol)与靶点AKT1、IL6、MAPK1、TP53的结合性最好,Taraxerol与靶点AKT1、IL6、MAPK1、TP53的最佳复合结构见图5。

表4 太子参活性化合物与关键靶点的对接结合能

图5 Taraxerol与关键靶点的分子对接图Fig.5 Molecular docking diagram of Taraxerol and key targets
3 讨论
中医学中没有“心肌缺血”这一病名,根据病位及胸闷、胸痛的临床表现将其归为“胸痹”“心悸”等范畴[9]。《张氏医通·悸》[10]所谓:“夫气虚者,由阳气内微,心下空虚,内动为悸”。心肌缺血发生时心脏受损,心阳虚衰致脏腑功能、气机升降等失调,导致痰、湿、瘀等病理产物的发生[11]。因此,心阳虚衰,痰瘀阻络为心肌缺血发生的病因病机。近年来,心肌缺血的治疗多采用中西医结合的治疗方法,中药在改善心肌缺血患者临床症状中起到一定的作用[12]。太子参为补虚药的代表药之一,其益气生津、强心等功效[13]与心肌缺血的病因病机相符合,使气充阴旺,血液顺畅则无瘀滞之虞[14]。现代药理研究表明[15],太子参可通过抗氧化应激、抑制心肌细胞凋亡及促进血管新生等途径干预心肌缺血。本研究应用网络药理学和分子对接的方法初步揭示太子参活性化合物抗心肌缺血的生物学过程,预测获得太子参抗心肌缺血的作用靶点及信号通路。
本研究结果显示,太子参的活性成分8个,对应的作用靶点有251个,其中与心肌缺血相同的作用靶点50个。PPI结果显示太子参抗心肌缺血的关键靶点为TGFB1、AVPR1A、MMP2、HIF1A、HMOX1、AKT1等。这些关键靶点参与血管系统重塑、血管生成、组织修复、炎症反应、免疫反应及细胞凋亡等生物学过程,涉及MyD88-independent TLR4 cascade、MyD88:Mal cascade initiated on plasma membrane、Activated TLR4 signalling、Toll Like Receptor 4 (TLR4) Cascade及Intrinsic Pathway for Apoptosis等通路,这些通路中的相关基因包括JUN、MAPK1、IKBKG、PTPN11及RELA等。借助分子对接技术将太子参活性成分与关键靶点PPI网络中度值排名前3位的靶点(AKT1、IL6、MAPK1、TP53)与太子参活性化合物进行分子对接验证,结果表明,蒲公英萜醇(Taraxerol)与靶点AKT1、IL6、MAPK1、TP53的结合性最好。
太子参活性成分中的蒲公英萜醇[16]、木犀草素[17]、β-谷甾醇[18]、刺槐素[19]及蒙花甙[20]均具有保护心肌细胞的作用。其中,蒲公英萜醇通过抑制氧化应激及炎症反应起到心肌保护的作用[16];木犀草素通过下调TLR4(Toll样受体4)、MyD88(髓样分化因子88)、NF-κB(核因子-kappa B)的表达,起到减轻炎症反应及心脏保护的作用[17];β-谷甾醇通过参与ERK1/2 信号通路,上调Bcl-2基因的表达,缓解心肌缺血再灌注大鼠的炎症损伤及抑制其心肌细胞凋亡[18];刺槐素通过介导MAPK和PI3K/Akt信号通路,激活PI3K下游靶点24,25Akt,促进心肌梗死后血管新生、改善心脏功能及抑制心肌重塑[19];蒙花甙通过激活Nrf-2起到抗氧化应激的作用,从而保护心肌组织免受局部缺血及其他损伤导致的损害[20]。
在缺血性心脏病中,冠状动脉再灌注可有效限制心肌梗塞面积,但在这一过程中由于TNF-α(肿瘤坏死因子α)和IL-6(白介素6)被释放引发炎症反应损伤心肌组织,会产生局部缺血再灌注损伤[21]。TLR4与心肌损伤密切相关,在心肌缺血发生时,激活后的TLR4通过介导MyD88依赖性途径增强NF-κB的活性,导致IL-1、IL-6、TNF-α等炎性因子的表达增加从而加重心肌细胞的损伤,因此,抑制HMGB1-TLR4-MyD88-NF-κB信号通路能够减轻炎症反应从而保护心脏组织[22]。关键靶点中HIF1A通过调控缺氧的适应性反应的主要转录调节因子及诱导AREG(双调蛋白)的表达,起到心脏保护的作用[23];MMP2参与血管系统重塑,血管生成及组织修复等过程[24]。
本文通过相关网络的构建,显示出太子参抗心肌缺血多成分、多靶点、多途径的特点,符合中医理论的治病特点,为太子参的临床应用提供了理论依据。目前研究报道太子参中其他成分如太子参多糖通过下调促凋亡相关蛋白Bax、Caspase-3和上调抑凋亡相关蛋白Bcl-2的表达来抑制心肌细胞的凋亡[5];太子参环肽B通过上调血管内皮细胞中VEGF165的表达,激活MAPK下游的ERK信号传导通路,促进血管内皮细胞的增殖和迁移[8]。本文通过预测,发现蒲公英萜醇与抗心肌缺血的关键靶点AKT1、IL6、MAPK1、TP53的结合性最好,激活MyD88-independent TLR4 cascade、MyD88:Mal cascade initiated on plasma membrane、Activated TLR4 signalling、Toll Like Receptor 4 (TLR4) Cascade及Intrinsic Pathway for Apoptosis等通路抑制心肌细胞凋亡、减轻炎症反应及促进血管新生,其抗心肌缺血作用值得深入研究。然而网络药理学不涉及活性成分之间的协调作用及在体内的代谢变化过程,因此本研究仅是理论基础上的预测,后续还需通过进一步实验验证药物的药效作用机制。
