大鳞副泥鳅蛋白制备ACE抑制肽的酶解方式研究
2021-04-16何泽贺肖宇刘建朝桑亚新孙纪录
何泽贺,肖宇,刘建朝,桑亚新,孙纪录*
(1.河北农业大学食品科技学院,河北保定071000;2.唐山市水产技术推广站,河北唐山063000)
血管紧张素转换酶(angiotensin converting enzyme,ACE)是一种锌蛋白酶,在调节血压中起着重要作用。ACE 可以水解血管紧张素-I(无活性的十肽),形成血管紧张素-II(有活性的八肽),收缩血管,并使血管舒张剂缓激肽失活[1]。因此,抑制ACE 活性被认为对预防高血压有效。合成的ACE 抑制剂,如卡托普利、依那普利和赖诺普利等,已被用于治疗高血压的药物。但是,合成的ACE 抑制剂具有不良副作用,如引发咳嗽、味觉障碍和皮疹。因此,目前通过酶解食物蛋白制备食源性的ACE 抑制肽,已获得广泛关注[2]。
大鳞副泥鳅(Paramisgurnus dabryanus),属鲤形目、鳅科、花鳅亚科、副泥鳅属,主要分布于长江、嘉陵江和岷江水系、辽河中下游、黄河及黑龙江等地区,是一种营底栖生活的小型鱼类。大鳞副泥鳅的蛋白质含量约为20%,脂肪含量约为2%,是功能性食品开发与综合利用的优质蛋白[3]。泥鳅还具有多种生理活性,可预防血管硬化,对高血压、贫血等患者有辅助治疗作用。因此,利用泥鳅蛋白制备ACE 抑制肽是一项值得探究的工作。
目前,以泥鳅为原料制备ACE 抑制肽的研究,多选用菠萝蛋白酶和碱性蛋白酶,进行酶解工艺的优化和营养学评价。姚东瑞等[4]将用泥鳅制备的ACE 抑制肽进行了初步纯化,李莹等[5]进行了更深一步的纯化,获得了ACE 抑制肽氨基酸序列Ala-His-Leu-Leu(452 Da)。然而,这些报道对于所用蛋白酶的选择原因并未进行深入的解释。ACE 抑制肽的定量构效关系(quantitative structure-activity relationship,QSAR)的研究显示[6],ACE 抑制肽的C 端氨基酸是与ACE 活性部位结合的关键,其疏水性和肽的ACE 抑制活性之间呈正相关[7]。C 端氨基酸为具环状结构的芳香族氨基酸或脯氨酸时,ACE 抑制肽的活性一般较强,如Ile-Pro-Pro 和Val-Pro-Pro[8]。大多数天然降血压肽的C-末端都具有脯氨酸,而且,目前广泛用于治疗高血压的肽类药物,如卡托普利和赖诺普利,都是C 端为脯氨酸的化学合成品。同时,ACE 抑制肽的活性与肽段长度有关,小分子量寡肽活性高于大分子量寡肽,2 个~12 个氨基酸的寡肽活性较强。
本文根据大量已知ACE 抑制肽的序列分析,由不同蛋白酶的作用位点专一性来选择水解泥鳅蛋白的蛋白酶种类。α-胰凝乳蛋白酶可从酪氨酸、色氨酸和苯丙氨酸的羧基处切断肽键,碱性蛋白酶的作用位点在疏水性氨基酸末端,脯氨酸蛋白酶是一种高度专一的蛋白酶,它只从脯氨酸的羧基端裂解多肽。因此,本文首先使用高效液相色谱法(high performance liquid chromatography,HPLC)分析大鳞副泥鳅蛋白的氨基酸组成,然后,选择这3 种蛋白酶对大鳞副泥鳅蛋白进行酶解方式的研究,并使用N-三(羟甲基)甲基甘氨酸十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(tricine sodium dodecyl sulfate -polyacrylamide gel electrophoresis,Tricine-SDS-PAGE)[9]进一步分析不同蛋白酶对泥鳅蛋白水解的情况,旨在为制备高活性的ACE 抑制肽提供理论指导。
1 材料与方法
1.1 材料与试剂
大鳞副泥鳅:河北农业大学农业科技市场。取回后,于沸水中热烫约30 s 去黏液,去头、尾、皮、骨、内脏,用搅拌机将泥鳅肉捣碎,得到肉糜,-20 ℃冷冻贮藏。
α-胰凝乳蛋白酶(3 000 U/mg):梯希爱(上海)化成工业发展有限公司;脯氨酸蛋白酶(26 U/mL):夏盛(北京)生物科技开发有限公司;碱性蛋白酶(200 U/mg)、血管紧张素转化酶(2.0 U/mL)、N-[3-(2-呋喃)丙烯醇酰]-2-苯丙氨酰甘氨酰甘氨酸[N-(3-(2-furyl)acryloyl)-L-phenylalanyl-glycyl-glycine,FAPGG]、三羟甲基氨基甲烷[tris(hydroxymethyl)methyl aminomethane,Tris]、三(羟甲基)甲基甘氨酸:美国Sigma 公司;Tricine-SDS-PAGE 凝胶制备试剂盒:北京康为世纪生物科技有限公司;氨基酸标准品、磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸、氯化钠:国药集团化学试剂有限公司。以上化学试剂均为分析纯。
1.2 设备与仪器
JYL-C020E 绞肉机:九阳股份有限公司;FS-2 匀浆机:巩义市宏华仪器设备工贸有限公司;Multiskan FC 酶标仪:赛默飞世尔科技公司;Beta1-8 LD plus 冷冻干燥机:德国Marin Christ 公司;SHA-B 水浴恒温振荡器:江苏正基仪器有限公司;ST5000pH 计:美国奥豪斯公司;5418 R 冷冻离心机:德国艾本德公司;BSA 电子天平:德国赛多利斯公司;MSH-R-03P 数显磁力加热搅拌器:杭州秋籁科技有限公司;HH-601 超级恒温水浴锅:常州迅生仪器有限公司;MIX1000 涡旋混匀仪:广东佛衡仪器有限公司。
1.3 试验方法
1.3.1 泥鳅蛋白的氨基酸组成测定
将大鳞副泥鳅蛋白置于水解管中,加入6 mol/L 的HCl 溶液水解24 h,使用高效液相色谱法测定除色氨酸以外的17 种氨基酸含量。其中色氨酸用NaOH 水解后再测定[10-11]。
1.3.2 泥鳅蛋白酶解工艺流程
泥鳅肉糜→解冻→匀浆→酶解→灭酶(沸水,10min)→冷却→离心(4 000 r/min,20 min)→取上清液→-18 ℃保存或冻干备用。
1.3.3 泥鳅肉糜处理
泥鳅肉糜常温解冻,然后与磷酸缓冲溶液制备成10%的肉糜匀浆。
1.3.4 泥鳅蛋白的单一酶解
分别使用脯氨酸蛋白酶、碱性蛋白酶和α-胰凝乳蛋白酶对泥鳅肉糜匀浆进行单一酶解。在酶解过程中,分时段取样,测定水解度和ACE 抑制率。3 种蛋白酶的酶解条件如表1 所示[12-13]。
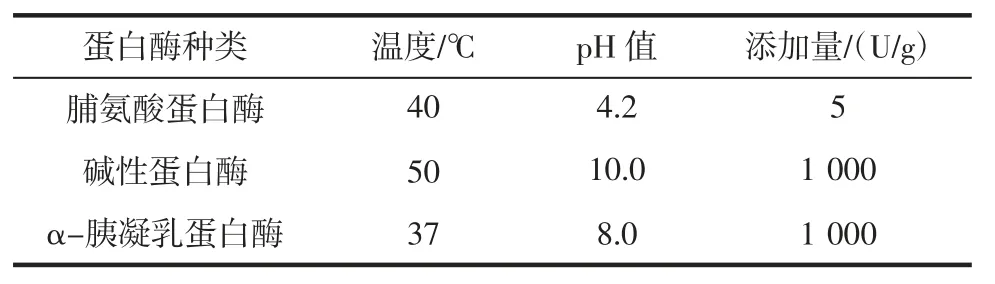
表1 3 种蛋白酶的酶解条件Table 1 Enzymatic conditions for three kinds of proteases
1.3.5 泥鳅蛋白的复合酶解
本研究将复合酶解分为双酶分步酶解和双酶同步酶解两种酶解方式。
1.3.5.1 双酶分步酶解
试验分为两组,酶解方式①:在泥鳅肉糜匀浆中,先加入碱性蛋白酶,在50 ℃、pH10、添加量1 000 U/g的条件下酶解,酶解时间为碱性蛋白酶最佳酶解时间,然后,调节条件为40 ℃、pH4.2,再加入脯氨酸蛋白酶5 U/g 继续酶解。酶解方式②:先加入脯氨酸蛋白酶,在40 ℃、pH4.2、添加量5 U/g 的条件下酶解,酶解时间为脯氨酸蛋白酶最佳酶解时间,然后,调节条件为50 ℃、pH10,再加入碱性蛋白酶1 000 U/g 继续酶解。
在酶解过程中,分时段取样,测定ACE 抑制率[14-16]。
1.3.5.2 双酶同步酶解
在泥鳅肉糜匀浆中,同时加入碱性蛋白酶和脯氨酸蛋白酶,碱性蛋白酶的有效温度范围为20 ℃~60 ℃,有效pH6~11。脯氨酸蛋白酶的有效温度范围15 ℃~60 ℃,有效pH3~7。所以选择复合酶解条件为40 ℃、pH7、碱性蛋白酶添加量为1 000 U/g、脯氨酸蛋白酶添加量为5 U/g。
在酶解过程中,分时段取样,测定ACE 抑制率[14-16]。
1.3.6 水解度的测定方法
将样品酶解液稀释至合适倍数,取2.00 mL 稀释液,向其中加入1.00 mL 茚三酮显色剂,混匀后,沸水浴加热15 min。然后,在冷水中冷却,终止显色反应。然后,加入5.00 mL 40%乙醇溶液,涡旋振荡。室温(25 ℃)放置15 min,570 nm 处测定吸光度值。
标准曲线的绘制:制备1 000 mg/L 甘氨酸溶液,稀释该溶液使其最终显色时浓度范围为0.5 mg/L~6.0 mg/L。取2 mL 待测液进行显色反应,然后于570 nm 处测定其吸光度值,以加入蒸馏水的试样为空白。根据测定值绘制标准曲线。根据样品的吸光度值,用标准曲线计算出酶解液中的-NH2的含量(μmol/mL),进一步根据如下公式计算水解度(degree of hydrolysis,DH)[17]。
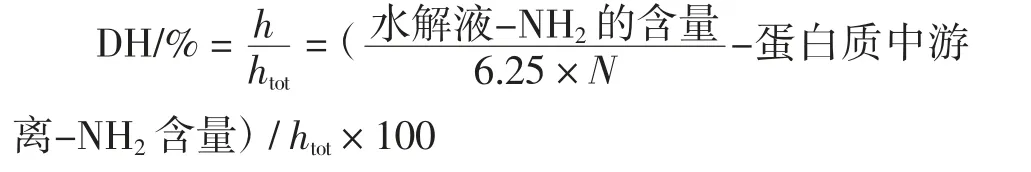
式中:h 为水解过程中每克蛋白质被裂解的肽键含量,mmol/g;htot为每克原料蛋白质的肽键含量,mmol/g,根据泥鳅蛋白氨基酸组成为8.4 mmol/g;6.25 为蛋白质系数;N 为蛋白质氮含量,mmol/g。
1.3.7 ACE 抑制率测定方法
将10 μL 的ACE 溶液(0.25 U/mL)和10 μL 蛋白水解液加入微孔板的微孔中但不混合,加入150 μL 经过预热的底物(1.0 mmol/L FAPGG 溶解于50 mmol/L 的Tris-HCl,pH7.5,包含0.3 mol/L NaCl),使其开始反应。迅速将微孔板放入酶标仪中并加热到37 ℃,每1 min 记录1 次在340 nm 下的吸光值,共记录20 min。空白对照使用10 μL 的缓冲液代替蛋白水解液。以吸光值(A340)对时间作曲线,计算斜率[18]。
ACE 抑制率/%=(1-ΔA抑制剂/ΔA空白)×100
式中:ΔA抑制剂为添加抑制剂,吸光值对时间的曲线在10 min~20 min 的斜率;ΔA空白为空白对照,吸光值对时间的曲线在10 min~20 min 的斜率。
IC50为抑制50%ACE 活性时所需酶解样品的质量浓度。用SPSS 13.0 统计软件的概率单位法计算。
1.3.8 Tricine-SDS-PAGE
将泥鳅蛋白酶解物与上样缓冲液混合,沸水浴5 min,12 000 r/min 离心5 min,上清液为待电泳样品。配制16.5%的分离胶、夹层胶和浓缩胶,上样10 μL,80 V 恒压电泳30 min,100 V 恒压电泳至终点[19]。用考马斯亮蓝R250 过夜染色,脱色至背景无色,然后拍照记录并分析条带。
1.4 统计学分析
试验数据以Means±SD 表示,运用SPSS 13.0 统计软件做方差分析,比较各组之间的差异性。
2 结果与分析
2.1 大鳞副泥鳅蛋白的氨基酸组成分析
大鳞副泥鳅蛋白的氨基酸组成见表2。
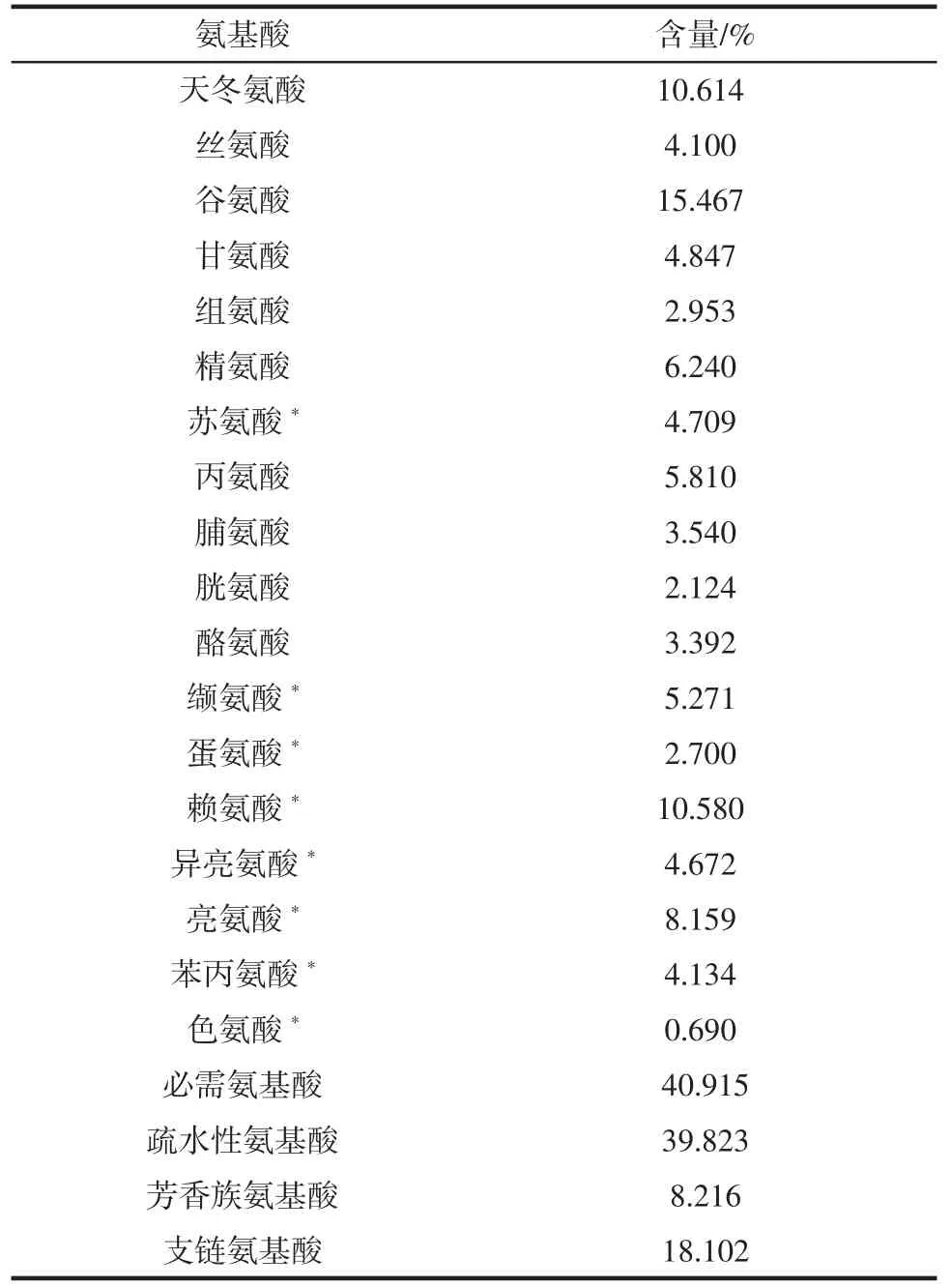
表2 大鳞副泥鳅蛋白的氨基酸组成Table 2 Amino acid composition of loach protein
表2 表明大鳞副泥鳅蛋白中脯氨酸和芳香族氨基酸(色氨酸、酪氨酸和苯丙氨酸)占氨基酸总量的11.756%。左琦等[6]分析了食源性ACE 抑制肽C 末端氨基酸出现频率,脯氨酸、色氨酸、酪氨酸、苯丙氨酸是ACE 抑制肽的主要C 端氨基酸。由氨基酸分析结果得出大鳞副泥鳅是制备ACE 抑制肽的良好来源。其中脯氨酸含量为3.540%,在鱼类蛋白中含量较高,使用泥鳅蛋白制备C 末端为脯氨酸的ACE 抑制肽原料充足。大鳞副泥鳅蛋白的疏水性氨基酸含量达39.823%,芳香族氨基酸含量8.216%,支链氨基酸含量18.102%。黎观红[20]研究了多种蛋白质的氨基酸组成与其酶解产物ACE 抑制活性之间的关系,通过多元统计分析得出,蛋白质中疏水性氨基酸含量、芳香族氨基酸含量、支链氨基酸含量均与酶解产物的ACE 抑制活性呈正相关,它们是泥鳅蛋白具有降压特性的重要物质基础。通过蛋白酶对泥鳅蛋白专一性酶解,释放的含有这些特定氨基酸的肽段,有可能具有较高的降压活性。
2.2 单一酶解方式产生泥鳅蛋白ACE 抑制肽的进程
2.2.1 脯氨酸蛋白酶对泥鳅蛋白的水解情况
脯氨酸蛋白酶对泥鳅蛋白的水解情况见图1。
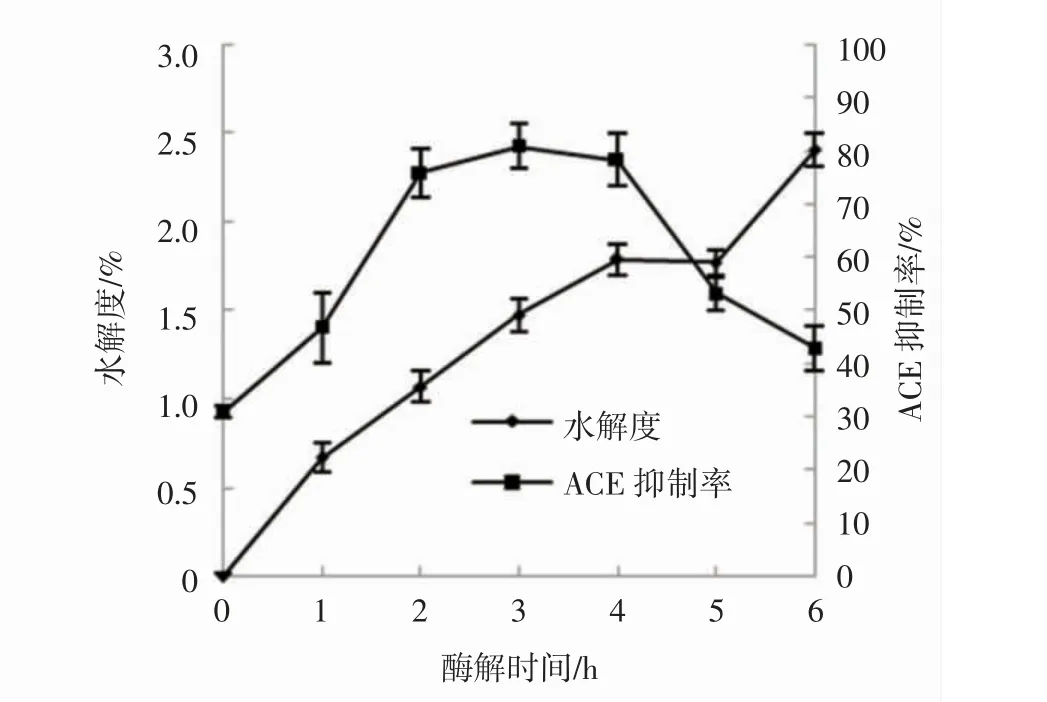
图1 脯氨酸蛋白酶酶解泥鳅蛋白过程中水解度和ACE 抑制率的变化Fig.1 Changes of hydrolysis degree and ACE inhibition rate during hydrolysis of loach protein by brewers clarex
由图1 可见,脯氨酸蛋白酶为专一性蛋白酶,活性位点单一,对蛋白的水解度较小。使用脯氨酸蛋白酶酶解泥鳅蛋白,水解度在不断增加,在6 h 的水解度达到2.41%,ACE 抑制率呈先上升后下降趋势,在3 h 达到最大值81.01%。ACE 抑制率受到产生的ACE 抑制肽的含量和抑制活性影响,ACE 抑制率随着水解度的增加先增加后减小,当水解度缓慢变化趋于平稳时具有活性的多肽被水解成高活性或者没有活性的多肽,所以ACE 抑制率随之改变。综上,3 h 为脯氨酸蛋白酶的最佳酶解时间,此时水解度为1.48%。
2.2.2 α-胰凝乳蛋白酶对泥鳅蛋白的水解情况
α-胰凝乳蛋白酶对泥鳅蛋白的水解情况见图2。
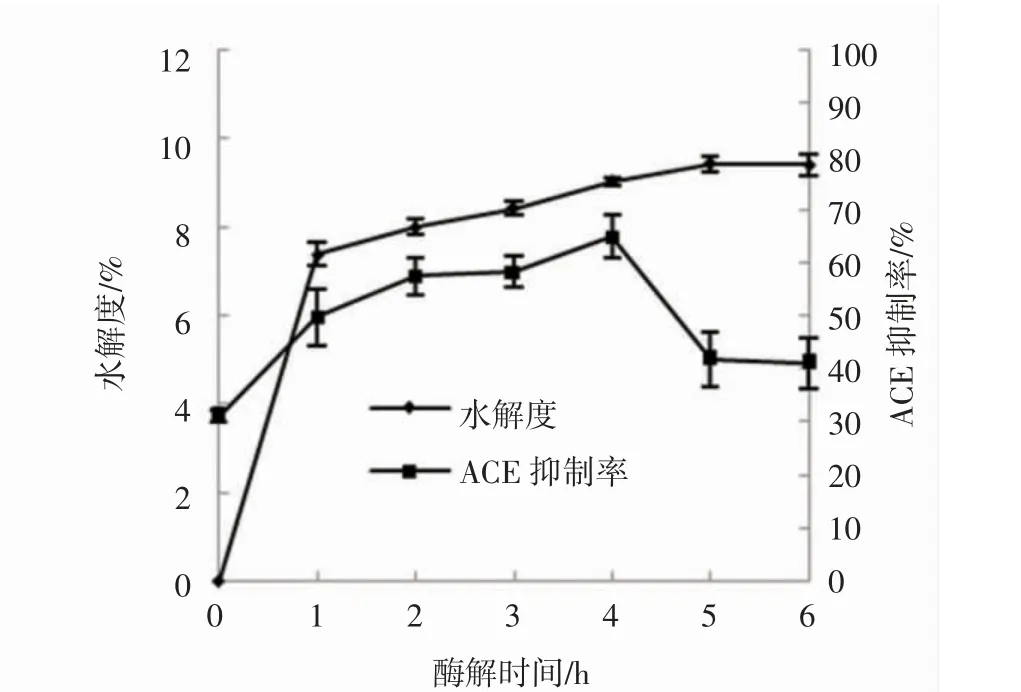
图2 α-胰凝乳蛋白酶酶解泥鳅蛋白过程中水解度和ACE 抑制率的变化Fig.2 Changes of hydrolysis degree and ACE inhibition rate during hydrolysis of loach protein by α-chymotrypsin
由图2 可见,使用α-胰凝乳蛋白酶酶解大鳞副泥鳅蛋白,随着酶解时间延长,水解度不断升高,5 h 达到最大水解度(9.43%),随后略有下降。酶解产物的ACE抑制率在未酶解前为31.08%,随着酶解时间延长,ACE 抑制率呈先上升后下降趋势,在4 h 达到ACE 抑制率最高点(64.91%)。由此可见,水解度最大时的ACE 抑制率并非最高,表明肽的大小对其活性的影响非常重要。综上,4 h 为α-胰凝乳蛋白酶的最佳酶解时间,此时水解度为9.04%。
2.2.3 碱性蛋白酶对泥鳅蛋白的水解情况
碱性蛋白酶对泥鳅蛋白的水解情况见图3。
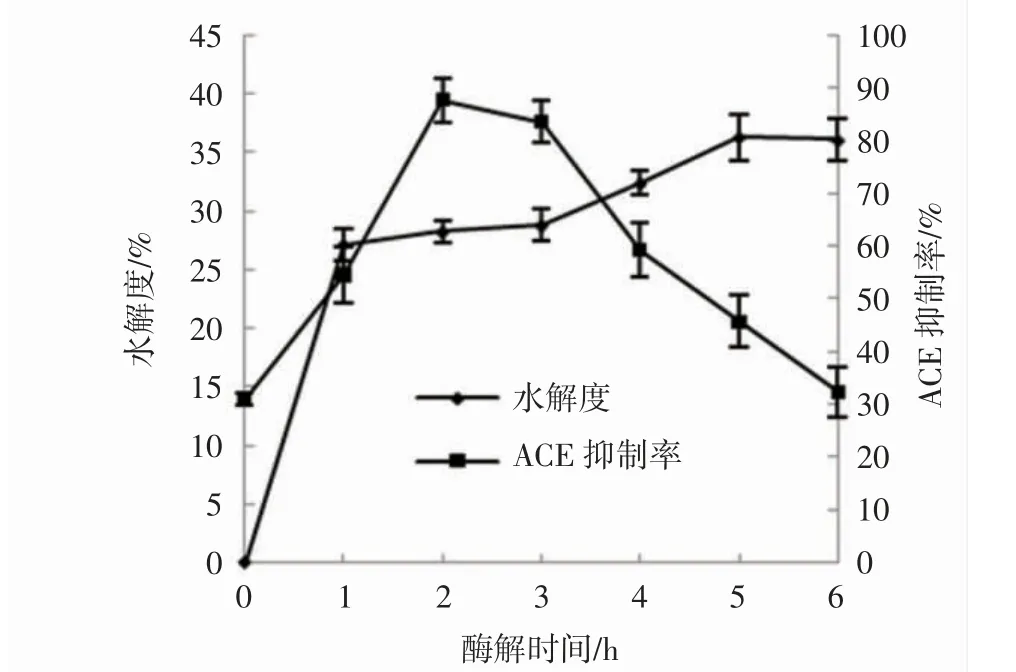
图3 碱性蛋白酶酶解泥鳅蛋白过程中水解度和ACE 抑制率的变化Fig.3 Changes of hydrolysis degree and ACE inhibition rate during the hydrolysis of loach protein by alkaline protease
由图3 可知,使用碱性蛋白酶酶解泥鳅蛋白,在1 h 之内,水解度增加很快,随着时间的推移,水解速率下降,5 h 水解度达到最大值(36.39%)后,水解度几乎保持不变。酶解产物的ACE 抑制率随着酶解时间的延长呈现先上升后下降的趋势,在2 h 达到ACE 抑制率最高点(87.84%)。由此可见,肽的大小对其活性的影响非常重要。综上,2 h 为碱性蛋白酶的最佳酶解时间,此时水解度为28.29%。
比较受试的3 种蛋白酶酶解泥鳅蛋白所得的最高ACE 抑制率,选择碱性蛋白酶和脯氨酸蛋白酶进行分步酶解和同步酶解的研究。
2.3 复合酶解方式产生泥鳅蛋白ACE 抑制肽的情况
2.3.1 双酶分步酶解泥鳅蛋白的情况
双酶分步酶解泥鳅蛋白的情况见图4。
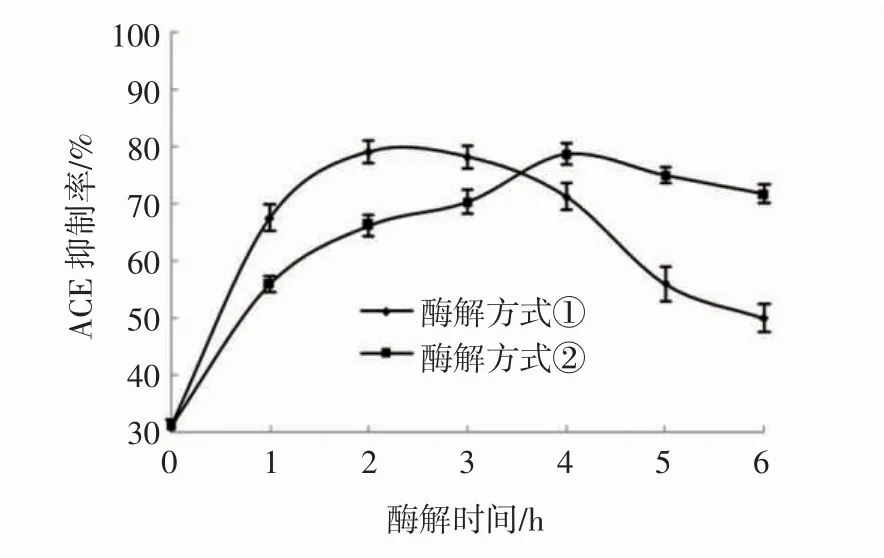
图4 分步酶解泥鳅蛋白过程中的ACE 抑制率变化Fig.4 Changes of ACE inhibition rate during stepwise enzymatic hydrolysis of loach protein
由图4 可知,在泥鳅蛋白的2 种分步酶解方式下,ACE 抑制率的变化趋势相同,均为先增大后减小。先加碱性蛋白酶酶解2 h 再加入脯氨酸蛋白酶酶解(方式①),ACE 抑制率在2 h 达到最大值79.17%。先加入脯氨酸蛋白酶酶解3 h 再加入碱性蛋白酶酶解(方式②),ACE 抑制率在4 h 达到最大值78.24%。两种分步酶解得到的酶解产物的ACE 抑制率均低于单一碱性蛋白酶酶解时的ACE 抑制率(87.84%)。这可能是由于在先后分批加入酶时,一部分被前一种蛋白酶酶解的有活性的肽段被后加入的酶继续酶解成了无活性的肽段。
2.3.2 双酶同步酶解泥鳅蛋白的情况
双酶同步酶解泥鳅蛋白的情况见图5。
由图5 可知,碱性蛋白酶和脯氨酸蛋白酶同时加入酶解,酶解产物的ACE 抑制率在3 h 达到最大值90.14%,高于2 种分步酶解方式和3 种单一蛋白酶酶解方式。所以,最佳酶解方式为脯氨酸蛋白酶和碱性蛋白酶同步酶解泥鳅蛋白,最佳酶解时间为3 h,此时,酶解液的ACE 抑制率最高IC50为0.491 mg/mL。
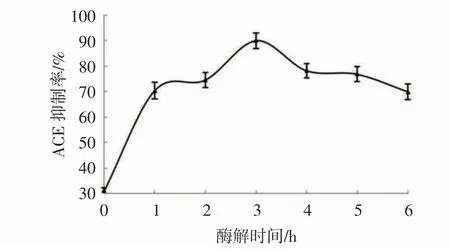
图5 同步酶解泥鳅蛋白过程中的ACE 抑制率变化Fig.5 Changes of ACE inhibition rate during simultaneous enzymatic hydrolysis of loach protein
已有研究表明,卡托普利对ACE 的IC50为1.30 ng/mL[21],本研究制备的大鳞副泥鳅蛋白水解物对ACE 的IC50虽然高于卡托普利,但是,低于LI 等研究的泥鳅的IC50(0.65 mg/mL)[22]。此外,与其它食源性ACE 抑制肽相比,大鳞副泥鳅蛋白水解物的ACE 抑制活性远高于小麦水解产物(IC50=2.79 mg/mL)[23]、绿豆蛋白水解产物(IC50=0.69 mg/mL)[24]、高粱蛋白水解产物(IC50=1.96 mg/mL)[25]。相比其它水产源蛋白水解物活性[例如菲律宾蛤仔(IC50=11.68 mg/mL)[26]、马面鱼(IC50=1.35 mg/mL)[27]、阿拉斯加鳕(IC50=11.68 mg/mL)],大鳞副泥鳅蛋白酶解产物的ACE 抑制活性较高。
2.4 大鳞副泥鳅蛋白水解产物的Tricine-SDS-PAGE结果
大鳞副泥鳅蛋白水解产物的Tricine-SDS-PAGE见图6。
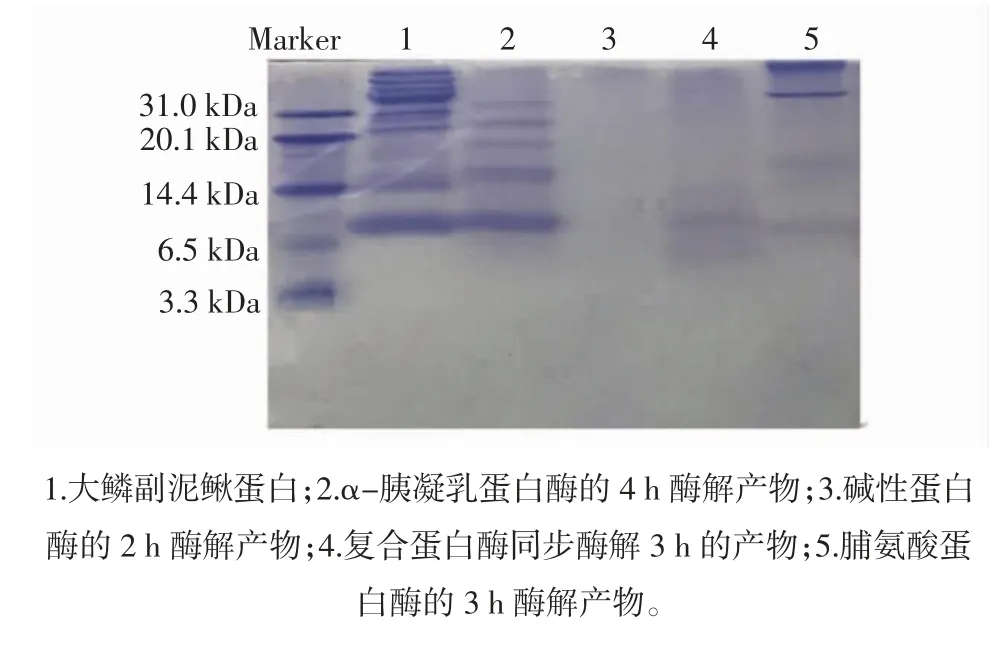
图6 泥鳅蛋白的不同蛋白酶酶解物的Tricine-SDS-PAGEFig.6 Tricine-SDS-PAGE of the hydrolysate of loach protein by different proteases
如图6 所示,相比于泥鳅蛋白(对照)的电泳条带,α-胰凝乳蛋白酶的酶解产物的电泳条带中,分子量>31 kDa 的条带明显变浅,表明α-胰凝乳蛋白酶将泥鳅蛋白中分子量大于31 kDa 的蛋白质酶解;碱性蛋白酶的酶解产物的电泳条带中,全部的条带明显变浅,表明碱性蛋白酶将泥鳅蛋白中大部分蛋白质组分酶解;脯氨酸蛋白酶的酶解产物的电泳条带中,分子量>31 kDa 的部分条带消失,分子量位于20.1 kDa~31.0 kDa范围的条带消失,分子量位于6.5 kDa~14.1 kDa 范围的条带变浅,表明脯氨酸蛋白酶将泥鳅蛋白中分子量位于6.5 kDa~31 kDa 范围的蛋白质组分酶解;复合酶同步酶解泥鳅蛋白的酶解产物中,分子量大的条带消失,6.5 kDa 以下分子量的条带出现。生物活性肽的相对分子质量通常小于6 000 Da,所以,复合蛋白酶同步酶解,产生了较大量的具有生物活性的多肽。
复合蛋白酶的酶解产物ACE 抑制率高于脯氨酸蛋白酶酶解产物ACE 抑制率。说明碱性蛋白酶与脯氨酸蛋白酶两种酶同时使用并未互相水解。结合电泳图结果分析,复合蛋白酶酶解产物与脯氨酸蛋白酶酶解产物的电泳条带相比>14.4 kDa 部分清晰条带消失,复合蛋白酶酶解了脯氨酸并未酶解的分子量>14.4 kDa部分蛋白。碱性蛋白酶的加入水解了大部分大分子蛋白,产生了更多小分子量且以脯氨酸为C 末端的多肽。但是水解产物活性的增加可能是水解出C 末端为疏水性氨基酸的ACE 抑制肽,也有可能是产生了更短且活性更强C 末端为脯氨酸的ACE 抑制肽,需要深入进行试验分析。
复合蛋白酶酶解的酶解产物ACE 抑制率略高于碱性蛋白酶酶解产物ACE 抑制率。结合电泳图结果分析,碱性蛋白酶将泥鳅蛋白酶解成的小分子多肽在电泳图中无法显示。复合蛋白酶酶解产物与碱性蛋白酶酶解产物的电泳条带相比<14.4 kDa 部分清晰条带出现,复合蛋白酶酶解产物出现了碱性蛋白酶酶解产物不存在的<14.4 kDa 部分蛋白。说明碱性蛋白酶与脯氨酸蛋白酶两种酶同时使用碱性蛋白酶丧失部分活性。对比碱性蛋白酶酶解产物,在复合蛋白酶酶解产物出现了6.5 kDa~14.4 kDa 范围蛋白,这部分蛋白组成是C 末端为脯氨酸或者疏水性氨基酸的多肽。复合蛋白酶酶解产物ACE 抑制活性较高,猜测这部分蛋白ACE 抑制活性较高。ACE 抑制肽的活性和肽链长度有关,肽链越短ACE 活性越高。6.5 kDa~14.4 kDa 蛋白产生的ACE 抑制肽大多是分子量小且末端为疏水性氨基酸的多肽,也可能存在少部分末端为脯氨基酸的ACE 抑制肽。复合蛋白酶酶解产物活性高于碱性蛋白酶酶解产物,说明6.5 kDa~14.4 kDa 这部分蛋白ACE抑制活性更高的应是末端为脯氨酸的降血压肽。猜测复合蛋白酶酶解产生了更多分子量更小同时活性更高的以脯氨酸为末端的ACE 抑制肽。
3 结论
大鳞副泥鳅蛋白含有丰富的疏水性氨基酸、芳香族氨基酸以及支链氨基酸,是制备ACE 抑制肽的良好来源。大鳞副泥鳅蛋白经碱性蛋白酶和脯氨酸蛋白酶的同步酶解后,水解物具有很高的ACE 抑制活性,IC50为0.491 mg/mL,最适酶解时间3 h。碱性蛋白酶与脯氨酸蛋白酶的组合,将大分子量的含有脯氨酸末端的肽段水解成了更小分子量的肽段,提高了酶解产物ACE抑制活性。
