五步法”突破电极反应式的书写
2021-04-16李静蕊张英锋
>>>李静蕊 张英锋
一、提出问题
在历年高考题中,电极反应式的书写是电化学知识的重要考查点,也是学生失分比较严重的题型。尤其当题干信息纷繁复杂、电极反应出现陌生物质的相互转化时,学生更是不知从何入手作答。近年来,许多文献开始从守恒的视角,按照“电子守恒—电荷守恒—原子守恒”的递进关系,分类阐述电极反应式的书写方法和技巧。周国亮提出的“析清池→列电极→标电子→定产物→建框架→三守恒”更是帮助学生形成了清晰的书写思路。而本文从电化学的基本原理入手,通过“负阳氧,正阴还”的电池模型,帮助学生确定电池和电极种类;通过标价态、找物质、标得失、调电荷、查原子“五步法”,帮助学生从化合价角度快速找准各个电极的反应物和生成物,并且明确先调电荷守恒再检查原子守恒的解题思路。值得一提的是,该方法更加具体,可操作性强,对于原电池和电解池类型的试题普遍适用。
二、知识基础
根据原电池与电解池原理的一般模型“负阳氧,正阴还”(如图1),准确判断原电池的正极、负极和电解池的阴极、阳极。掌握两个电极上各物质的变化情况,是正确判断和书写电极反应式的基础和前提。
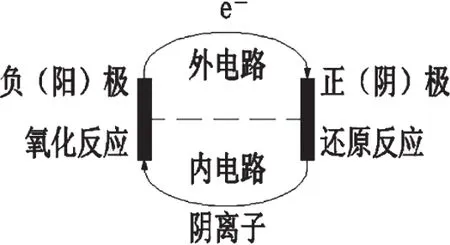
图1 原电池与电解池原理的一般模型
1.原电池
失电子的物质在负极放电,化合价升高,发生氧化反应;得电子的物质在正极放电,化合价降低,发生还原反应。电解质溶液中,阳离子一般移向正极,阴离子移向负极,原电池依靠电子和离子的定向移动形成闭合回路。
2.电解池
与外加电源负极相连的一极为阴极,电解池工作时溶液中得电子能力强的离子在阴极得到电子,化合价降低,发生还原反应;与外加电源正极相连的一极为阳极,电解池工作时活性电极(除Au、Pt外的金属)自身或溶液中失电子能力强的离子在阳极失去电子,化合价升高,发生氧化反应。而在电解质溶液中,阴离子移向阳极,阳离子移向阴极,整个电解池通过电子和离子的定向移动形成闭合回路。
3.二次电池
放电时相当于原电池,充电时相当于电解池,放电过程和充电过程互为逆过程。如大家熟悉的铅蓄电池,Pb电极放电时的电极反应式为Pb-2e-+SO42-=PbSO4,该电极失去电子,为原电池的负极;充电时只有PbSO4+2e-=Pb+SO42-才能使该电极恢复至放电前的状态,此时,该电极得到电子,为电解池的阴极。对于PbO2电极,原电池的正极反应式和电解池的阳极反应式也存在这样的互逆关系。因此,根据原电池负极与电解池阴极、原电池正极与电解池阳极的电极反应式互逆关系,可以快速解答某些试题。
三、“五步法”解题示例
1.五步法
标价态:根据题意找出变价元素并标明其化合价。
找物质:根据正极、负极、阴极、阳极的反应特点,找出各个电极上的反应物和产物。
标得失:根据每一个电极反应物和产物中变价元素的化合价,标明得到或者失去几个电子。
调电荷:根据题目所给的电解质环境选择用H+或者OH-来调整电极反应式左右两边的电荷情况,保证电荷种类相同,数目相等。
查原子:电极反应式两边所有元素的原子总数要分别相等。
其中,调电荷是学生普遍存在的难点问题。如果电解质是酸性溶液,溶液中存在大量的H+,此时电极反应式中不能出现OH-,调电荷必须要用H+,反之碱性溶液中必须要用OH-。
2.典例赏析
例1.【2019年全国卷Ⅲ,理综第13题改编】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)
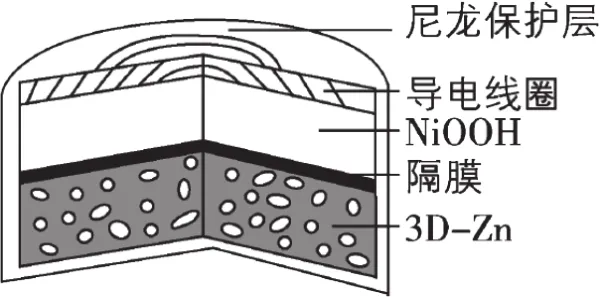
则:(1)放电时负极反应为____________________;
(2)充电时阳极反应为___________________________。
【解析】该题干给出了电池放电过程和充电过程的总反应Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。
(1)放电时:Zn(s)+2NiOOH(s)+H2O(l)=ZnO(s)+2Ni(OH)2(s),负极失去电子,化合价升高。
①标价态:Zn元素由0价变为+2价;②找物质:Zn→ZnO;③标得失:Zn-2e-→ZnO;④调电荷:由于该电池为碱性环境,应该选用OH-而不是H+来调整电荷情况。式子左边失去2个电子而带2个单位正电荷,右边不带电,故右边应加上2个OH-,即Zn-2e-+2OH-→ZnO;⑤查原子:式子两边H、O原子不守恒,右边应该加一个H2O,即Zn-2e-+2OH-=ZnO+H2O。因此,放电时的负极反应式应该为Zn-2e-+2OH-=ZnO+H2O。
(2)充电时:ZnO(s)+2Ni(OH)2(s)=Zn(s)+2NiOOH(s)+H2O(l),阳极失去电子,化合价升高。
①标价态:Ni元素由+2价变为+3价;②找物质:Ni(OH)2→NiOOH;③标得失:Ni(OH)2-e-→NiOOH;④调电荷:由于该电池为碱性环境,同样应该选用OH-来调整电荷情况。式子左边失去1个电子而带1个单位正电荷,右边不带电,故左边应加上1个OH-,即Ni(OH)2-e-+OH-→NiOOH;⑤查原子:式子两边H、O原子不守恒,右边应该加一个H2O,即Ni(OH)2-e-+OH-=NiOOH+H2O。因此,充电时的阳极反应式应该为Ni(OH)2-e-+OH-=NiOOH+H2O。
例2.(2019年天津卷,理综化学第6题改编)我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
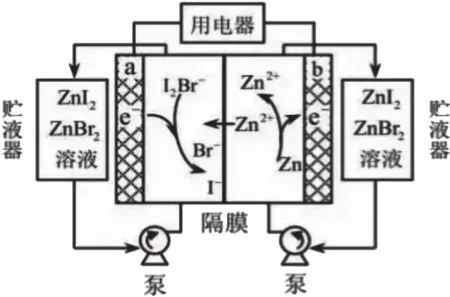
则:(1)放电时,a电极的反应式为__________;
(2)充电时,b电极每增重0.65g,溶液中有_________mol·I-被氧化。
【解析】这道题对于学生来讲情境比较陌生,通过提取有效信息进行原电池或电解池、正负极或阴阳极的判断,是解答本题的第一步。
由图可知,该装置连接了一个用电器,应为原电池。a电极附近,I2Br-+e-→I-+Br-,得到电子,a电极应该为正极;b电极附近,Zn-2e-→Zn2+,失去电子,b电极应该为负极。
(1)a电极
放电时,I2Br-+e-→I-+Br-
①标价态:根据电负性规律,Br的电负性强于I,I2Br-中I元素应该为0价,故I元素由0价变为-1价;②找物质:I2Br-→I-+Br-;③标得失:I2Br-+2e-→ 2I-+Br-。观察可知式子左右两边已经遵循了电荷守恒和原子守恒,④调电荷和⑤查原子这两个环节可以略去。即放电时a电极的反应式为:I2Br-+2e-=2I-+Br-。
(2)这道题目中,只要正确书写充电时a、b两个电极的反应式,b电极的增重与溶液中被氧化的I-之间的定量关系就很清晰了。
根据(1)中a电极放电时的反应式:I2Br-+2e-=2I-+Br-,再结合充电时阳极和放电时正极电极反应式的互逆关系,a电极充电时的反应式应为2I-+Br--2e-=I2Br-。同理,b电极放电时Zn-2e-=Zn2+,充电时应为Zn2++2e-=Zn。因此,b电极每增重0.65g,电路中转移的电量为0.02mol,相应a电极就有0.02mol·I-被氧化。
四、结束语
在解决电化学问题时,只要理顺了各个电极上物质间的转化情况,题目所设置的问题往往就能迎刃而解。依据“负阳氧,正阴还”的电化学原理模型,通过标价态、找物质、标得失、调电荷、查原子“五步法”很好地解决了书写电极反应式这一关键问题,非常有利于学生对电化学知识的整体理解和把握。
