复发性阿弗他口腔炎组织中基因异常表达分析
2021-04-16穆艳超陈新
穆艳超,陈新
(安阳市妇幼保健院 a.检验科;b.口腔科,河南 安阳 455000)
复发性阿弗他口腔炎(recurrent aphthous stomatitis,RAS)是常见的口腔黏膜疾病,具有周期复发的特点。RAS多发于舌、腭、唇、颊等处,主要表现为圆形、椭圆形、孤立的浅表性溃疡,可出现显著的灼烧感,饮食和说话可致疼痛加剧,不适感可影响患者饮食、言语,降低患者生活幸福感[1]。该病是国内外研究的热点,但因其发病机制尚不明确,治疗手段主要以抑制炎症加重、缓解疼痛、促进溃烂愈合、延长疾病发作间歇期为目的,尚缺乏有效的治疗手段[2]。研究显示,有超过1/3的RAS患者具有显著的遗传易患性,人类白细胞抗原A2表型与RAS发生具有显著相关性,血凝素基因缺陷患者的RAS发病率高达56%,叶酸代谢通路基因表达异常的人群RAS患病率显著高于正常人群,细胞因子基因高表达的人群中RAS的发病率高于低表达人群[3-5]。本研究通过生物信息学分析筛选候选基因,并验证JAK2、STAT3、IL-6、SOCS3、CXCR4在RAS组织中异常表达情况。
1 资料与方法
1.1 一般资料选取2019年9月至2020年10月安阳市妇幼保健院口腔科收治的25例RAS患者,取其病灶组织作为观察组。纳入标准:(1)病史1 a以上,1 a发作2次以上;(2)无其他口腔疾病,就诊前3 d内未服用抗生素、止痛药、免疫抑制剂等药物;(3)年龄15~35岁。选取同期25例拔牙者智齿附着组织为对照组。对照组:男12例,女13例;年龄21~35岁,平均(26.9±2.0)岁。观察组:男12例,女13例;年龄16~35岁,平均(25.7±2.3)岁。两组性别、年龄比较,差异无统计学意义(P>0.05)。本研究经安阳市妇幼保健院医学伦理委员会批准。纳入研究者均签署知情同意书。
1.2 高通量测序数据的处理高通量测序数据从National Center for Biotechnology Information(NCBI)Gene Expression Omnibus(GEO)数据库(http://www.ncbi.nlm.nih.gov/geo/)获取,测序系列号为GSE37265。该数据集中共包含14例RAS患者,分别采集患者的溃疡组织、正常组织,提取总RNA,按照Affymetrix标准操作规程对RNA进行片段化、端部修复、连接和聚合酶链式反应(polymerase chain reaction,PCR)扩增建库,使用Affymetrix Human Genome U133 Plus 2.0 Array对文库进行测序。
1.3 差异表达基因(differentially expressed genes,DEGs)的筛选建立筛选条件:-log10P>-log100.05;|log2Fold Change|>1。log2Fold Change>1为高表达基因,log2Fold Change<-1为低表达基因。
1.4 基因富集的分析利用DAVID在线软件分析DEGs富集情况。DAVID被用于信号通路Kyoto Encyclopedia of Genes and Genomes(KEGG)的分析。通过DAVID软件计算各富集组的P值。
1.5 实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)取对照组和观察组新鲜组织20 mg放入无RNA酶的离心管中,加入4 ℃预冷生理盐水5 mL,以4 000 r·min-1转速离心1 min,弃上清。使用4 ℃预冷磷酸盐缓冲液洗涤,以4 000 r·min-1转速离心1 min,弃上清。使用核酸提取仪提取总RNA。RNA水平经NanoDrop 2000检测,OD260/OD280大于1.90可用于后续试验。用TOYOBO试剂盒进行反转录,PCR管中加1 μL Random Primer,加3.0 μg提取的mRNA,用RNase Free H2O补齐至20 μL,反转录产物于-80 ℃保存。使用Roche combas z480进行荧光定量PCR,扩增引物由上海生工公司合成。反应体积为25 μL,ACTB为内参基因,每个基因做3个复孔,反应程序:95 ℃ 10 min,95℃ 15 s,64 ℃ 15 s,72 ℃ 30 s,40个循环;37 ℃ 1 min。使用2-ΔΔCt法进行扩增数据分析。
2 结果
2.1 高通量测序数据中不同组织的DEGs对原始数据进行归一化处理,并对对照组和观察组的基因表达进行t检验分析,共计1 645个DEGs满足筛选条件(-log10P>-log100.05且|log2Fold Change|>1),其中高表达1 082个,低表达563个。见图1。

图1 符合筛选条件的基因倍数与P值负对数分布图
2.2 DEGs功能分布情况使用DAVID软件分析DEGs富集最多的5个信号通路为细胞因子-细胞因子受体相互作用通路、PI3K-Akt信号通路、趋化因子信号通路、癌症通路、单纯疱疹病毒感染通路。见表1。

表1 GSE37265中DEGs富集的信号通路情况
2.3 候选基因的筛选情况DEGs导入STRING数据库进行分析。在蛋白间相互作用(protein-protein interaction,PPI)关系网中,39个基因编码PPI置信度大于0.995,见表2。39个基因被筛选为候选基因,用于进一步验证。

表2 GSE37265 DEGs编码蛋白PPI分析
2.4 qPCR验证候选基因结果经验证,观察组JAK2mRNA相对表达量低于对照组,STAT3mRNA、IL-6mRNA、SOCS3mRNA、CXCR4mRNA相对表达量均高于对照组(P<0.05)。见表3。
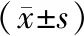
表3 qPCR验证候选基因mRNA表达情况
3 讨论
RAS的发病机制尚未完全明确。研究表明,RAS发病与免疫、遗传和环境等多种因素有关[6]。维生素B12、叶酸、锌缺乏以及吸烟、精神压力、激素和月经周期变化等都可诱发RAS[7]。其发病无显著季节性,具有自限性、复发性和周期性等特点,炎症病灶的溃疡面积不大,病灶中心位置可见表面覆盖假膜的凹陷[8]。
以往研究表明,RAS患者外周血中细胞免疫指标CD4、CD4/8、CD16+56水平低于对照组,血清免疫指标IgM、CH50、IL-6水平高于对照组,提示RAS患者疾病期细胞免疫功能降低,体液免疫功能发生紊乱[9]。本研究报道JAK2、STAT3、IL-6、SOCS3、CXCR4等多个基因在病灶组织中表达异常,这与以往其他类型炎症性疾病中发现的DEGs一致[10]。本研究报道的异常表达基因可参与细胞因子-细胞因子受体相互作用通路、PI3K-Akt信号通路、趋化因子信号等多个信号转导通路,与机体免疫功能的调控密切相关。RAS表现为复发性炎症性溃烂,参与炎症过程的细胞因子表达异常或信号通路调节紊乱都不利于RAS的控制。以往研究发现,JAK2和STAT3广泛表达于多种细胞与组织中,是JAK/STAT信号通路中的关键调控因子,与多种疾病发生发展密切相关[11]。本研究证实JAK2mRNA、STAT3mRNA相对表达量与对照组有显著差异,JAK2和STAT3编码蛋白表达量变化及其磷酸化程度将对RAS炎症过程产生重要影响,根据JAK2和STAT3编码蛋白活化情况调控其表达,纠正信号通路转导状态将有利于RAS的控制。SOCS3可通过占据受体磷酸化酪氨酸位点,竞争性阻断STAT3对受体的招募;SOCS3可与JAK家族蛋白结合,特异性抑制JAK激酶活性,且SOCS3及其蛋白家族其他成员可介导JAK家族蛋白泛素化降解,从而抑制JAK2/STAT3信号通路转导,导致细胞与组织正常免疫稳态被打破,产生一系列炎症相关疾病[12]。IL-6是由白细胞产生的细胞因子,在免疫细胞中成熟活化,通过血液运输至靶细胞发挥调节作用。CXCR4参与JAK2和STAT3磷酸化过程。药物调节IL-6/JAK2/STAT3信号通路有助于缓解炎症,促进受损黏膜的修复,减轻组织中炎症细胞浸润[13]。研究表明,黄芪建中汤具有抑制溃疡的作用,可能通过激活JAK2/STAT3通路,调节免疫屏障功能[14]。针对该病的分子靶点药物尚未开发应用,检测病灶组织中的分子指标或血清标志物有助于判断疾病预后。目前,对于RAS的治疗仍以抑制炎症进展、缓解疼痛、降低复发率、延长疾病发作间歇期为目的。基础医学的进步将有助于RAS的治疗和精准防控,进一步阐明RAS疾病进展的机制是精准治疗的前提。炎症性疾病涉及的信号通路复杂,涉及的分子较多,从发病机制入手纠正RAS病程中分子网络状态将有助于实现根治目标。以往研究提示,纠正细胞或者组织分子网络应综合评估采取措施的安全性[15],深入挖掘对于RAS进展影响大的致病因子是未来研究的方向。
检测RAS相关基因有望为解释疾病发生发展机制提供数据支撑。本研究由于样本量较小并且未建立动物模型,基因表达差异的调控机制尚未得到深入解释,更大样本量和动物模型的建立将有助于基因转录调控机制的研究。
