基于真空冷冻干燥的响应面优化超声提取青杨梅中抗氧化物质及活性分析
2021-04-15石峰李思敏高定烽丁岗芯崔恩浩熊华斌高云涛杨志
石峰,李思敏,高定烽,丁岗芯,崔恩浩,熊华斌,高云涛,杨志
(云南民族大学 化学与环境学院,昆明 650500)
云南野生青杨梅(MyricaadenophoraHance)为杨梅属植物,分布于广东、广西和云南等地,生命力强,生长于酸性土壤中,pH值在5.5~6最为适宜。青杨梅是一种富含葡萄糖、柠檬酸、苹果酸、果糖等营养物质的植物,具有很高的营养价值,还含有多种维生素和花色苷等抗氧化物质[1]。随着人民生活水平的日益提高,人们在营养膳食方面更加注重绿色和健康。米雪等[2]通过对柿子果皮中类胡萝卜素的研究发现,超声提取的类胡萝卜素含量高、抗氧化作用效果好。戴喜末等[3]对野艾蒿多糖的提取发现,超声提取的野艾蒿多糖提取率达6.44%,对DPPH·的清除能力强。但是,鲜见采用真空冷冻干燥辅助超声提取云南野生青杨梅抗氧化物质的报道。本实验以云南野生青杨梅为实验研究对象,通过真空冷冻干燥处理后,以单因素实验分析结果为基础,利用响应面法优化最佳超声提取工艺,并对青杨梅提取物对DPPH·的清除效果进行抗氧化活性分析,为进一步开发、利用野生植物资源青杨梅提供了技术和理论参考。
1 材料与方法
1.1 材料与试剂
本文用材云南野生青杨梅采于云南省曲靖市,且实验所研究的果实均采摘自同一株野生青杨梅树。
色谱纯乙醇、分析纯乙醇、DPPH标准品:美国Sigma公司;实验室用水为超纯水。
1.2 仪器与设备
SJIA-2012超声波细胞破碎机 杰瑞安仪器设备有限公司;JM-L140胶体磨 上海贝工泵业制造有限公司;8453型紫外可见分光光度计、7890B-5977B气相色谱-质谱联用仪 Agilent Technologies Inc.;FA2004电子分析天平 上海上平仪器公司;水浴锅 力辰科技有限公司;真空冷冻干燥机 宁波双嘉仪器有限公司;离心机 湖南可成仪器设备有限公司。
1.3 实验方法
1.3.1 真空冷冻干燥提取云南野生青杨梅中抗氧化物质的工艺流程
青杨梅→去核→胶体磨研细→冻干12 h→青杨梅粉→水浴浸提2 h→超声破碎→离心→提取液。
1.3.2 原料预处理
真空冷冻干燥技术是一种将样品冷冻至凝固点以下,再通过程序设定温度升温,使样品中的水分直接升华,再通过抽真空后使水分离开原有体系的干燥方法[4]。 样品在真空烘干、烘干、热风干燥和冻干4种技术下进行干燥,结果显示在冻干技术中样品的总酚、总黄酮和总花色苷等活性物质的含量显著高于其他3种干燥技术[5]。其中,冻干条件下样品的维生素C含量远远高于热风干燥的含量[6],所以本实验采用真空冷冻干燥技术,在最佳的干燥技术下保证青杨梅中的抗氧化物质成分以最大程度保存,工艺参数见表1。

表1 青杨梅的真空冷冻干燥工艺参数Table 1 The vacuum freeze-drying process parameters of Myrica adenophora Hance
1.3.3 云南野生青杨梅提取物最大吸收峰的测定
准确称取(0.2±0.01) g杨梅粉于200 mL烧杯中,以固液比1∶25 (g/mL)加入乙醇,置于50 ℃恒温水浴2 h后,在4000 r/min的转速下离心10 min,取上清液备测。取1 mL上清液于比色管中加入乙醇定容至50 mL,在190~800 nm波长范围内进行光谱扫描,得上清液最大吸收波长,平行测定3组。
1.3.4 最佳固液比的确定及其提取液对DPPH·的清除效果
准确称取6份(0.2±0.01) g杨梅粉于6个200 mL烧杯中,分别加入5,10,15,20,25,30 mL乙醇,与1.3.3相同的水浴和离心条件进行实验,取0.5 mL上清液于比色管中,再加入已配制的DPPH·(A=0.7±0.1)溶液10 mL,摇匀静置30 s后,于517 nm处测定吸光度,并计算提取液对DPPH·的清除率,平行测定3组。
1.3.5 最佳提取温度的确定及其提取液对DPPH·的清除效果
准确称取6份(0.2±0.01) g 杨梅粉于6个200 mL烧杯中,以固液比1∶25 (g/mL)加入乙醇,分别于40,45,50,55,60 ℃恒温水浴2 h,与1.3.3相同的离心条件进行实验,与1.3.4相同的测定条件测定待测液的吸光度,平行测定3组。
1.3.6 最佳乙醇浓度的确定及其提取液对DPPH·的清除效果
分别配制体积分数为0%、20%、40%、60%、80%和95%的乙醇溶液,准确称取6份(0.2±0.01) g 杨梅粉于6个烧杯中,分别加入已配制好的乙醇溶液,与1.3.3相同的水浴和离心条件进行实验,与1.3.4相同的测定条件测定待测液的吸光度,平行测定3组。
1.3.7 最佳超声功率的确定及其提取液对DPPH·的清除效果
准确称取6份(0.2±0.01) g 杨梅粉于6个200 mL烧杯中,以固液比1∶25 (g/mL)加入乙醇,然后于50 ℃恒温水浴2 h,设定超声时间为30 min,再分别以150,300,450,600,750,900 W的功率超声提取,与1.3.3相同的离心条件进行实验,与1.3.4相同的测定条件测定待测液的吸光度,平行测定3组。
1.3.8 最佳超声时间的确定及其提取液对DPPH·的清除效果
准确称取6份(0.2±0.01) g杨梅粉于6个200 mL烧杯中,以固液比1∶25 (g/mL)加入乙醇,然后于50 ℃恒温水浴2 h,设定超声功率为600 W,再分别以10,20,30,40,50,60 min的时间超声提取,与1.3.3相同的离心条件进行实验,与1.3.4相同的测定条件测定待测液的吸光度,平行测定3组。
2 结果与分析
2.1 云南野生青杨梅提取物的最大吸收波长
由图1的UV-Vis吸收光谱扫描结果可知,云南野生青杨梅提取物溶液的光谱扫描在190~800 nm之间没有吸收峰,DPPH·表现出在328 nm与517 nm波长处有两个特征吸收峰,而云南野生青杨梅提取物溶液在205 nm波长处出现最大吸收峰。所以,本实验选定205 nm为云南野生青杨梅提取物的最大吸收波长。
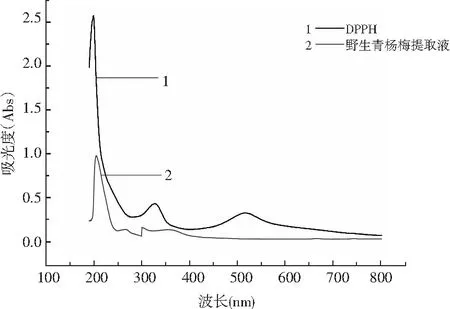
图1 野生青杨梅提取物的最大吸收峰Fig.1 The maximum absorption peak of wild Myrica adenophora Hance extracts
2.2 不同固液比对DPPH·的清除效果
由图2可知,在固液比为1∶25~1∶125 (g/mL)时,固液比的减小对DPPH·的清除率表现出下降的趋势,在固液比为1∶25 (g/mL)时对DPPH·的清除率最大,当固液比成倍数减小时,清除率随固液比的减小而减小,这是由于随着固液比的逐渐减小,杨梅提取液中抗氧化成分也逐渐被稀释,所以对DPPH·的清除率下降;还可能是固液比的增大导致杨梅中其他物质溶出,使得抗氧化物质溶出较少[7]。由于青杨梅为粉末状,且为疏松多孔状,当固液比小于1∶25 (g/mL)时,难以使样品与提取剂充分混合,所以本实验的最佳固液比为1∶25 (g/mL)。

图2 不同固液比对DPPH·的清除率Fig.2 The scavenging rates of different solid-liquid ratios on DPPH free radicals
2.3 不同提取温度对DPPH·的清除效果
由图3可知,当温度在40~50 ℃区间时,提取液对DPPH·的清除率随着温度的升高而逐渐升高;但50 ℃之后,温度在50~60 ℃区间时,提取液对DPPH·的清除率随着温度的升高而逐渐减小。如对茶多糖提取及其抗氧化活性的研究表明,由于在升温条件下,茶多糖结构受到破坏,影响了多糖的提取率[8]。在高温下抗氧化物质容易被破坏和分解,所以本实验的最佳提取温度为50 ℃。

图3 不同提取温度对DPPH·的清除率Fig.3 The scavenging rates of different extraction temperatures on DPPH free radicals
2.4 不同乙醇浓度对DPPH·的清除效果
由图4可知,乙醇浓度(体积浓度)在0%~60%区间时,提取液对DPPH·的清除率随着乙醇浓度的增大而逐渐升高,但乙醇浓度在60%~95%区间时,提取液对DPPH·的清除率随乙醇浓度的升高而逐渐降低,这是由于青杨梅中抗氧化物质既有水溶性也有醇溶性,当达到最佳乙醇浓度时,提取的抗氧化物质也最多,随着乙醇占比在最佳浓度的基础上升高或降低,提取液对DPPH·的清除率都会降低,所以本实验采取体积浓度为60%的乙醇溶液。

图4 不同乙醇浓度对DPPH·的清除率Fig.4 The scavenging rates of different ethanol concentration on DPPH free radicals
2.5 不同超声功率对DPPH·的清除效果
由图5可知,在超声功率区间为150~600 W时,提取液对DPPH·的清除率随着超声功率的升高而升高,直至功率达到600 W时,提取液对DPPH·的清除率达到最大值,随后随着功率的升高提取液对DPPH·的清除率大幅下降。这是由于超声功率过大,超声探头温度过高,引起抗氧化物质降解[9]。当超声功率为600 W时,青杨梅细胞壁已完全破裂,杨梅中的抗氧化物质已基本溶出,再增加超声功率,无法再增加抗氧化物质的含量,反而破坏已溶出的抗氧化物质[10]。所以,本实验选用最佳超声功率为600 W。

图5 不同超声功率对DPPH·的清除率Fig.5 The scavenging rates of different ultrasonic power on DPPH free radicals
2.6 不同超声时间对DPPH·的清除效果
由图6可知,在超声时间为10~30 min时,提取液对DPPH·的清除率随着超声时间的延长而增大,直至超声时间为30 min时,提取液对DPPH·的清除率达到最大值。随后随着超声时间的延长,提取液对DPPH·的清除率逐渐下降,这是由于超声时间过长破坏了抗氧化物质。还存在超声空化作用的增强,导致在提取液中的抗氧化物质被超声降解,所以本实验选用最佳超声时间为30 min。
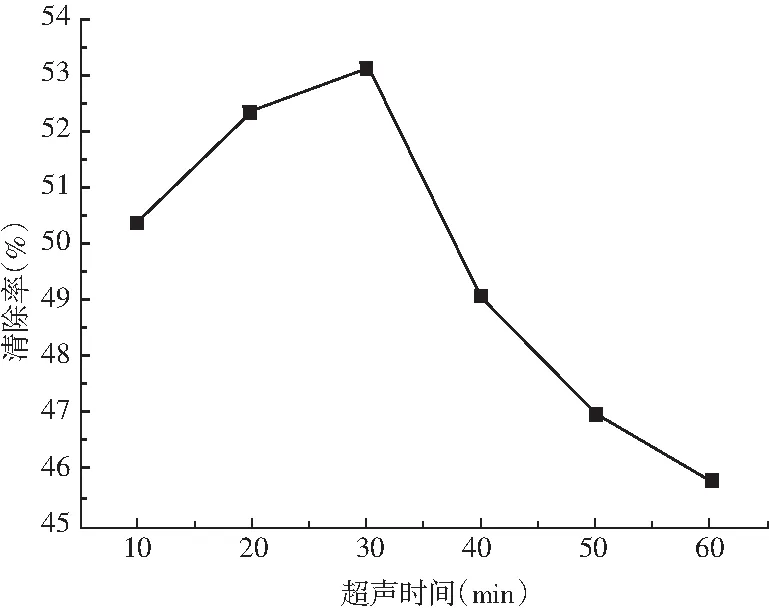
图6 不同超声时间对DPPH·的清除率Fig.6 The scavenging rates of different ultrasound time on DPPH free radicals
2.7 CCD设计及其实验结果
根据单因素实验分析可知,提取温度、超声功率和超声时间对DPPH·清除的影响较为显著,所以本实验以提取温度、超声功率和超声时间3个因素作为响应因素A,B,C,以青杨梅提取物对DPPH·的清除率作为响应值R,设置3个水平,见表2,从中选出最优工艺[11]。

表2 响应面实验的因素和水平值Table 2 The factors and levels of response surface test

表3 CCD实验设计及实验结果Table 3 CCD experimental design and results
2.8 回归和方差分析
以青杨梅提取物对DPPH·的清除率为响应值,并由表3可得出清除率和各响应因素间的回归方程:
R清除率=+51.97-0.21A-0.19B+0.19C+0.35AB+7.500E-003AC-0.23BC-0.83A2-0.54B2-0.66C2。
该方程相关系数 R2=0.9689,相关性良好。该方程的方差分析结果见表4。
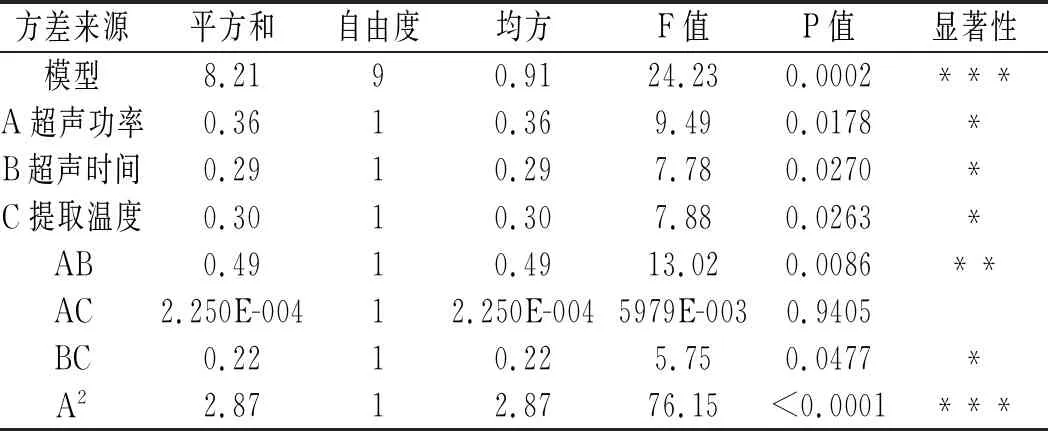
表4 云南野生青杨梅提取物对DPPH·清除率的影响回归方差分析结果Table 4 The regression variance analysis results of effects of Yunnan wild Myrica adenophora Hance extracts on the scavenging rates of DPPH free radicals

续 表
通过分析软件Expert 8.1.6建立模型,当P<0.001时,表明具有极显著性,P>0.1表明无显著性,该模型的整体P值为0.0002,<0.001,具有极显著性,可得出该实验所建立的模型可用于青杨梅抗氧化成分提取的响应面分析。此外,A、B、C、AB、BC、A2、B2和C2项的P值都小于0.05,表现出显著性,表明超声功率、超声时间和提取温度均为青杨梅抗氧化成分提取物对DPPH·清除率影响的主要因素,其中,A2、B2和C2项的P<0.001,说明超声功率、超声时间和提取温度对DPPH·清除率的影响表现出极为显著;AB项的P<0.01,表明超声功率与超声时间的交互作用要强于超声功率与提取温度、超声时间与提取温度的交互作用;A、B、C、BC的P<0.05,表明超声功率、超声时间和提取温度对DPPH·清除率的影响显著,而AC的P值明显大于0.05,说明超声功率和提取温度对DPPH·清除率的影响没有交互作用。
2.9 响应面分析
A(超声功率)、B(超声时间)和C(提取温度)3个因素对DPPH·清除的3D响应面图(a1、b1、c1)和等高线图(a2、b2、c2)见图7。

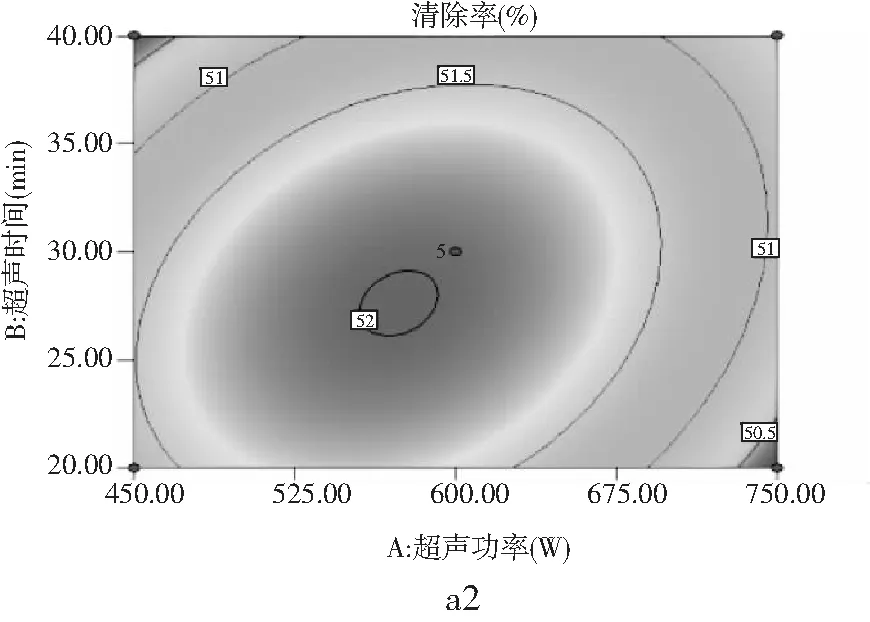

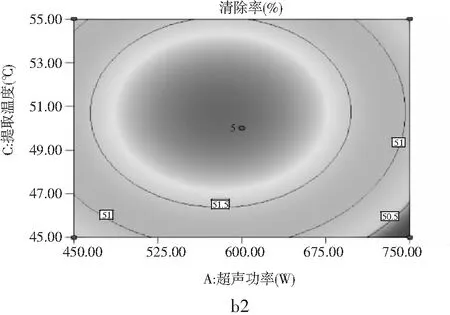
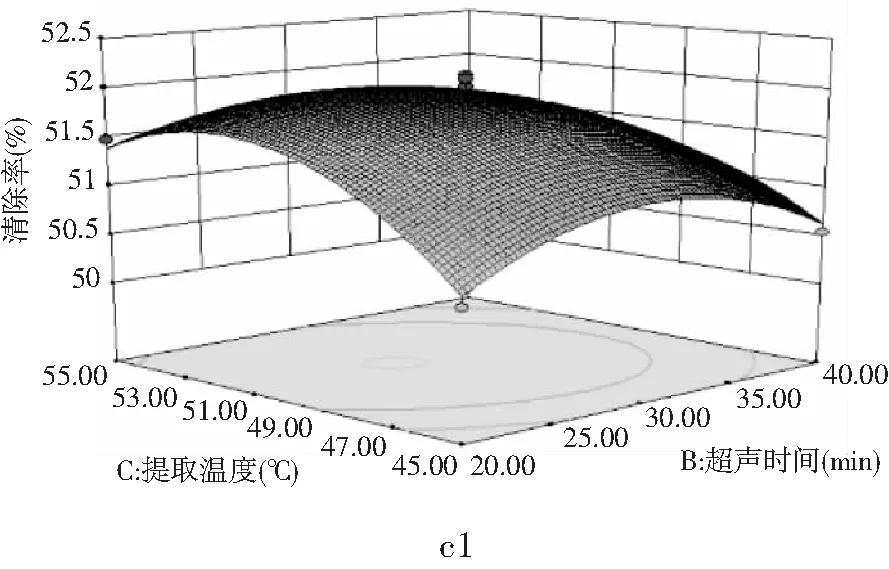
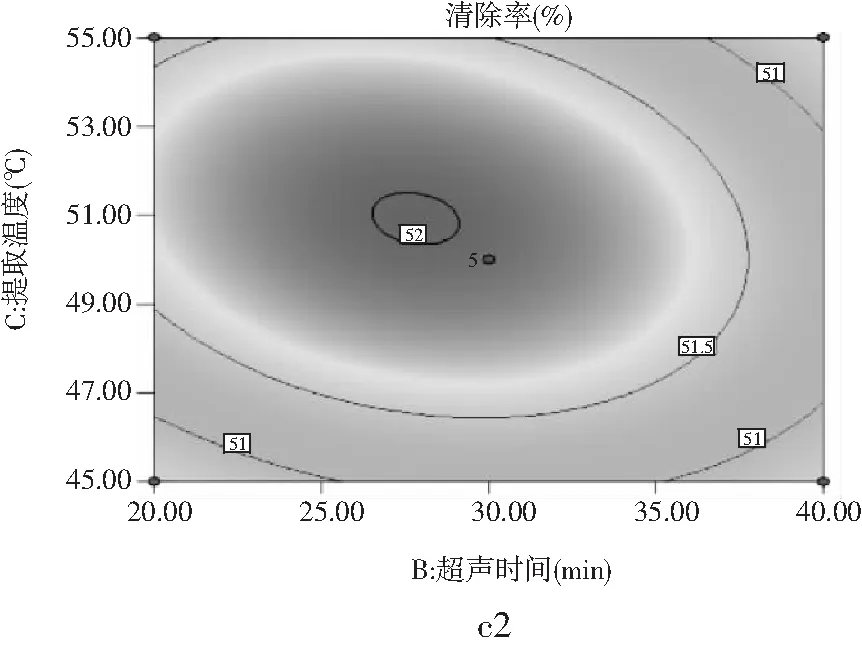
图7 各因素及其交互作用的响应面图Fig.7 The response surface diagrams of various factors and their interactions
由图7中a1和a2可以看出A因素和B因素对DPPH·清除率的影响趋势近似,沿B方向响应面的曲线较陡、切峰值较高,沿A方向响应面的曲线较平缓、切峰值较低,说明超声时间对DPPH·清除率的影响大于超声功率对DPPH·清除率的影响。由图7中a2也可以看出沿B方向的等高线密度要高于沿A方向的等高线密度,由此可得出超声时间对DPPH·清除率的影响大于超声功率的影响。
由图7中b1可以看出A因素和C因素对DPPH·清除率的影响,沿C方向响应面的曲线较陡、切峰值较高,沿A方向响应面的曲线较平缓、切峰值较低,说明提取温度对DPPH·清除率的影响大于超声功率。由图7中a2也可以看出沿C方向的等高线密度要高于沿A方向的等高线密度,由此可得出提取温度对DPPH·清除率的影响大于超声功率的影响。
由图7中c1可以看出B因素和C因素对DPPH·清除率的影响,沿C方向响应面的曲线较陡、切峰值较高,沿B方向响应面的曲线较平缓、切峰值较低,说明提取温度对DPPH·清除率的影响大于超声时间。由图7中c2也可以看出沿C方向的等高线密度要高于沿B方向的等高线密度,由此可得出提取温度对DPPH·清除率的影响大于超声时间的影响。通过响应面分析,可直观反映出各因素对DPPH·清除率的影响情况,其分析效果比单因素实验更具有说服力,通过响应面综合分析可以得出,3个因素对DPPH·清除率的影响程度不同,其程度大小为提取温度>超声时间>超声功率。
此外,通过模型分析优化,预测的最优条件是超声功率573.29 W、超声时间27.63 min、提取温度50 ℃,预测的最优清除率为52.02%。通过实验测得的清除率为52.14%,与预测值相差仅0.12%,说明该方案是可行的[12]。通过超声技术和对单因素参数的优化,云南野生青杨梅提取物对DPPH·的清除率得到了有效的优化,这与核桃青皮萘醌类[13]和辣椒油树脂[14]研究的结果相一致。
2.10 云南野生青杨梅的GC-MS分析
本实验对杨梅提取液及其与DPPH·的混合液进行气质分析,结果见表5和表6。

表5 云南野生青杨梅溶液成分分析Table 5 The analysis of components in Yunnan wild Myrica adenophora Hance solution

表6 加入云南野生青杨梅后的DPPH·成分分析Table 6 The analysis of components in DPPH free radicals after adding Yunnan wild Myrica adenophora Hance
由图8和表5可知,云南野生青杨梅提取物中可分离出10种物质;由图9和表6可知,提取液与DPPH·的混合溶液中能分离出7种物质。经对照分析可看出,青杨梅提取液与DPPH·的混合溶液中相对青杨梅提取液有5种物质的峰消失,分别为2-蒎烯、2-环己烯-1-酮、4H-Pyran-4-one,2,3-dihydro-3,5-dihydroxy-6-methyl-、5-羟甲基糠醛和β-D-阿洛糖,这5种物质对DPPH·均具有清除作用;同时也伴随着新物质N-乙酰-DL-丙氨酸和4-苄基吡啶两种物质峰的产生。

图8 青杨梅气相色谱图Fig.8 Gas chromatogram of Myrica adenophora Hance

图9 加入青杨梅后的DPPH·气相色谱图Fig.9 DPPH free radical gas chromatogram of Myrica adenophora Hance
3 结论
云南野生青杨梅抗氧化物质提取的最优条件是固液比为1∶25 (g/mL),乙醇体积分数为60%,超声功率为573.29 W,超声时间为27.63 min,提取温度为50 ℃。
响应面优化的最优DPPH·清除率为52.02%,通过实验测得的清除率为52.14%,与预测值相差仅0.12%,证明真空冷冻干燥下的响应面法优化超声提取云南野生青杨梅中抗氧化物质工艺是可行的。
云南野生青杨梅中含有较高的抗氧化活性成分,可为进一步开发、利用野生植物资源青杨梅提供技术和理论参考。
