重症中暑早期大鼠认知功能及脑能量代谢核磁共振氢谱研究
2021-04-15何国鑫马志全潘升华徐安聪陈尔徐啸天虞希冲
何国鑫,马志全,潘升华,徐安聪,陈尔,徐啸天,虞希冲
1温州医科大学附属第三医院重症医学科,浙江温州 325200;2温州医科大学附属第三医院病理科,浙江温州 325200;3温州医科大学药学院,浙江温州 325200
重症中暑(heat stroke,HS)是指暴露于高热环境或强体力劳动条件下,机体中心体温升高超过40 ℃,并出现以中枢神经系统功能障碍为特征的一系列临床表现,如谵妄、惊厥甚至昏迷等症状的一种重症疾病。未能早期干预及治疗的HS可快速进展为多器官衰竭,病死率高达30%~50%[1],在救治成功的患者中,仍有20%~30%的幸存者遗留永久性的中枢神经功能障碍[2-3]。遭遇严重热打击时,机体体温会急剧升高,可在短时间内提高细胞的化学反应速率,导致颅脑缺血缺氧及中枢神经系统代谢紊乱,代谢产物的积聚也会进一步加重细胞的损 伤[4-5]。尽早防止热打击对中枢神经系统的损害对于HS的急救及预后有重要的意义。
核磁共振技术是最早应用于代谢组学的分析方法之一,在生命科学领域拥有重要地位及明显的优势,目前仍然是代谢组学研究的有力工具[6-7]。有学者应用核磁共振波谱技术研究发现,HS患者的小脑存在明显代谢异常,并可通过小脑的代谢物N-乙酰天门冬氨酸/肌酸(NAA/Cr)比值判断病情的轻重[8],但热打击后脑代谢模式的变化及其与脑损伤的关系目前尚不清楚。本研究利用基于核磁共振氢谱(1H-NMR-based metabonomics,1H NMR)的代谢组学方法观察HS早期大鼠脑代谢模式的变化,并结合行为学实验,初步探讨HS脑损伤后行为异常的代谢组学相关机制,以期进一步了解热打击脑损伤的病理机制,为HS脑损伤的早期诊断及治疗提供依据。
1 材料与方法
1.1 仪器、试剂及实验动物 Agilent DD2 600 MHz核磁共振谱仪(美国Agilent公司)。重水(D2O,99.9%)及氘代氯仿(CDCl3,99.8%)购于英国剑桥同位素实验室。磷酸盐(K2HPO4/NaH2PO4)、甲醇、氯仿购于上海国药集团化学试剂有限公司。核磁共振管(直径5 mm)购于美国Wilmad-LabGlass公司。健康成年雄性清洁级SD大鼠25只,体重(254±18) g,购于温州医科大学医学实验动物中心,合格证编号:X1104549。分笼饲养,室温(22±1) ℃,12 h/12 h昼夜周期,自由进食及饮水。所有大鼠适应性饲养1周后进行实验,所有操作程序严格遵守美国国立卫生研究院(NIH)关于小鼠的实验动物饲养及使用手册。QHX-150型智能人工气候箱(上海比朗仪器有限公司)由温州医科大学公共卫生学院提供。
1.2 方法
1.2.1 HS模型的建立 将25只SD大鼠随机分为对照组(11只)及HS组(14只),实验前4 h停止饮水进食。将HS组大鼠置于智能人工气候箱,设定温度(40.5±0.5) ℃,相对湿度60%±3%,每隔30 min测其直肠温度(Tc)。当Tc达41 ℃时,每隔10 min测其Tc;参照本课题组前期HS动物造模方案,以大鼠Tc达42 ℃作为造模成功的标志[9],造模成功后立即将大鼠移至温度(25.0±0.5) ℃、相对湿度35%±5%的环境下复温3 h。对照组置于温度(25.0±0.5) ℃、相对湿度35%±5%的环境中,禁水禁食。
1.2.2 大鼠神经功能缺损评定 分别于造模前、造模后复温0 h、造模后复温3 h采用改良神经功能评分(modified neurological severity scores,mNSS)对HS组大鼠进行神经功能缺损评定[9]。
1.2.3 Morris水迷宫检测 实验分为定位航行实验与空间探索实验。水迷宫装置由一圆柱形水池及一个可移动位置的站台组成(温州医科大学药学院提供)。对照组大鼠训练期结果为基线数据,实验当天不予热打击处理,直接行Morris水迷宫实验,实验当天结果为处理后数据。HS组实验当天于造模成功并复温3 h后行Morris水迷宫测试,所得结果为处理后数据。(1)定位航行实验:在建立HS模型前训练4 d,4次/d,每次训练间隔2 h。每次分别随机从东、西、南、北4个入水点将大鼠头朝池壁放入水池中。设定潜伏期时间为120 s,若大鼠在120 s内找到站台,让其在站台上停留30 s,若大鼠未找到站台,将其引导至站台上,使其停留30 s,摄像头追踪大鼠至其到达站台或耗时120 s终止记录。HS模型建立且复温后再进行定位航行实验,记录大鼠寻找平台的潜伏期及航行距离。(2)空间探索实验:在最后一次定位航行实验结束24 h后,撤去平台,任选1个入水点将大鼠放入水中,所有大鼠为同一入水点,自由游泳120 s,每只大鼠进行1次,记录大鼠120 s内跨越原平台的次数及在目标象限停留所占时间比例。
1.2.4 大鼠脑组织样本的收集与处理 复温3 h后,将两组大鼠处死后快速分离出脑组织,迅速放入液氮中急冻,置于-80 ℃保存。取对照组8只、HS组11只大鼠脑组织冷冻样本,按常规方法制备脑组织提取液,供1H NMR检测用。取对照组及HS组剩余各3只大鼠的脑组织,按常规方法制备冷冻切片,供HE染色用。
1.2.5 HE染色观察大鼠脑组织病理变化 按常规方法制备大鼠脑组织冷冻切片,进行HE染色,将所有切片进行随机编码后由病理医师在光镜下观察并比较两组大鼠的脑组织病理学改变。
1.2.6 脑组织提取物的1H NMR检测及数据处理 按常规方法制备大鼠脑组织提取液,于600 MHz核磁共振(NMR)波谱仪上进行NMR采集实验,1H共振频率是599.83 MHz,采用水峰抑制的Noesygppr1d序列,弛豫延迟2.0 s,采集时间1.3 6 s,谱宽12 000 Hz,温度25 ℃,累加次数64次,采样点数32 k。使用MestReNova软件(v9.0.1)对采集的所有1H NMR谱图的FID信号加上增宽因子为1 Hz的指数窗函数后进行傅立叶变换,然后进行手动校正相位及基线,采用以TSP的单峰定标(δ0.00)。将核磁共振谱图进行分段积分(0.002 ppm/段),将积分后的数据进行归一化处理,将数据导入SIMCA软件(V14.1)进行正交偏最小二乘法-判别分析(orthogonal projections to latent structures-discriminant analysis,OPLS-DA),该空间中每一个点代表一个样本,图中椭圆区域代表95%置信区间。对OPLS-DA模型各代谢物相应的相关系数进行分析,对有统计学意义的代谢物进一步归纳。在相关系数图中,将每一个变量的loading值与其标准偏差相乘后进行数据的回溯转换,基于P=0.05为有统计学意义的临界值,自由度为9,再与相应的相关系数临界值表进行比对,最终筛选出引起组间差异的代谢物[10]。
1.3 统计学处理 采用SPSS 19.0软件进行统计分析。正态分布的计量资料以±s表示,Morris水迷宫定位航行实验数据应用重复测量资料的方差分析,其余数据采用单因素方差分析(ANOVA),进一步两两比较采用重复测量数据多重比较配对t检验LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 两组大鼠脑组织病理学变化 对照组大鼠脑细胞结构正常,细胞质、细胞核清晰,神经细胞的细胞状态、组织间隙均未见明显异常;相较于对照组,经热打击复温3 h后的HS组大鼠脑组织病理切片可见神经细胞坏死、凋亡,细胞核固缩,染色较深,并见细胞外间质疏松(图1)。
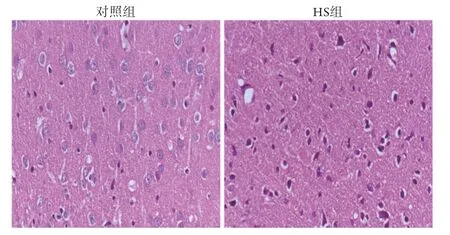
图1 两组大鼠脑组织病理改变(HE ×400)Fig.1 Pathological changes of rats' brain tissue in each group (HE ×400)
2.2 HS组大鼠造模前后的mNSS评分比较 造模前,H S 组大鼠的m N S S 评分为0 分,无神经功能损伤表现;造模后复温0 h的mNSS评分为(11.79±0.89)分,造模后复温3 h的mNSS评分为(9.29±0.83)分,均明显高于造模前(P<0.05),而造模后复温3 h与造模后复温0 h的mNSS评分比较差异无统计学意义(P>0.05)。
2.3 两组大鼠Mo r r i s 水迷宫实验结果比较 定位航行实验结果显示,对照组寻找平台潜伏期的时间基线为(34.86±1.96) s,处理后为(33.14±1.51) s;HS组寻找平台潜伏期的时间在造模前的基线值为(33.93±1.27) s,造模处理后为(53.14±2.14) s,长于造模前基线值及对照组处理后,差异有统计学意义(P<0.05)。对照组寻找平台航行距离的基线值为(377.07±15.39) cm,处理后为(360.79±13.50) cm;HS组寻找平台航行距离在造模前的基线值为(374.71±11.67) cm,造模处理后为(693.29±28.63) cm,长于造模前基线值及对照组处理后,差异有统计学意义(P<0.05)。空间探索实验结果显示,对照组大鼠在目标区域穿越次数的基线值为(5.79±0.80)次,处理后为(6.36±0.84)次;HS组目标区域穿越次数在造模前的基线值为(6.29±0.83)次,造模处理后为(2.64±0.75)次,低于造模前基线值及对照组处理后,差异有统计学意义(P<0.05)。对照组在目标象限航行时间百分比的基线值为(58.42%±1.57%),处理后为(65.78%±1.06%);HS组目标象限航行时间百分比在造模前的基线值为(59.34%±1.73%),造模后为(35.81%±1.14%),低于造模前基线值及对照组处理后,差异有统计学意义(P<0.05,图2)。
2.4 HS大鼠中枢神经系统的代谢组学分析
2.4.1 大鼠脑组织提取物的1H NMR波谱 对照组及HS组大鼠脑组织提取液的典型1H NMR谱(δ0.5~4.5)如图3所示。归属的代谢物包括异亮氨酸(Ile,δ0.94,δ1.01),乳酸(Lac,δ1.33,δ4.11),丙氨酸(Ala,δ1.48),醋酸(Ace,δ1.92),谷氨酸(Glu,δ2.35,δ2.12,δ2.07),琥珀酸(Suc,δ2.42),谷氨酰胺(Gln,δ2.45),天冬氨酸(Asp,δ2.67,δ2.81,δ3.95),胆碱(Cho,δ3.2),肌醇(m-I,δ3.26,δ3.62,δ4.07),甘氨酸(Gly,δ3.56),还原型谷胱甘肽(GSH,δ2.56,δ2.95),丙酮酸(Py,δ2.38)。

图2 两组大鼠Morris水迷宫实验结果Fig.2 Morris water maze tests results of two groups of rats
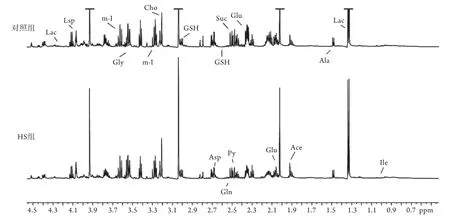
图3 两组大鼠脑组织提取物典型1H NMR波谱Fig.3 Typical 1H NMR spectrum of rats' brain tissue extracts of control group and HS group
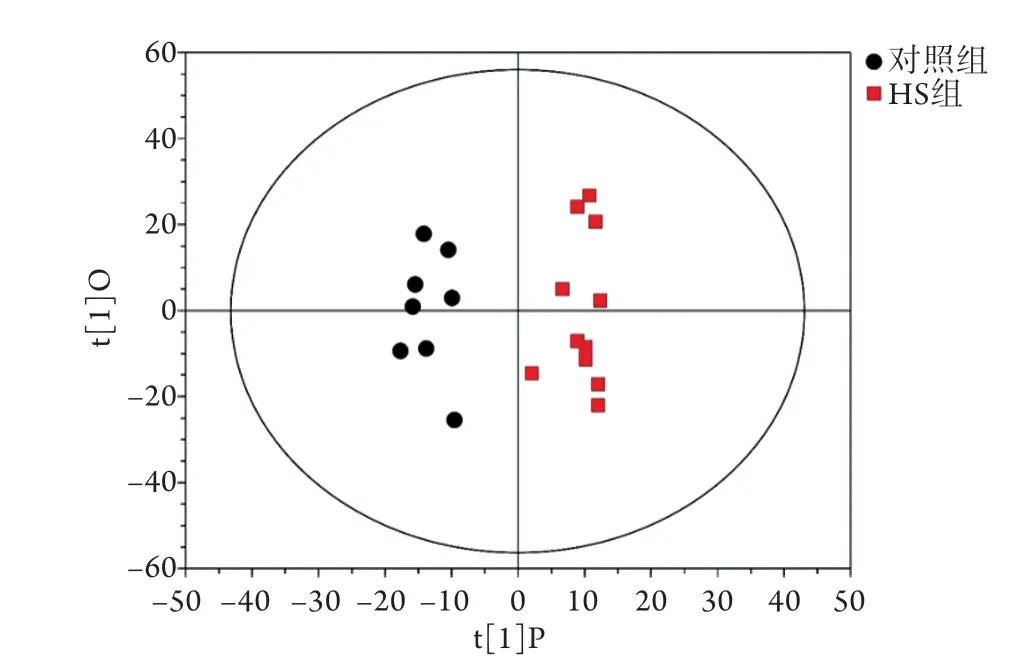
图4 两组大鼠脑组织提取物1H NMR数据OPLS-DA得分散点分布Fig.4 Score scatter plot of OPLS-DA model in 1H NMR of rats' brain tissue extracts of control group and HS group
2.4.2 两组大鼠脑组织样本提取物1H NMR数据的OPLS-DA分析 由OPLS-DA得分散点图(图4)可见,对照组与HS组的差异沿t[1]轴已达到最大化,两组大鼠脑组织代谢轮廓存在明显差异。横坐标t[1]P表示第一主成分的预测主成分得分,纵坐标t[1]O表示正交主成分得分;两组样本区分显著,样本均处于99%置信区间内。图中一个点代表两组某一个时间点的代谢轮廓。结合脑组织样本荷载图结果发现,HS早期大鼠中枢神经系统的代谢模式发生明显改变,与对照组相比,HS组大鼠脑内谷氨酸、谷氨酰胺、乳酸、琥珀酸等的含量升高(P<0.05),而天冬氨酸、甘氨酸、谷胱甘肽、丙酮酸等的含量下降(P<0.05,图5)。
3 讨 论
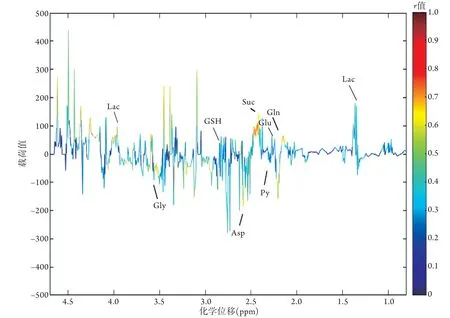
图5 两组大鼠脑组织提取物1H NMR数据OPLS-DA载荷特点Fig.5 Load diagram of OPLS-DA model in 1H NMR of rats' brain tissue extracts of control group and HS group
脑是HS早期最易受损的靶器官,磁共振检查发现HS脑损伤患者的靶部位多位于海马、小脑及丘脑[10]。研究显示,随着HS程度加重,脑组织会逐渐出现水肿、神经元变性、坏死等[11]。本研究结果显示,HS可在短时间内对中枢神经系统造成损伤,早期即可出现神经元坏死或凋亡,更加明确了热打击对中枢神经系统的损伤。
HS患者在发病早期主要表现为精神异常及认知功能障碍,若不尽早予以干预,随即发生记忆减退、意识模糊直至谵妄、惊厥、四肢抽搐,甚至昏迷、死亡[12]。针对HS的有效治疗干预应在发病几个小时内完成,因此,阐明热打击相关的早期脑损伤分子机制更具现实意义及临床应用价值。
目前研究显示,热打击致中枢神经系统损伤的机制主要包括高热直接损伤、脑缺血缺氧性改变、全身炎症反应、自由基损伤、内皮素增加及多种神经递质改变等,其中,脑缺血缺氧后出现的脑组织代谢紊乱被认为是热打击影响脑功能的首要因 素[13-14]。基于NMR的代谢组学技术可以实现无创、无偏向性的检测,具有良好的客观性及可重复性,在疾病的发病机制、早期诊断及治疗研究方面具有重要作用[6-7]。
有研究报道,热打击可诱导大鼠脑中的神经炎症,造成谷氨酸含量异常[15]。本研究应用基于1H NMR的代谢组学方法发现,相对于对照组,HS组大鼠脑中谷氨酸及谷氨酰胺含量均明显升高,而抑制性神经递质甘氨酸明显下调,进一步证实了热打击可导致中枢神经系统中氨基酸类神经递质出现代谢紊乱。谷氨酸作为哺乳动物体内分布最广、最主要的兴奋性神经递质,参与机体的多种细胞活动及生理功能[16]。神经元释放的谷氨酸被星形胶质细胞摄取并转化为谷氨酰胺,谷氨酰胺又被转运回神经元合成谷氨酸,谷氨酸-谷氨酰胺循环是体内生成谷氨酸的主要途径[17]。谷氨酸异常增多可过度激活谷氨酸受体,引起神经细胞损伤级联反应,造成神经元的凋亡[18]。甘氨酸是神经系统中一种重要的抑制性神经递质,是脑组织中重要的自我保护调节剂,对脑神经元起到保护作用,可以抑制兴奋性中毒及氧化应激,防止神经细胞受损[19]。
离子型谷氨酸受体(N-methy l-D-aspar tate receptor,NMDA)广泛存在于大脑神经元表面,在海马CA1区表达最为密集,与学习记忆活动及认知功能紧密相关[20]。NMDA-ERK-CREB信号通路是学习记忆相关通路中的重要环节,该通路发生异常与多种伴有认知功能障碍的神经精神疾病相关,如阿尔茨海默病、精神分裂症、抑郁症、脑卒中后脑损伤等。生理情况下,谷氨酸可与NMDA结合,引起Ca2+内流,结合到钙调蛋白(calmodulin,CaM)后,通过Ras-Raf-MEK途径调节下游ERK-CREB通路的活性,调控长时程增强(long-term potentiation,LTP)与神经元突触的可塑性,参与学习、记忆及认知功能形成过程[21-22]。而过度激活海马与皮质神经元的NMDA可导致兴奋性氨基酸毒性损伤,从而影响学习记忆相关信号通路,造成认知功能受损[20]。本研究从组织病理学方面发现,与对照组相比,HS组大鼠的神经细胞发生明显的坏死、凋亡;通过mNSS评分分析、Morris水迷宫实验可以发现,在HS早期,大鼠的运动、平衡、肌张力等基本神经功能以及空间记忆、方位定向能力等认知功能就已经受损,提示在HS早期脑损伤中,氨基酸类神经递质的代谢紊乱发挥了一定作用。
高热刺激会使组织细胞的蛋白酶变性失活,细胞膜及其内部结构产生严重损伤,导致细胞膜的通透性发生改变,干扰有氧代谢途径[23]。本研究发现,热打击可导致脑组织中乳酸异常升高,而乳酸在脑内是由能量底物葡萄糖通过无氧酵解方式代谢产生的,说明热打击过程中有氧代谢途径被抑制,而无氧酵解途径增强。热打击结束后,经3 h的复温后,三羧酸循环的中间产物琥珀酸含量增多,天冬氨酸、丙酮酸含量下降,提示三羧酸循环及有氧代谢途径均增强。大鼠经热打击出舱后,直肠温度在1~2 h会迅速降低,表现为特有的低体温状态,然后进入恢复期[24]。HS早期,脑组织中能量代谢模式从无氧酵解向有氧代谢的转变可能与热刺激的解除及大鼠进入恢复期、脑功能缓慢平稳恢复有关,致使复温3 h后的mNSS评分较造模后0 h有下降 趋势。
谷胱甘肽是体内重要的自由基清除剂及抗氧化剂,还原型谷胱甘肽可促进体内自由基的清除,增强机体抗氧化能力[25]。本研究发现热打击可致大鼠脑组织还原型谷胱甘肽含量下降,可能与热打击所致的脑组织氧化损伤引起的还原型谷胱甘肽过度消耗相关[26]。氧化应激过程中产生的大量氧自由基可引起细胞坏死、凋亡[27-28],从而导致中枢神经系统功能障碍。
综上所述,本研究应用组织病理学分析、动物行为学分析及基于1H NMR的代谢组学分析方法研究了HS早期大鼠脑损伤及其相关代谢的变化,结果显示在HS早期大鼠即出现了神经功能损害及认知功能障碍,其机制可能涉及氨基酸类神经递质代谢紊乱、能量代谢模式的改变及氧化应激过程。但本研究以观察性研究为主,且缺乏脑组织定位信息,尚需要对局部脑区进行独立、动态的代谢组学分析。本研究从代谢水平初步探讨了HS脑损伤的相关机制,为深入认识HS脑损伤提供了新思路。
