鼻内镜下个体化手术治疗鼻咽癌放疗后颅底坏死9例报告
2021-04-15梁九思王小路孙悍军
梁九思,王小路,孙悍军
解放军总医院第三医学中心耳鼻喉头颈外科,北京 100089
鼻咽癌是耳鼻喉头颈外科常见的恶性肿瘤,治疗以放、化疗为主,并辅以其他治疗方式,如免疫、靶向治疗等。但鼻咽癌放疗后会引起一系列并发症如分泌性中耳炎、慢性鼻-鼻窦炎、内分泌功能低下、颅底骨坏死等,其中放射性骨坏死是鼻咽癌放疗后最为严重的并发症之一,其主要临床表现为口腔、鼻恶臭,剧烈头痛,张口困难等,坏死骨质与组织可侵蚀颈内动脉导致大出血。及时行个体化诊断及治疗,不仅可减轻患者的临床症状,减少并发症的发生,而且能提高患者的生活质量及生存率。本文探讨鼻内镜下鼻咽癌放疗后颅底坏死及坏死灶的个体化处理,取得较好效果。
1 资料与方法
1.1 研究对象 收集解放军总医院第三医学中心2017年12月-2019年8月收治的9例鼻咽癌放疗后发生颅底坏死并行鼻内镜下个体化手术治疗患者的临床资料。排除鼻咽癌放疗后复发者,且经内镜检查、影像学检查、专科查体等相关辅助检查后,明确诊断为“鼻咽癌放疗后颅底坏死”。
1.2 方法
1.2.1 术前检查 全部患者均在术前行耳鼻喉专科检查,包括电子纤维鼻镜、喉镜、头颅增强MRI,头颅CT血管造影(computed tomography angiography,CTA)、甲状腺颈部淋巴结彩超。对于术前影像学检查提示颅底坏死邻近颈内动脉或已经侵蚀颈内动脉者,术前行颈内动脉血管造影,患侧行球囊闭塞实验,评估双侧颈内动脉情况及健侧颈内动脉的代偿情况。本组共有3例患者术前行颈内动脉血管造影及球囊闭塞实验,均为阴性(-),无明显交通侧支循环闭塞。
1.2.2 手术方法 患者取仰卧位,碘伏10 ml加0.9%氯化钠注射液20 ml加3支肾上腺素注射液浸润棉片消毒双侧鼻腔黏膜3遍,探查鼻咽颅底坏死的主要部位,使用电钻初步磨除蝶骨嘴骨质,磨除蝶骨前壁、底部,并根据坏死骨范围,逐步向上、下、左、右磨除坏死骨。根据病情磨除包括斜坡、颅颈交界区、寰枢椎前间隙等处的坏死骨,充分清除鼻咽部的坏死病变。如果咽隐窝或咽旁间隙有巨大坏死腔,常采用翼突入路,开放上颌窦及上颌窦后壁骨质,暴露翼腭窝及颞下窝内变性组织结构,予以清理。以骨动力系统磨除翼突根部,暴露咽鼓管软骨部及咽隐窝内结构,彻底清除咽隐窝及颅底坏死组织。当术野受限时,可行唇龈沟入路,在上颌窦前壁开窗2.0 cm×2.0 cm,方便暴露术野及手术操作。当张口困难时,可行颞下颌关节切除术,在耳轮脚前1.5 cm处行约3 cm纵行切口,切除部分颞下颌关节。如果病变可疑侵犯颈内动脉或邻近颈内动脉或患者张口困难,麻醉插管困难,须行气管切开术。止血彻底后鼻腔放置1~3条碘伏纱条,防止过度通气导致鼻腔产生大量干痂。
1.2.3 术后处理 术后观察患者生命体征并给予常规抗炎、止血、补液等对症处理,于术后第3天开始向鼻腔内注射碘伏与0.9%氯化钠注射液混合液,密切监测有无术区出血,并于术后第1天、第3天、第7天复查血常规、生化全项,观察患者电解质平衡情况。
1.2.4 随访观察 所有病例均在术后第7天拆除碘伏纱条,并指导患者及家属出院后加强鼻腔冲洗。术后1个月复查鼻内镜及影像学检查,评价术区愈合情况及坏死骨质清除范围,观察是否出现脑脊液鼻漏、脑膜炎等症状。评估术前症状是否缓解或消失,此后3个月定期复查电子纤维喉镜、鼻镜、血液检查,每4个月至半年行影像学复查,判断是否有迟发性脑脊液鼻漏、逆行性脑膜炎、脑膜脑膨出等并发症发生。
2 结 果
2.1 一般情况 入选病例中男6例,女3例,年龄31~63岁,中位年龄54岁,初诊鼻咽癌病例类型:非角化型未分化癌2例、高分化型鳞癌4例、低分化型鳞癌3例。所有患者均有鼻咽癌放疗病史,照射剂量在50~70 Gy,发病时间为7个月至8年。9例均有鼻咽部组织坏死、颅底骨质坏死,其中表现为放疗后张口困难5例,剧烈头痛8例,面部麻木2例,面瘫、抬头困难和鼻腔反复出血各1例,4例有外耳道或鼓室内脓性分泌物,伴有听力下降,未发现其他明显后遗症。鼻内镜检查见鼻咽部和(或)鼻腔大量痂皮或坏死脓臭性分泌物8例,有散在点状出血糜烂点;见寰、枢椎前间隙脓臭性分泌物1例。耳内镜检查见鼓室外耳道脓性分泌物4例,呈鼓膜紧张部置管后表现1例。患者术前影像学检查见坏死部分累及不同区域,包括斜坡,蝶骨、岩尖,寰、枢椎前间隙和枕骨。
2.2 手术及随访情况 全部手术均采用鼻内镜下经鼻中线入路,行翼突入路2例,颞下颌关节切除术2例,唇龈沟入路1例,气管切开术5例。截至2019年8月,9例随访患者的病理结果均为呼吸道黏膜慢性炎伴少许坏死,无鼻咽癌复发。共随访4~23个月,中位随访时间12个月,其中随访1年以上患者5例。9例患者均未发生颅内感染、气颅、脑脊液鼻漏、脑膜脑膨出、脑疝等并发症。
2.3 典型病例
病例1,男,31岁,因“鼻咽癌放疗后9个月”入院。病理类型:非角化型未分化癌(左侧鼻咽黏膜下肿物),癌组织侵犯骨质。查体:左侧面部红肿,张口困难,约半横指。左侧咽隐窝可见大量坏死物。术前行头颅CTA、头增强MRI、DSA等相关检查,局麻下行气管切开术,全麻鼻内镜下行颅底坏死灶清除术。全面苏醒后突发鼻腔出血,给予压迫止血等对症处理。术后第2天再次发生鼻腔、口腔出血,紧急行DSA,诊断为“颈内动脉C2段假性动脉瘤”,并置入Willis覆膜支架。术后28 d出院。随访6个月,面部对称,口、鼻腔无异味,无头痛(图1)。
病例2,女,56岁,因“鼻咽癌放疗后9个月,剧烈头痛3个月余”入院。病理类型:非角化型低分化癌(右侧鼻咽隐窝)。查体:张口困难,约一横指,鼻咽部呈放疗后改变,见大量干痂,右侧咽隐窝可见坏死物,颈强直,不能屈曲及后仰。术前完善头颅CTA、头部MRI等相关术前检查,局麻下行气管切开术,全麻鼻内镜下行鼻咽部坏死灶清除术,寰、枢椎前间隙坏死物切除术及右侧颞下颌关节切除术。术后随访4个月,患者张口约两横指,颈部可屈曲及后仰,颈部活动略受限,无头痛,偶有清涕流出(图1)。
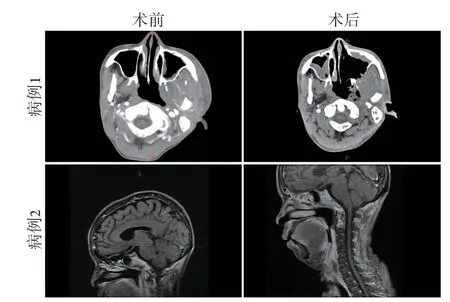
图1 典型鼻咽癌放疗后颅底坏死病例术前与术后对比Fig. 1 Comparison of skull bottom necrosis before and after operation
3 讨 论
随着诊疗技术的不断提高,鼻咽癌的5年生存率已由最初的15%提高至59%~76.1%[1]。放疗后形成低氧-低血供-低细胞成分的组织,待组织分解后形成经久不愈的伤口,并向骨质侵袭,导致放射性骨坏死[2]。放射性骨坏死最早出现在放疗结束后6个月,约7年达到发病高峰,最长可达25年[3]。当鼻咽癌放疗后出现颅底坏死时,在鼻内镜下可见鼻咽部大量的痂皮、伴有恶臭的脓性分泌物及裸露的坏死骨质,将坏死组织清理后可见坏死骨质。一旦颅底坏死,病情将出现不可逆的发展,所以应早发现、早就诊、早处理。
鼻咽癌放疗后颅底坏死的治疗方式有两种,即非手术治疗和手术治疗。非手术治疗包括高压氧舱、抗感染及鼻腔冲洗等对症治疗。黄晓明等[4]采用高压氧舱、鼻腔冲洗等方式治疗鼻咽癌放疗后大面积颅底坏死患者6例,死亡4例,其中3例死于颈内动脉破裂鼻咽部大出血。非手术治疗可缓解症状,但不能彻底清除坏死病灶,因此,鼻咽癌放疗后颅底坏死的首选治疗方式为手术清除坏死病灶[5]。 兰桂萍等[6]通过治疗15例鼻咽癌放疗后颅底骨坏死病例发现,手术治疗后患者临床表现缓解甚至消失,预后及生活质量同时得到改善,但当颅底坏死组织与颈内动脉相毗邻或坏死组织已侵蚀颈内动脉时,颈内动脉损伤的概率增高,因此,设计个体化治疗方案尤为重要。本研究认为,应通过头颅CTA及头部MRI在术前明确坏死灶的位置,充分掌握颈内动脉与颅底坏死灶之间的关系,结合术中鼻内镜视野下的解剖结构及解剖标志物,达到术前预判、术中对应的诊疗思路。鼻内镜手术视线方向(视野中的上、下、左、右方向)是不变的,但视线方向与空间结构的前后位置存在差异,因此,术前应明确CT影像层面解剖结构前后位置的排列顺序; 术中经鼻内镜确定视野内视线方向所见的解剖标志出现的先后顺序[7],通过两者的结合应用,明确颅底坏死灶位置。另外,术前制定个体化的手术方案,有利于模拟术中情况,从而做到术中最大范围地清除颅底坏死组织及坏死骨质,并保证术区引流通畅。
鼻咽癌患者经放射性治疗后会出现颈部血管损伤及狭窄,而这种损伤又以颈总动脉及颈内动脉最为明显[8]。受损后狭窄的颈内动脉血管壁易于向外膨出,形成假性动脉瘤,而颈内动脉的岩骨段最易出现颈内动脉假性动脉瘤。典型病例1中,正是颈内动脉岩骨段形成假性动脉瘤破裂而导致出血。已有研究表明,鼻咽癌放疗后出血量为1400~7600 (2500.0±224.0) ml[9]。如果颅底坏死灶毗邻颈内动脉或已侵蚀颈内动脉,应尽早行双侧颈内动脉DSA检查,并预防性行气管切开,以有效降低引起窒息的可能。既往有研究报道,鼻咽癌放疗后有许多的先兆表现提示存在颅底坏死:开口门齿距<1 cm;鼻咽部恶臭;咽反射敏感度下降;频繁出现吞咽动作;血常规检查提示不同程度贫血,血红蛋白低于90 g/L[10]。
本组9例患者中,有2例存在严重的张口困难,张口半横指或一横指,只能进半流食,行颞下颌关节切除术松解颅底坏死灶侧的颞下颌关节,不完全切除全关节,术后可张口约两横指,术后1个月复查,体重均增加5~10 kg。但如果不进行有效的干预治疗,会因张口门齿距减小或牙关紧闭造成进食困难,最终导致营养不良甚至恶液质的发生。
综上所述,随着影像学及鼻内镜手术技术的发展,通过分析鼻咽癌放疗后颅底坏死患者的临床资料,制定个性化的手术方案,可确保术中更精准的定位以及坏死病灶的清除,术后患者临床症状可明显缓解,但仍须长期随访观察。
