紫外光B波段光信号调控植物生长发育的研究进展
2021-04-15任慧,黄烯
任 慧,黄 烯
(厦门大学生命科学学院,细胞应激生物学国家重点实验室,福建 厦门 361102)
太阳光是地球生命体的能量来源.植物将太阳能转化为化学能储存起来,供给动植物繁衍生息.太阳光是一种电磁波,能透过大气层照射到地表的波段主要包括可见光、红外光和紫外光(UV).由于季节更替和地势的差异,环境中的光照条件如光波组成和光照强度等在不断发生着变化.为了更好地生存,植物在长期的自然选择过程中,能够高效地利用太阳光维持自身生长发育,同时进化出复杂而精细的信号转导网络来适应光照环境的改变.光调控了植物的整个生命过程,包括种子萌发、光形态建成、避荫反应、开花等,贯穿营养生长和生殖生长阶段[1-2].研究表明不同波段的光对植物的生长发育有不同的调控作用,植物通过特异的光受体来接收不同波段的光:光敏色素(phytochrome,phy)接收红光和远红光信号(600~750 nm),隐花色素(cryptochrome,cry)、向光素(phototropin)和Zeitlupes家族蛋白接收蓝光和紫外光A波段(UV-A)光信号(315~500 nm),UVR8(UV Resistance Locus 8)蛋白接收UV-B光信号(280~315 nm)[3-6].UV是一种短波长(10~400 nm)的非可见光,大部分被臭氧层阻挡[7].随着臭氧层破坏的加剧,地表的UV强度逐渐增强[8].UV按辐射强度分为3个波段:短波段的UV-C(100~280 nm),大部分都被臭氧层过滤掉;长波段的UV-A(315~400 nm),穿透性较强且有致癌性;中波段的UV-B,波长在280~315 nm之间.植物对UV-B光的响应受到UV-B光强度、波长和照射时长的影响.一般来说,高强度、较短波长的UV-B光会诱发植物的应激反应,造成DNA损伤,加速植物衰老或造成植株死亡[9-10];低强度、较长波长的UV-B光对植物的多种发育过程有正向调控作用,如光形态建成、避荫反应、向光性、叶片的生长发育等[11].本文从UV-B光信号的接收、下游传递过程及产生的效应3个方面阐述植物如何响应UV-B光信号.
1 UV-B光信号的接收与信号转导
1.1 UV-B光受体蛋白UVR8
植物UV-B光受体首先在模式植物拟南芥(Arabidopsisthaliana)中被鉴定出来.通过遗传筛选,Kliebenstein等[12]鉴定到对UV-B辐射胁迫超敏感的突变体uvr8-1,在UV-B光照射下,uvr8-1中类黄酮含量降低,类黄酮和花青素合成关键基因的表达明显减少;由此克隆了UVR8基因,并发现其氨基酸序列与RCC1(Regulator of Chromosome Condensation 1)具有相似性,但是目前尚未发现UVR8能像RCC1一样行使鸟苷酸交换因子的功能.转录组分析揭示UVR8是一个特异性介导植物UV-B光响应的信号因子,调控包括HY5(ElongatedHypocotyl5)在内的一系列UV-B光诱导基因的表达[13].随后,Favory等[14]基于UV-B光形态建成研究体系的建立和更精细的转录组分析,进一步确认了UVR8在UV-B光信号转导中的核心地位.
2011年,Rizzini等[6]发现呈二聚体形式的UVR8蛋白在UV-B光照射下能迅速解聚成单体,并与COP1(Constitutively Photomorphogenic 1)蛋白结合.随后,结构生物学家利用UVR8的原核重组蛋白和X射线衍射技术,解析了非激活态即二聚体形式UVR8蛋白的晶体结构,揭示了UVR8作为UV-B光受体的分子基础;研究显示UVR8蛋白的三维结构形似螺旋桨,由7个桨叶构成,每个桨叶都是经典的WD40重复结构域形成的β-折叠片,螺旋桨结构表面含有带正电和带负电的部分,且正负电荷基本呈现聚集性的对称分布[15].当环境中没有UV-B光时,2个UVR8蛋白在其表面精氨酸残基的帮助下,通过电荷作用及化学键结合形成同源二聚体;当受到UV-B光照射后,作为生色团的色氨酸残基吸收UV-B光并发生偏转,打破了维持二聚体间相互作用的化学键,使得二聚体解聚成单体;该过程发生快速,实验证明只需要用UV-B光照射5 s即可检测到UVR8蛋白构象的改变,这说明UVR8蛋白能帮助植物及时地响应UV-B光信号,迅速启动发育和防御机制[6].UVR8蛋白的第286位和第338位精氨酸残基(R286和R338)对于稳定二聚体结构起到不可替代的作用,当其中之一突变为丙氨酸后,UVR8蛋白都无法形成二聚体;UVR8蛋白二聚体表面共有7个色氨酸残基,其中第233位和第285位色氨酸残基(W233和W285)是UVR8蛋白中主要负责吸收UV-B光的生色团,与精氨酸残基形成稳定的化学键来维持蛋白的结构,当其中之一突变为丙氨酸后,UVR8蛋白也无法形成稳定的二聚体结构[15-16].
二聚体转变为单体的构象变化过程是可逆的.在体外条件下,原核重组的UVR8蛋白单体在UV-B光移除后缓慢恢复成二聚体,35 h后依然能检测到大部分UVR8单体[15].而拟南芥内源的UVR8单体恢复成二聚体的速度明显快于体外重组蛋白,UV-B光移除30 min即能检测到二聚体,2 h后大部分UVR8单体都恢复成二聚体,说明拟南芥体内对于UVR8蛋白的构象变化有精细的调控,以保证当环境中UV-B光消失时,信号传递能及时终止[17].
1.2 UV-B光信号转导的起始
UV-B光照条件下,UVR8蛋白由二聚体解聚成单体后,能够直接结合光形态建成的关键调控蛋白COP1[18].实验结果显示,UV-B光照射5 s即可检测到拟南芥体内UVR8单体的存在,1 min后就能检测到它与COP1的结合[6],说明UV-B光信号的起始转导步骤迅速高效.Ouyang等[19]进一步利用数学建模手段对这一过程进行了动态重建.
在拟南芥uvr8和cop1功能缺失突变体中,大量UV-B光应答基因的表达不发生变化,花青素不积累,植物无法响应UV-B光进行光形态建成,说明UV-B光信号转导同时依赖于UVR8和COP1蛋白,两者在拟南芥应答UV-B光信号中起着不可或缺的作用[6,18].UVR8蛋白在白光及UV-B光下都有较恒定的积累[20],但其在白光下的功能尚无相关报道.白光下储备的UVR8蛋白能帮助植物在受到UV-B光照射后迅速做出反应,可以看作是植物的一种自我保护机制;而COP1基因的表达受UV-B光诱导,其蛋白在UV-B光下与可见光下相比有更高水平的积累[21].
COP1依赖于UV-B光结合单体形式而非二聚体形式的UVR8蛋白.UVR8蛋白由N端的7个WD40重复结构域和C端的27个氨基酸(C27)组成,其中WD40重复结构域与COP1蛋白的相互作用依赖于UV-B光,而C27片段与COP1的相互作用不依赖于UV-B光但依赖于第440位缬氨酸(V440)和第441位脯氨酸(P441);将C27片段转入uvr8突变体能使拟南芥幼苗在白光下就具有组成型的短下胚轴表型,说明C27片段可以代替激活的UVR8全长蛋白来调控COP1蛋白的功能,使得COP1蛋白在白光下即可促进光形态建成的发生[22-23].由此推测UVR8蛋白的C27片段在其与COP1蛋白发生相互作用的过程中起关键调控作用,而N端结构域可能调节C27片段与COP1的相互作用,使得UVR8与COP1发生依赖于UV-B光的相互作用,说明UV-B光信号的起始和传递具有可调节性[23-24].
UVR8蛋白的内源生色团(W233和W285)和稳定二聚体结构的氨基酸(R286和R338)在UV-B光信号感知和转导中都发挥重要功能.COP1和UVR8在拟南芥体内的结合也依赖于这些关键氨基酸.UVR8突变型蛋白UVR8W285F表现为组成型的二聚体状态,无法结合COP1蛋白,导致幼苗无法在UV-B光下完成正常的光形态建成;UVR8W233A蛋白虽然为组成型的单体,但是在拟南芥体内可与COP1形成较少的蛋白复合体,而组成型的UVR8R338A蛋白单体能与COP1蛋白形成大量的蛋白复合体,使幼苗光形态建成增强,说明UVR8与COP1形成蛋白复合体在UV-B光信号转导中具有阈值效应,对于UV-B光形态建成的程度起决定性作用[19-25].
在植物细胞内,UVR8在细胞质和细胞核中均有分布.UV-B光能促进UVR8在细胞核中积累,使得细胞核中仅存在UVR8蛋白单体,从而介导光形态建成;在这一过程中,E3泛素连接酶COP1蛋白帮助UVR8蛋白以单体形式在细胞核中积累,而RUP 1/2(Repressor of UV-B Photomorphogenesis 1/2)是该过程的负调控因子;UVR8和COP1在细胞核中的积累是UV-B光信号转导起始的关键步骤,然而关于COP1是携带UVR8蛋白一起入核还是将UVR8限制于细胞核中,或是需要其他蛋白的帮助,目前还不清楚[26-27].两者进入细胞核后如何将UV-B光信号传递到下游的转录因子,从而调控UV-B光应答基因的转录,也需要进一步研究.
1.3 UV-B光信号转导的关键因子
1.3.1 COP1
COP1是多功能的E3泛素连接酶,在动植物中广泛分布且功能保守[28].COP1蛋白具有3个功能结构域:N端具有泛素连接酶活性的RING finger环指结构域、负责蛋白自身互作的coiled-coil结构域以及C端负责COP1与其他蛋白结合的WD40结构域[29].在植物中,COP1蛋白通过调控蛋白的稳定性参与多种生物学过程,包括光形态建成、开花、生物钟节律和激素响应等[30].研究发现,拟南芥的COP1可以自身作为泛素连接酶,也能够在CUL4-DDB1(Cullin 4-Damaged DNA Binding Protein 1)泛素连接酶复合体中作为底物接收蛋白,介导底物通过泛素-蛋白酶体途径降解[31-32].COP1的这些功能依赖于SPA(Suppressor of phyA-105)家族中4个功能冗余的同源蛋白SPA1、SPA2、SPA3和SPA4,spa四突变体中COP1的泛素连接酶活性被抑制[33].COP1与SPAs能够形成稳定的同源或异源四聚体,SPAs的组织特异性表达决定了它们对COP1蛋白功能的调控存在一定程度的组织特异性[33-37].
COP1在远红光、红光、蓝光和UV-B光信号通路中均发挥重要功能.在黑暗中,COP1介导光形态建成的核心转录因子HY5的降解,从而抑制光形态建成[30];在光照条件下,远红光/红光受体phyA、phyB以及蓝光受体cry2的稳定性都受到COP1的抑制[38-40];而在UV-B光下,尚未有光受体UVR8的稳定性受COP1调控的报道.UVR8和COP1通过形成蛋白复合体使UV-B光信号转导起始,并以多种机制共存的方式保证转录因子HY5的蛋白积累与活性,最终促进光形态建成的发生:1)HY5基因受UV-B光的诱导表达依赖于UVR8和COP1[18];2) UVR8 结合COP1及SPAs后,竞争性地将COP1-SPAs与CUL4-DDB1解离,使得降解HY5的CUL4-DDB1-COP1-SPAs泛素连接酶复合体解聚[41];3) UVR8利用VP结构域与HY5竞争性地结合COP1[42],使得HY5蛋白逐渐积累并促进UV-B光应答基因的表达[14,41];4) UV-B光下COP1与RUP1/2蛋白结合促进其泛素化降解,抑制RUP1/2介导的HY5蛋白降解;5) RUP1和RUP2蛋白在UV-B光下的积累也抑制了COP1和HY5的相互作用[43].因此,UV-B光下COP1在转录水平和转录后水平上都对HY5起正调控作用;尤其是UV-B光信号使COP1对HY5蛋白的调控发生反转,从介导降解转变为促进稳定.
1.3.2 RUP1和RUP2
当接收到UV-B光信号时,二聚体UVR8蛋白解聚成单体并将信号向下游传递;当环境中的UV-B光消失后,UVR8蛋白又逐渐恢复成二聚体形式,抑制UV-B光信号的持续传递.该过程受到两个同源蛋白RUP1和RUP2的调控.rup1突变体的光形态建成没有明显缺陷,rup2突变体在白光及UV-B光下的光形态建成表型明显增强,而rup1rup2双突变体在UV-B光下表现出进一步增强的光形态建成表型,这些结果说明RUP1和RUP2协同抑制UV-B光下的光形态建成,其中RUP2起主导作用[44].
RUP1和RUP2蛋白在UV-B光下诱导积累,通过与UVR8蛋白的C27片段结合来抑制UVR8-COP1复合体的形成,并促进UVR8恢复成二聚体[17].RUP1和RUP2对于UVR8蛋白构象变化的调控具有功能冗余性,RUP1或RUP2基因的过表达能促进UVR8恢复成二聚体,RUP1或RUP2基因功能缺失对UVR8恢复成二聚体的速度无明显的改变,但两者同时缺失可使UVR8恢复成二聚体的速度明显减慢,由此可见RUP1和RUP2共同调控UVR8蛋白构象的动态变化,在UV-B光信号转导过程中有效抑制信号的过度放大[17,19,23,44].
新近研究发现,RUP1/2蛋白除了能够调节UVR8构象变化和UVR8复合体形成外,还可以作为CUL4-DDB1这一E3泛素连接酶的底物受体来介导HY5蛋白的泛素化降解,即通过减弱转录因子的稳定性来抑制UV-B光信号转导[43];除了抑制幼苗的光形态建成外,RUP2还能在短日照条件下抑制UVR8调控的开花途径,通过与CO(Constans)蛋白结合,抑制FT(FloweringLocusT)基因的转录,从而抑制开花[45].
2 UV-B光信号通路的调控
2.1 UV-B光信号介导的转录调控
UV-B光受体UVR8与调控蛋白COP1结合后,稳定并激活下游的bZIP(basic Zipper)转录因子HY5,诱导多个基因的表达,使得拟南芥下胚轴伸长被抑制,并促进色素积累和胁迫适应[6,41].UVR8和COP1参与了大部分UV-B光应答基因的表达调控[14].新近研究表明,在UV-B光下细胞核内UVR8特异性调控的基因中,存在大量光应答基因和激素应答基因;除了HY5外,细胞核内UVR8调控的转录组应答还受到多个已知转录因子的共同调控,如MYB 13(Myb Domain Protein 13)、PIF1(Phytochrome-interacting Factor 1)、PIF3、PIF4、PIF5、FHY3(Far-red Elongated Hypocotyl 3)、ARF6(Auxin Response Factor 6)、BZR1(Brassinazole-Resistant 1)和BES1(BRI1-EMS-Suppressor 1);UVR8和HY5共同调控的基因中大部分是受UV-B光诱导上调的光应答基因,UVR8和PIFs共同调控的基因中大部分是受UV-B光诱导下调的生长素应答基因,ARF6、BZR1和BES1也参与UVR8调控的生长素应答基因下调[46].
在各类光受体下游,HY5处于光信号转导网络的枢纽位置,是光形态建成的核心转录因子[47-49].在拟南芥基因组中,已发现的HY5结合位点有9 000多个,能调控1 000多个基因的表达,包含拟南芥中24%的光应答相关基因;HY5主要通过C端的bZIP结构域结合靶基因启动子区的G-box(CACGTG)以及GACGTG和GACGTA序列(统称为ACGT元件或ACE元件)[50-52].此外,HY5还能通过调控miRNA的形成来调控基因表达;HY5调控的这些基因涉及大分子合成、亚细胞定位、物质转运、细胞代谢等过程,参与光形态建成、叶绿体发育、根部发育、细胞防御等[50-51].因此,HY5在植物生长发育中发挥广谱的调控作用.在UV-B光下,HY5及其同源蛋白HYH(HY5-Homolog)受到诱导而得到积累,两者进而诱导包括自身在内的一系列光形态建成相关基因的表达,如UGT84A1(UDPGlucuronosyltransferase84A1)、CHS(ChalconeSynthase)、COP1、RUP1、RUP2、RBCS1A(RibuloseBisphosphateCarboxylaseSmallChain1A)、ELIP1(EarlyLightInducibleProtein1)和ELIP2[11,49,53-54].以COP1基因为例,在UV-B光下HY5与另一转录因子FHY3共同调控COP1的转录;HY5通过直接结合COP1启动子区的ACE元件激活COP1基因的表达,是对UV-B光信号转导的正反馈调节;同时,FHY3通过结合COP1基因启动子区的FBS(FHY3 binding site)元件来激活COP1基因的表达[21].
不同于对COP1基因的转录调控,HY5诱导RUP1和RUP2基因的表达是对UV-B光信号转导的负反馈调节[44].HY5自身的转录因子活性也受到其他蛋白的影响.转录因子STO/BBX24(Salt Tolerance)在UV-B光下抑制HY5蛋白的积累,与HY5和COP1结合后分别抑制这两个蛋白的活性,从而抑制UV-B光形态建成[55].这些精细的调控模式使得UV-B光信号的传输处于动态平衡之中,既有利于信号的有效传递又避免了信号的过度放大.
近年来,多项研究表明UV-B光受体UVR8通过直接调控转录因子的积累或活性参与基因表达调控.在UV-B光形态建成过程中,转录因子WRKY36(WRKY DNA-Binding Protein 36)能结合HY5基因的启动子并抑制其表达,而UVR8与WRKY36的相互作用可解除WRKY36对HY5基因表达的抑制,最终使光形态建成得以正常进行[56].UV-B光信号与油菜素内酯信号存在协同调控,促进植物的UV-B光形态建成:BES1和BIM1(BES1-Interacting Myc-like 1)是油菜素内酯信号转导通路中的重要转录因子,在UV-B光下,UVR8与BES1和BIM1蛋白的结合削弱了它们对靶基因启动子的结合能力,从而抑制下胚轴伸长[57].UV-B光信号也能通过转录因子调控生长素响应基因表达,拮抗调控避荫反应和温度反应,抑制下胚轴或侧根伸长:在UV-B光与避荫反应、温度反应的信号互作中,PIF4/5调控的部分基因在UV-B光下表达下调,且UV-B光诱导的PIF4/5蛋白发生依赖于UVR8的降解,抑制下胚轴伸长相关基因(如XTR7(XyloglucanEndotransglycosylase7)、YUC8(Yucca8)、IAA19(Indole-3-AceticAcidInducible19)和IAA29)的表达,从而抑制拟南芥下胚轴的伸长[58];在侧根发育过程中,UVR8在UV-B光的照射下结合转录因子MYB73/77,阻碍了MYB73/77对生长素响应基因启动子的结合,从而抑制植物侧根的发育[59].MYB13是近期发现的UV-B光信号转导的正调控因子.UV-B光诱导MYB13基因特异地在子叶中表达,并诱导UVR8和MYB13形成复合体,促进MYB13结合类黄酮合成相关基因如CHS、CHI(ChalconeIsomerase)和FLS(FlavonolSynthase)的启动子,从而增强拟南芥对UV-B光胁迫的适应;同时,虽然UVR8抑制MYB13对生长素响应基因SAUR(SmallAuxinUpregulatedRNA)27/28/66启动子的结合,但是MYB13受UV-B光的诱导积累能够逐渐解除这种抑制,最终促进SAUR27/28/66基因的表达来介导拟南芥子叶的延展[46].
综上,UV-B光信号介导的主要转录调控机制总结于图1.
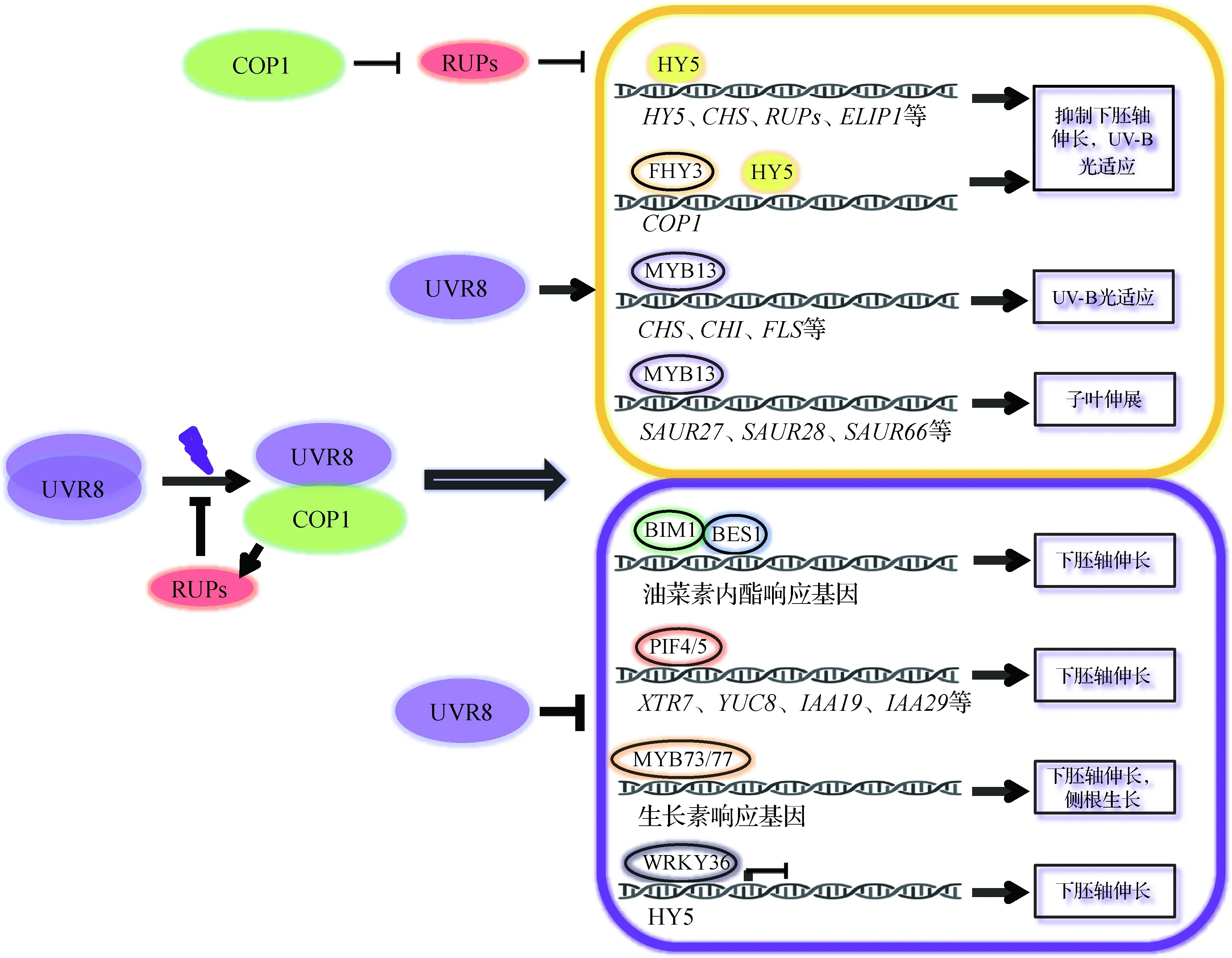
二聚体的UVR8接收到UV-B光后转变为单体并与COP1结合,使UV-B光信号转导起始;RUPs抑制UVR8单体与COP1结合并 促进HY5蛋白的降解;COP1通过促进RUPs的降解,稳定HY5.在基因表达调控方面,转录因子HY5、FHY3和MYB13是 UV-B光信号转导通路的正调控因子(黄色方框内),而BIM1、BES1、PIF4/5、MYB73/77和WRKY36是负调控因子(紫色方框内).图1 UV-B光信号介导的转录调控机制Fig.1 Transcriptional regulation mechanism mediated by UV-B light signal
2.2 UV-B光与可见光信号通路的交叉调控
通过对植物基因组和转录组的分析,Han等[60]发现植物由深海迁移到浅水区时进化出UV-B光信号通路,并在适应UV-B光后逐步进化出感受红光和远红光的phy及接收蓝光信号的cry.不同光受体调控的信号通路间形成了复杂而有序的信号转导网络.
phy主要调控种子的萌发和光形态建成等生物学过程,这种光受体的出现代表植物能够在红光比例较高的浅水区稳定生存,并开始逐渐改变植物的繁殖模式,向种子植物进化.转录因子PIFs家族蛋白是光形态建成的负调控因子,phy通过结合PIF3并抑制它与DNA的结合来促进光形态建成,黑暗下PIF3蛋白被COP1蛋白降解[61];而红光下PIF3、PIF4和PIF7蛋白一起抑制phyB的积累[62-63];在UV-B光下,UVR8通过促进PIF4和PIF5的降解抑制下胚轴的伸长,从而促进光形态建成[58],但具体的调控机制还有待研究.
cry1、cry2和UVR8都能与COP1-SPAs复合体组分结合并调控COP1蛋白的活性.cry1和cry2能抑制COP1对下游信号因子的降解从而促进开花[40,64];UVR8则通过与COP1一起稳定转录因子HY5而促进UV-B光诱导的光形态建成[25].cry1、cry2和UVR8能共同促进HY5/HYH诱导的花青素合成基因表达,当cry1、cry2和UVR8基因同时突变后,拟南芥幼苗在阳光下无法存活;在UV-B光下,cry1和cry2抑制UVR8调控的UV-B光应答基因表达,可能是由于它们会和UVR8竞争结合COP1[65].这说明接收不同波段光信号的光受体间既有协同调控作用也有拮抗调控作用.
3 不同植物对UV-B光信号的响应
植物接受UV-B光照后产生多种生理响应.高水平的UV-B辐射对植物产生胁迫,造成DNA损伤和活性氧积累,严重影响植物的正常生长发育;UVR8调控的UV-B光信号转导通路能帮助植物适应UV-B光的照射,减少UV-B辐射对植物造成的伤害[11].低水平的UV-B光照能促进拟南芥的生长发育,有助于光形态建成和黄酮类积累;UV-B光还能调控细胞核内DNA复制、叶片形态建成、侧根发育、向光性、避荫反应、气孔分化和开闭、生物钟节律、抗病抗逆、热形态建成及光合作用等过程[11,59,66].
自模式植物拟南芥中的UV-B光受体被发现以来,越来越多的研究开始关注植物对UV-B光的响应,并对多个物种的UV-B光受体进行鉴定,解析它们的UV-B光信号转导机制(表1),包括单细胞藻类莱茵衣藻中的CrUVR8[67]、苔藓植物小立碗藓的PpUVR8和地钱的MpUVR8[68]、苹果中的MdUVR8[69]、葡萄中的VviUVR1[70]、黄瓜中的CsUVR8[71]、园林植物胡杨中的PeUVR8[72]和白桦中的BpUVR8[73]、药用植物杭白菊中的CmUVR8[74].这些蛋白与拟南芥的UVR8蛋白相比,不仅具有高度的序列相似性,还呈现功能上的保守性.CrUVR8接收UV-B光信号由二聚体转变为单体并能结合拟南芥的COP1,CrUVR8转入拟南芥uvr8突变体中能回补该突变体在UV-B光下的缺陷表型[67].除了具有感知UV-B光的功能外,CrUVR8还参与莱茵衣藻的光保护过程,将光能转化为热能释放出来,避免强光损伤,为植物适应强UV-B光提供了重要保障[76].莱茵衣藻也存在COP1的同源蛋白CrCOP1,它能与CrUVR8在UV-B光下结合并诱导UV-B光应答基因的表达,可见UV-B光信号转导通路的起始机制在进化过程中十分保守[67].小立碗藓对UV-B辐射的耐受能力强于拟南芥,UV-B光可引起其400多个基因的差异性表达;小立碗藓基因组编码两个UVR8同源蛋白,PpUVR8在UV-B光下可由二聚体转变为单体并在细胞核中积累[68,91].MpUVR8基因具有两个转录本,但MpUVR8蛋白几乎不形成二聚体,单体MpUVR8不依赖于UV-B光定位在细胞核中[68].
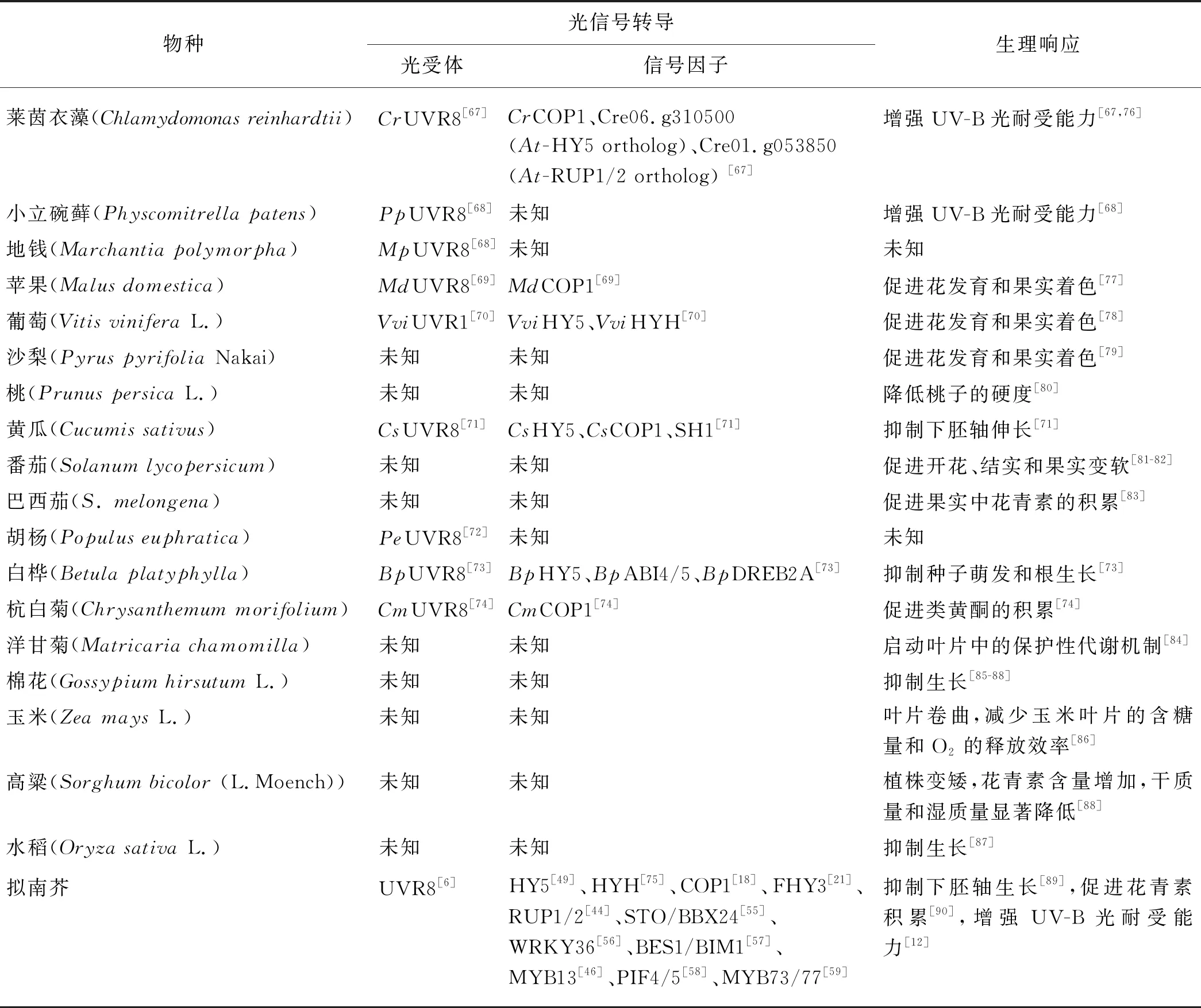
表1 部分植物对UV-B光的生理响应及其分子基础Tab.1 Physiological responses of partial plants to UV-B light and their molecular basies
如上文所述,单细胞藻类莱茵衣藻的CrUVR8能响应UV-B光由二聚体转变为单体,暗示在植物进化早期就产生了对UV-B光的感知机制[67].进化分析发现,植物早在由深海迁移到浅水区的过程中就出现了UVR8介导的UV-B光信号通路;在迁移过程中,植物接受的UV-B光强度越来越高,对UV-B光信号的响应机制可能伴随着光照条件的改变而发生[60].而光受体UVR8蛋白在不同植物的物种间十分保守[6,92],说明植物在进化过程中保留了对UV-B光的适应性.
在高等植物中,UV-B光可以促进沙梨、苹果和葡萄等开花,加深果实的颜色[77-79],为农业生产上的实际应用提供了科学依据.目前,沙梨中的UV-B光受体尚未鉴定.结构预测表明,苹果MdUVR8的三维结构与拟南芥UVR8的非常相似;UV-B光可以促进MdUVR8的表达,因此随着一天中UV-B光强度的变化,MdUVR8蛋白呈现出节律性的表达;在UV-B光下,MdUVR8也能介导拟南芥的光形态建成,且与MdCOP1存在直接相互作用[69].葡萄中除了存在UVR8的同源蛋白VviUVR1外,还存在HY5的同源蛋白VviHY5和VviHYH;它们通过调控UV-B光应答基因的表达来促进花青素的积累[70].另有研究指出,UV-B光照还能降低桃的硬度,改善桃的口感使其方便食用[80].
黄瓜UV-B光受体CsUVR8接收到UV-B 光信号后由二聚体解聚成单体,结合CsCOP1并激活转录因子CsHY5,从而促进黄瓜幼苗的光形态建成,抑制下胚轴的伸长.SH1(Short Hypocotyl 1)通过抑制HY5的积累及其和DNA结合的活性从而抑制UV-B光信号转导,而SH1自身的表达受低强度的UV-B光抑制,因此黄瓜的UV-B光信号转导机制与拟南芥具有相似性[71].UV-B光能促进番茄的开花和结实并能帮助果实变软[81-82],但番茄中的UV-B光受体尚未被鉴定,其UV-B光信号转导机制仍有待研究.UV-B光能促进巴西茄果实中花青素的积累,使果实的颜色加深,具体机制还有待研究[83].基于这些结果,科学家的推测UV-B光不仅促进蔬菜的光形态建成,还能促进果实的成熟,因此在蔬果种植中尤其是在果实成熟阶段,增加UV-B光可能帮助提升果实的口感和观赏度.
胡杨中的UV-B光受体PeUVR8含有9个保守的RCC1(Regulator of Chromosome Condensation 1)重复结构域和C27片段,预测所得的蛋白结构与拟南芥的UVR8高度相似.PeUVR8能回补拟南芥uvr8突变体的缺陷表型,并结合拟南芥的COP1以诱导UV-B光应答基因的转录[72].胡杨的生长环境恶劣,具有极强的耐旱能力,是沙漠中的“生命之魂”,尤其是长期暴露在较高强度的UV-B光下,PeUVR8可能帮助胡杨耐受高强度的UV-B光.白桦中的BpUVR8不仅能够感知UV-B光信号,参与调控脱落酸(ABA)信号通路,且其蛋白水平受到ABA信号的调控;当BpUVR8过表达后,在ABA处理下的白桦种子萌发率会降低,根部的生长也会受到抑制,提示白桦中UV-B光信号通路和ABA信号通路间存在交叉调控[73].
杭白菊中的CmUVR8也包含9个RCC1重复结构域及C27片段;CmUVR8能回补拟南芥uvr8突变体的表型,促进UV-B光下类黄酮合成相关基因的表达,并能与CmCOP1结合,可能通过与拟南芥类似的机制使UV-B光信号转导起始;CmUVR8可能调控杭白菊在UV-B光下类黄酮的积累,保护其免受光损伤,但杭白菊与拟南芥中类黄酮的成分不同,因此其UV-B光信号转导的下游调控过程可能与拟南芥存在较大差异[74].UV-B光也能刺激洋甘菊叶片启动损伤保护机制,避免其受到损伤[84].
UV-B光能影响多种重要农作物的生长发育,如棉花、玉米、高粱和水稻[85-88]:棉花的生殖生长受低强度UV-B光的影响,因此UV-B光照可能会影响棉花的产量;然而棉花的营养生长受高强度UV-B光的影响,强UV-B光能够增加棉花近轴叶表面的蜡质成分和气孔指数,还会使棉花的叶片变薄.高强度的UV-B光对高粱、玉米和水稻的生长产生胁迫,而低强度的UV-B光是否能影响这几种农作物的生长与产量目前尚未见报道.研究UV-B光对农作物的影响,能够为利用UV-B光来优化作物种植条件、改善作物生长或提高产量提供科学指导.这些农作物的UV-B光受体还有待研究.
4 总结和展望
早在1989年,Caldwell等[93]就发现UV-B光能影响拟南芥的光形态建成;而围绕UV-B光信号转导机制的研究,以2011年对UV-B光受体的鉴定为契机,在近10年内逐步展开,取得了一系列重要的进展,让人们对UV-B光在植物生长发育中的积极作用有了新认识.拟南芥UV-B光受体UVR8不仅能接收UV-B光信号,还能通过转录因子调控下游基因的表达.COP1蛋白在UV-B光信号转导的起始阶段与UVR8蛋白一起将信号向下游传递,并稳定了转录因子HY5;RUP1/2蛋白一方面促进UVR8蛋白恢复成二聚体,另一方面介导HY5蛋白的降解,避免信号的过度放大;HY5及其他多种转录因子协同作用,有序调控多类UV-B光应答基因的表达,并通过诱导RUP1/2基因表达形成负反馈的调节机制.UV-B光信号转导通路的每一个关键节点都存在正反两种调控模式,保证了信号的平衡转导.
适度的UV-B光有利于植物的生长发育并能减少UV-B光对植物的伤害.然而,近半个世纪以来,臭氧层的破坏造成了地表UV-B光强度的增加,对植被环境以及粮食生产造成的影响不容忽视.研究UV-B光信号转导不仅能提供植物适应UV-B光的基本知识,还有助于人类根据光照环境变化有针对性地改善植物的生长环境,科学利用UV-B光能源服务于作物改良育种.
