人乳头瘤病毒疫苗的研究进展
2021-04-15李少伟王致萍李婷婷夏宁邵
李少伟,王致萍,池 鑫,陈 洁,李婷婷,顾 颖,张 军,夏宁邵*
(1.厦门大学公共卫生学院,分子疫苗学和分子诊断学国家重点实验室,福建 厦门 361102;2.厦门大学生命科学学院,国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102)
在自然界中,有一类广泛感染脊椎动物的古老病毒,被称为乳头瘤病毒(PV),有着几百万年的存在历史[1].20世纪30年代,美国科学家Shope等[2]首次从雪兔中分离得到了棉尾兔乳头瘤病毒(CRPV),随后的研究发现该病毒可导致兔产生肿瘤[3].在CRPV被分离鉴定之后,许多其他PV如牛乳头瘤病毒(BPV)和犬口腔乳头瘤病毒(COPV)也陆续被分离鉴定[4-5].早期PV和另一类多瘤病毒统一归类为乳多空病毒科(Papovaviridae).20世纪70年代,随着分子生物学技术迅速发展,人们认识到PV与多瘤病毒在基因序列、转录方式和编码蛋白的同源性等方面存在极大差异,因此国际病毒分类委员会(ICTV)于2000年将PV归类为乳头瘤病毒科(Papillomaviridae).在1983年和1984年,德国zur Hausen课题组从宫颈癌组织中分离得到人乳头瘤病毒HPV16和HPV18型毒株,揭示了HPV感染与宫颈癌发生的密切关系[6-7].2006年美国Merck公司的第一个HPV疫苗上市,使得HPV导致的宫颈癌和尖锐湿疣等成为可预防的疾病.zur Hausen因发现HPV和癌症的关系而获得2008年的诺贝尔生理学或医学奖.本文综述HPV的生物学和流行病学特征,及其预防性和治疗性疫苗的最新研究进展,为其他病毒疫苗的创新研究提供思路和借鉴.
1 HPV的生物学和流行病学特征
1.1 HPV病毒基因组、蛋白及分型
PV是一类无包膜的双链环状DNA病毒,其直径约55 nm,呈二十面体结构.HPV属于乳头瘤病毒科乳头瘤病毒属(Papillomavirus),其基因组长度为7~8 kb,可划分为3个区域:编码早期蛋白的早期区,主要负责编码病毒复制和宿主细胞恶性转化所需的各种蛋白(E1、E2、E4、E5、E6和E7),长度约4 kb;编码晚期蛋白的晚期区,主要负责编码病毒的两个衣壳蛋白L1和L2,长度约3 kb;剩下的为非编码区,长度约1 kb,包含转录调控原件,因此也被称为长调控区(LCR)(图1)[8].
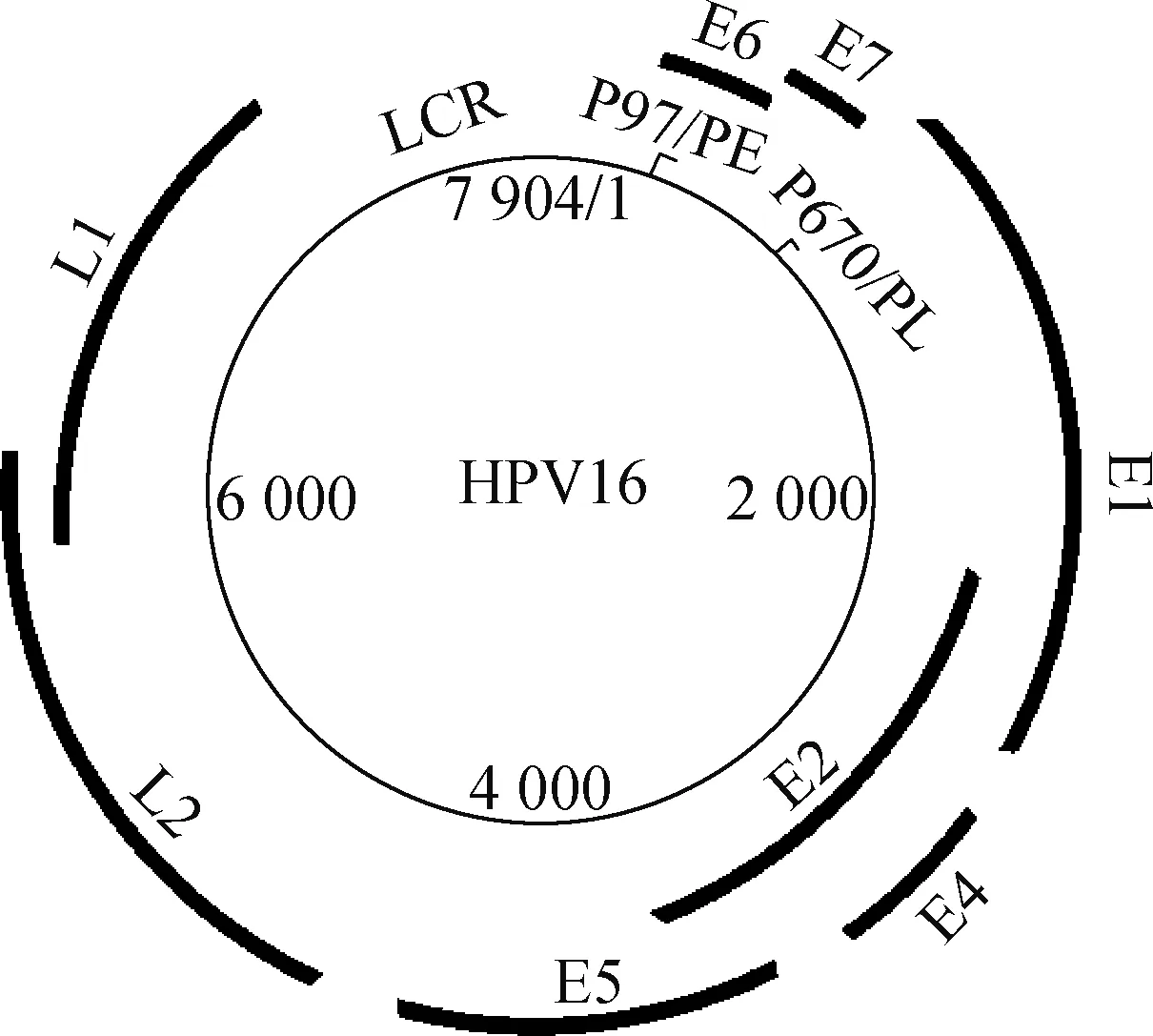
E1.调控病毒DNA复制;E2.病毒转录调节因子;E4.促进 病毒成熟与释放;E5.宿主转化相关,调节生长因子信号通路; E6.宿主转化相关,促进p53降解;E7.细胞转化相关, 结合pRb蛋白;L1.主要衣壳蛋白;L2.次要衣壳蛋白; P97/PE.早期启动子;P670/PL.晚期启动子.图1 HPV16基因组结构Fig.1 Genomic organisation of HPV16
早期蛋白主要在病毒感染早期表达(除E4表达于病毒复制晚期外),通过相互作用调节病毒扩增和宿主细胞恶性转化[9-12].其中,E1是DNA解旋酶,也是唯一由PV编码的酶[13];E2是序列特异性的DNA结合蛋白,是主要的转录调节因子[14];E4可能具有促进病毒成熟和释放的功能[15];E5、E6和E7是重要的癌蛋白,与宿主细胞的恶性转化相关[16-17].
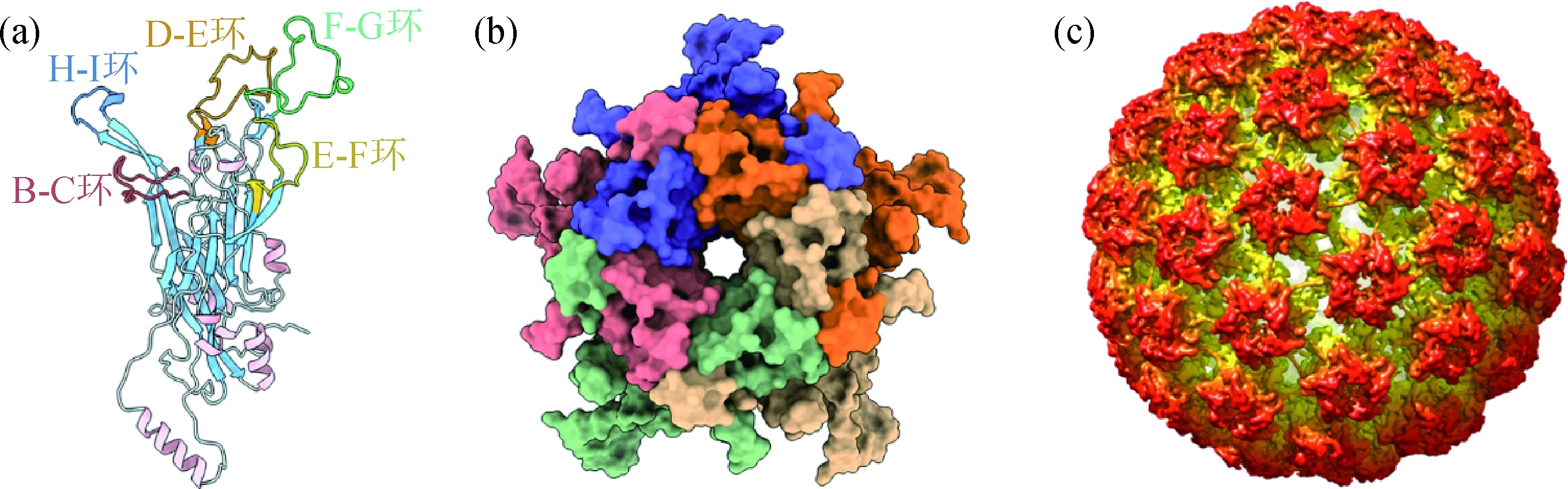
(a)HPV16 L1单体(PDB:1DZL[18]);(b)HPV58 L1五聚体(PDB:5Y9E[19]);(c)HPV16 L1 VLP(PDB:3J6R[20]).图2 HPV L1单体、五聚体和病毒样颗粒(VLP)Fig.2 HPV L1 monomer,pentamer and capsomer (VLP)
晚期蛋白是形成HPV衣壳的结构蛋白,在病毒感染晚期表达,包括L1和L2,两者共同组成了病毒的球状颗粒结构.L1分子质量约55 ku,单个L1分子主要包括α螺旋、β折叠和β折叠片之间的柔性环状连接肽(图2(a)),其中β折叠形成的“桶状”结构是L1的核心区[18].研究发现HPV衣壳颗粒结构可仅由L1形成,5个L1首先形成五聚体的基本结构单位[19](图2(b)),72个五聚体再进一步组装为三角形剖分数T=7的二十面体对称结构(图2(c)),又称为病毒样颗粒(VLP)[20],其具有良好的免疫原性,是目前已上市HPV疫苗的抗原成分.L2在病毒颗粒中占比很少,最多可占病毒衣壳总量的1/6,但其对于病毒的组装和感染具有重要作用[21],因其序列在各型HPV中非常保守,故具有成为广谱疫苗的潜力,但其分子结构及与L1的相互作用细节尚未知.
病毒分类主要基于病毒基本性质,如基因序列、组织嗜向性、感染模型等[22].虽然PV的宿主范围十分广泛,但是其具有严格的宿主特异性和组织特异性[23].由于缺乏相应的血清标志物,所以采用其宿主特异性和基因序列同源性进行分类.能感染人的HPV主要属于α、β、γ、μ和ν 5个属;引起恶性肿瘤的HPV主要在α属中,其中最常见的HPV16和HPV18分别属于α属的9种和7种.目前已鉴定超过200型HPV,其中绝大多数型别已完成全基因组测序.
1.2 HPV生活史及致病机理
HPV的生活周期严格依赖于宿主上皮细胞的增殖和分化过程[24]:首先HPV由皮肤或黏膜的微小创伤接触具有分化能力的基底层细胞,并通过衣壳蛋白与受体的相互作用进入上皮的基底细胞后,在衣壳蛋白L2的协助下,病毒基因组进入细胞核.在HPV感染早期,细胞仍可以维持正常的生理活动,但此时HPV的早期蛋白E1和E2开始表达,并借助宿主细胞的复制系统获得病毒的基因拷贝,此时拷贝数一般较低;在较低层的宿主细胞中也会表达癌蛋白,使得宿主细胞长期处于分裂状态.随着宿主细胞的向上迁移和分化,多种病毒基因组复制所需蛋白被上调,协助病毒基因组进行大量复制.在病毒感染终末期,早期蛋白E4和晚期蛋白L1和L2开始表达,晚期蛋白和基因组形成的新病毒颗粒在E4的帮助下从细胞中释放,进行下一轮感染.从最初的HPV感染到发展为组织良性或者恶性的病变过程十分漫长.HPV感染细胞后,为了维持自身基因组的复制和表达,通过癌蛋白E5、E6和E7的作用对宿主的细胞周期进行干扰,使得宿主细胞持续增殖、无法脱落,这是导致宿主细胞持续分裂成疣状病变或发展为癌症的主要原因.此外,在有丝分裂的过程中,HPV基因组通过非同源重组整合入宿主基因,通常引起E2编码基因区断裂,进一步增强癌蛋白E6和E7的表达.
1.3 HPV免疫学机制
人体免疫系统的天然免疫和适应性免疫会对感染的HPV进行控制和清除,因此大部分感染都是自限性的.研究表明90%以上的感染者会在3年内将病毒清除[25];但是由于HPV有多种逃逸免疫系统的机制,仍然会有小部分人成为持续感染者.
在皮肤或黏膜发生物理损伤后,病毒得以接触基底层细胞,此时起作用的是第一道免疫防线,也称为天然免疫或固有免疫.自然杀伤(NK)细胞和巨噬细胞在其中起关键作用.正常情况下,NK细胞上的杀伤抑制受体(KIR)与主要组织相容性复合体(MHC)Ⅰ类分子结合,抑制其对正常细胞的杀伤效应,而HPV感染会下调MHC Ⅰ类分子,启动NK细胞的杀伤功能;另外,白介素2(IL-2)、干扰素(IFN-α/β/γ)等多种细胞因子也对病毒感染起清除和抑制作用[26-27].
适应性免疫作为HPV免疫的第二道防线,需要经历识别、提呈、效应过程,免疫响应时间较长,但其具有特异性,且存在免疫记忆,仍是HPV免疫的重要组成部分.CD8+细胞介导的细胞毒性T淋巴细胞(CTL)杀伤效应能够清除被感染的细胞,而E6和E7存在多个CTL表位,可以引起这种特异性细胞杀伤[28].HPV感染后,机体会产生针对L1、L2和E6等多种蛋白的抗体,其中L1的抗体占比最大,但大多为型别特异性抗体,难以产生型别交叉免疫保护;HPV的抗体分子类型以IgG和IgA为主,其中IgA又分为血清型和分泌型,早期认为其在黏膜中的作用大于IgG(IgG主要分布于血清中,可透过血管壁浸润周围组织),但后期的临床试验证明IgG类抗体在抗HPV感染中起主要作用[29-30].
HPV的基因组虽然简单,但是进化出诸多复杂的机制来逃避宿主的免疫监控和清除.HPV感染初期,病毒早期抗原表达量低,且不表达晚期抗原;在后期迁移到离基底层细胞较远的表层才开始大量表达晚期抗原,且不会引起细胞的裂解,因此难以引起免疫系统的有效应答[31].L2也在HPV的免疫逃逸中起重要作用,主要通过阻止朗格汉斯(Langerhans)细胞表面的免疫相关信号分子数量上升,并抑制其激活T细胞的能力[32].另外,某些型别的E6和E7可以通过干扰细胞周期来下调Ⅰ型IFN的表达[33].
1.4 HPV流行病学现状
HPV感染十分常见,传播途径主要为性传播.在一项对女性的长期观察数据分析中发现,18~35岁女性中HPV检出率为42.6%,但只有小部分会持续感染发展为癌症[34],癌症发展过程通常在10年以上.男性群体的HPV检出率在不同地区和群体中差异很大,但在性行为活跃的男性中HPV检出率较高[35].HPV感染的人群呈现明显年龄差异特征,目前比较主流的观点是呈现双峰分布,即存在25岁以下及65岁以上两个感染高峰[36].据2019年世界卫生组织(WHO)的统计数据显示:世界范围内,每年约有57万新发宫颈癌病例,31.1万死亡病例[37].HPV在全世界范围内广泛流行,但由于经济发展水平、文化差异、地理环境等因素的不同,在各地区HPV的流行率存在较大差异,亚洲和欧洲的感染率较低,而非洲和大洋洲的感染率较高.
目前鉴定出的HPV型别超过200多种,国际癌症研究中心根据其危险性,将HPV分为低危型和高危型;根据高危型的致癌能力强弱又将其分为3类:1类(致癌)包括HPV16、18、31、33、35、39、45、51、52、56、58和59共12个型别,2A类(很可能致癌)仅包括HPV68一个型别,2B类(可能致癌)包括HPV26、30、34、53、66、67、69、70、73、82、85和97共12个型别[38].低危型HPV主要引起组织的良性病变,如HPV11和HPV6的感染通常引起肛门和外生殖器疣,是15~24岁人群中的高发性传播疾病,某些嗜皮肤型低危HPV也可以引起扁平疣和跖疣等皮肤病变;高危型HPV则与组织癌变有关,包括宫颈癌、口咽癌、头颈癌、阴道癌、外阴癌、阴茎癌和肛门癌等[23].在宫颈癌患者中,HPV16和HPV18的检出率最高,约占全球患者的70%以上,中国人群中84.5%的宫颈癌由这两种HPV病毒引起;此外,HPV58、52和33也是检出率较高的型别[39].
2 HPV预防性疫苗的研究进展
疫苗是人类历史上最伟大的发明之一,接种HPV预防性疫苗是预防HPV感染及其相关疾病最经济有效的方法.HPV自然感染引起的免疫反应较弱,难以产生足够滴度的抗体来中和入侵的病毒;而接种HPV预防性疫苗可以刺激机体产生高滴度的中和抗体,清除入侵病毒.临床结果显示,HPV疫苗产生的中和抗体可以渗透血管壁到达感染部位,结合病毒使其丧失感染细胞的能力[40],L1和L2均是良好的预防性疫苗候选蛋白.
近期有研究结果表明,青少年女性的HPV疫苗(馨可宁®/Ceclin®)接种联合成年女性每5年一次的careHPV筛查是中国宫颈癌防控最具成本效益的策略[41].2020年10月1日发表的瑞典最新HPV疫苗大规模接种人群(1 672 983名10~30岁的女孩和妇女)2006—2017年的随访研究结果显示,17岁前完成HPV疫苗接种可减少88%的宫颈癌发生,18~30岁接种可减少53%的宫颈癌发生[42].可见接种HPV疫苗能显著降低宫颈癌的发生风险,且接种HPV疫苗越早,接种年龄越小,预防宫颈癌的效果越好.HPV 具有严格的种属和组织特异性,感染高度未分化的上皮细胞,在体外难以大规模培养,因此目前已上市的HPV预防性疫苗都是L1蛋白的VLP形式,其结构与天然HPV高度相似,具有良好的免疫原性,免疫机体可诱导产生高滴度的针对疫苗型别HPV的中和抗体;此外,这种形式的疫苗不含有病毒的基因组成分,不存在致癌的可能,具有良好的安全性.
2.1 已上市的HPV预防性疫苗现状
截至2020年10月,已上市的HPV疫苗有4种,分别是2006年上市的4价疫苗Gardasil®4[43]、2007年上市的2价疫苗Cervarix®[44]、2014年底上市的9价疫苗Gardasil®9[45]和2019年底上市的2价疫苗馨可宁®/Cecolin®.这4种疫苗均基于L1 VLP研制.
2.1.1 Gardasil®4
2006 年美国Merck公司研制的Gardasil®4(加卫苗)是全球首个上市的HPV疫苗,该疫苗含有酿酒酵母(Saccharomycescerevisiae)表达的HPV6、11、16和18这4种型别的L1 VLP,通过吸附到羟基磷酸铝硫酸盐佐剂(AAHS)上制成疫苗[46],可以预防约90%的尖锐湿疣和约70%的宫颈癌.每剂Gardasil®4疫苗中HPV6、11、16和18 VLP的含量分别为20,40,40 和20 μg,接种目标人群为9~26岁女性,接种方式为肌肉注射,程序采用0,2和6个月三针免疫.
Gardasil®4上市前,先后进行了10次以上临床试验,结果表明其具有良好的安全性和有效性,疫苗有效率可达100%.2007年一项覆盖12 167名15~26岁女性的随机双盲多中心的Ⅲ期临床试验显示,Gardasil®4对HPV16和18引起的宫颈上皮内瘤变(CIN)2级或3级以及原位癌的保护率高达98%,对非疫苗型别感染也有一定的预防作用[47];2007年一项覆盖5 455名16~24岁女性的临床试验显示,Gardasil®4对宫颈病变的保护率为98%[48];2009年一项覆盖1 910 名24~45岁女性的临床试验显示,Gardasil®4对HPV16和18感染引起相关疾病的保护率为83.1%,对HPV6和11感染引起相关疾病的保护率为100%[49];而且在多次临床试验中该疫苗均未出现严重的不良反应,证明其安全性和有效性良好[49-53].
2008年12月31日,Gardasil®4在中国启动Ⅲ期临床试验,共有3 006名20~45岁女性参与,第30个月和第78个月的随访报告显示,其对6和12个月宫颈持续感染的疗效分别达91.6%和97.5%,还降低了与HPV6、11、16、18相关的宫颈细胞学异常率,有效率为94.0%[54],提示Gardasil®4对20~45岁的中国女性的持续感染和生殖器癌前病变是有效的.2017年,Gardasil®4获中国国家药品监督管理局批准上市.随后90个月的随访报告显示,Gardasil®4在20~45岁的中国妇女中耐受性良好,且具有良好的安全性,这与全球试验和安全性监测研究的结果一致[55].
此外,2011年的一项覆盖18个国家的4 065名16~26岁健康男性的临床试验结果显示,Gardasil®4对HPV6、11、16和18相关病变的有效率为90.4%,表明Gardasil®4可预防HPV6、11、16和18感染引起的16~26岁男性外生殖器相关病变的发生[56].另有临床试验评估了Gardasil®4在3 252例27~45岁女性中的有效性,随访时间中位数为3.5年,结果显示Gardasil®4在预防HPV6、11、16和18相关的任何级别CIN的有效率为87.7%[49,57].基于上述临床数据,美国食品药品监督管理局(FDA)在2018年10月批准将Gardasil®4的适用人群扩大到27~45岁的女性和男性[49,57].
临床试验结果显示,4价疫苗对其他高危型HPV如HPV31、33和45的传播也有预防作用,但交叉保护效力较低,对HPV31、33和45的保护效力分别为46.2%,24.0%和7.8%[58].
2.1.2 Cervarix®
2007年9月,英国葛兰素史克(GlaxoSmithKline,GSK)公司研发的疫苗Cervarix®(卉妍康)获得欧盟批准上市,2009年10月获得美国FDA通过,2016年于中国大陆获批上市.该疫苗含杆状病毒-昆虫细胞表达的 HPV16和18两种VLP组分,含量均为20 μg,不包含低危型 HPV,因此并不能预防尖锐湿疣,但同样可以保护约70%的宫颈癌.该疫苗使用的佐剂是GSK公司研发的AS04佐剂,包含氢氧化铝和单磷酰脂质(MPL)A[59],性能优于氢氧化铝佐剂,具备较好的免疫增强效应[60].接种目标人群为9~45岁女性,接种程序为0,1和6个月三针免疫,采用肌肉注射.
Cervarix®的Ⅲ期临床试验规模比Gardasil®更大,有来自亚、欧、美洲的14个国家的18 729名15~25岁女性参与.2009年的临床试验显示Cervarix®对HPV16和18相关的2级及以上CIN有98.1%的保护率[61];同时该疫苗具有良好的长效性,接种疫苗4~5年后,免疫人群中 HPV16和18抗体的阳性率仍达到98%,而且疫苗所诱导的抗体滴度在接种4年后依然维持在较高水平[62-66].在一项7年的横断面研究中,Kavanagh等[67]明确了2价疫苗具有重要的交叉保护作用:12~13岁的女性接受2价疫苗的接种,20~22岁时接受宫颈细胞学筛查并检测HPV DNA,以评估HPV疫苗对病毒传播的预防作用,结果发现HPV疫苗减少了89%的HPV16和18感染和传播;更重要的是,2价疫苗对HPV31、33和45亚型感染均有预防和减少传播的作用,其交叉保护效力分别为93.8%(95%可信区间83.8%~98.5%),79.1%(95%可信区间64.2%~89.0%)和82.6%(95%可信区间61.5%~93.9%).Cervarix®在安全性方面同样较好,但由于该疫苗含有MPL成分,接种疫苗后产生的不良反应发生率相比于Gardasil®略高[68-69].
2.1.3 Gardasil®9
2014年12月,Merck公司研制的Gardasil®9在美国获批上市.该疫苗同样在酿酒酵母中表达,含有HPV6、11、16、18、31、33、45、52和58共9种VLP组分,含量分别为30,40,60,40,20,20,20,20和20 μg,抗原总量高达270 μg,接种程序为0,2和6个月三针免疫,采用肌肉注射,适宜人群为9~26岁女性和9~15岁男性.Gardasil®9可以预防由7种高危型HPV导致的约90%的宫颈、阴道、外阴和肛门癌症,以及由低危型 HPV6和11导致的约90%的尖锐湿疣.
2017年报道的一项覆盖18个国家的14 215名16~26岁女性的临床试验显示:Gardasil®9对高度宫颈病变、外阴及阴道病变的保护率为97.4%;与Gardasil®4相比,9价疫苗诱导的抗体滴度在接种疫苗3年内无明显降低;总的来说,Gardasil®9能预防约90%的宫颈癌,疫苗的效力能维持至少6年[70].在安全性方面,两组间严重不良事件无显著差异,11名参与者在研究随访期间死亡(Gardasil®9 疫苗组6人,Gardasil®4疫苗组5人),但这些死亡事件均与疫苗无关,Gardasil®9总体上具有更广病毒型别保护范围和良好的安全性[71-72].
2.1.4 馨可宁®(Cecolin®)
2019年12月,由厦门大学联合厦门万泰沧海生物技术有限公司研制的首个国产宫颈癌疫苗馨可宁®(Cecolin®)在我国获批上市,标志着我国成为继美国、英国之后世界上第3个实现HPV疫苗自主供应的国家.与之前上市的HPV疫苗不同的是,该疫苗首次采用高效、简便、快速、低廉的大肠杆菌(Escherichiacoli)重组表达系统获得疫苗抗原,即HPV16和18的L1 VLP,大大降低了生产成本,并提高了产量,为WHO 2018年提出的要在2030年全球消除宫颈癌计划和2020年两会政协提案——将HPV疫苗纳入国家免疫规划(9~14岁女孩免费接种),提供了可行性基础.
馨可宁®含有HPV16和18两种VLP组分,每剂含量分别为40和20 μg,使用铝佐剂.2020年,一项7 372 名18~45岁中国女性参与的临床试验结果显示,馨可宁®对HPV16和18相关的高度生殖道病变保护率为100%,对HPV16和18持续感染的保护率为97.8%[73].由于上市时间短,还未有相关的交叉保护数据报道.2020年4月21日,馨可宁®首批93 643支疫苗获国家药品监督管理局的生物制品批签发证明,2020年5月18日全国首针国产HPV疫苗在湖北省武汉市妇幼保健院接种,截至2020年9月全国已有18个省份实现了国产2价苗接种,分别为湖北、江西、云南、新疆、山东、河南、广东、河北、上海、天津、湖南、福建、海南、浙江、吉林、山西、内蒙古和四川,批签发数量超过200万支.另外,一项979名9~26岁女性接种馨可宁®的临床试验表明,9~14岁女孩接种3或2剂HPV疫苗的免疫原性与年轻成年妇女的免疫原性没有统计学差异,并首次获批9~14岁女孩两针法免疫接种程序[74].在产能一定的情况下,减少接种次数可增加接种人数并提高接种完成度.
2.2 处于临床阶段的HPV疫苗研究现状
除了已经上市的4种HPV疫苗外,还有多种疫苗也进入临床阶段,其中包括L2肽段为抗原的疫苗和靶向癌蛋白的重组腺病毒(Ad)载体疫苗,但大多数仍以HPV L1蛋白作为免疫原.国外多数进入临床阶段的HPV疫苗为治疗性疫苗.目前,我国有5个研发单位的HPV 9价疫苗已经进入临床阶段,其中,厦门大学联合厦门万泰沧海生物技术有限公司[75]和上海博唯生物技术公司的HPV 9价疫苗已经进入Ⅲ期临床;HPV 4价疫苗和HPV 2价疫苗也分别有2和3个研发单位进入临床阶段;除了常见的2价、4价和9价疫苗外,3价、11价和14价疫苗也获批进入临床阶段的研究(表1).
2.3 新一代HPV预防性疫苗的研究
目前上市的预防性疫苗均是以含有野生型蛋白序列的HPV L1 VLP为抗原、多型别混合制备的,其中保护范围最广的是9价疫苗Gardasil®9(约90%),其保护机制是诱导机体产生高滴度的中和抗体[76].然而,HPV具有高度的型别特异性,单一型别VLP诱导的抗体难以对其他型别产生交叉中和,导致现有上市的HPV疫苗难以保护疫苗涵盖型别之外的其他HPV型别;而目前已知的高危型HPV在15种以上,不同地区宫颈癌相关HPV型别分布也有较大的差异,其中9价疫苗保护范围外的HPV59和35两种型别在西非的分布分别占9.8%和4.4%[41].新一代疫苗需要考虑达到更广的型别保护范围,然而继续增加新型别HPV L1 VLP将加大生产工艺的复杂性和潜在的副作用,且多种不同型别VLP混合免疫在体内可能会产生不同型别免疫原的免疫反应干扰,影响保护效果.因此,新一代HPV预防性疫苗研发需突破原有疫苗仅产生型别特异性保护的限制,在理论和技术上另辟蹊径.
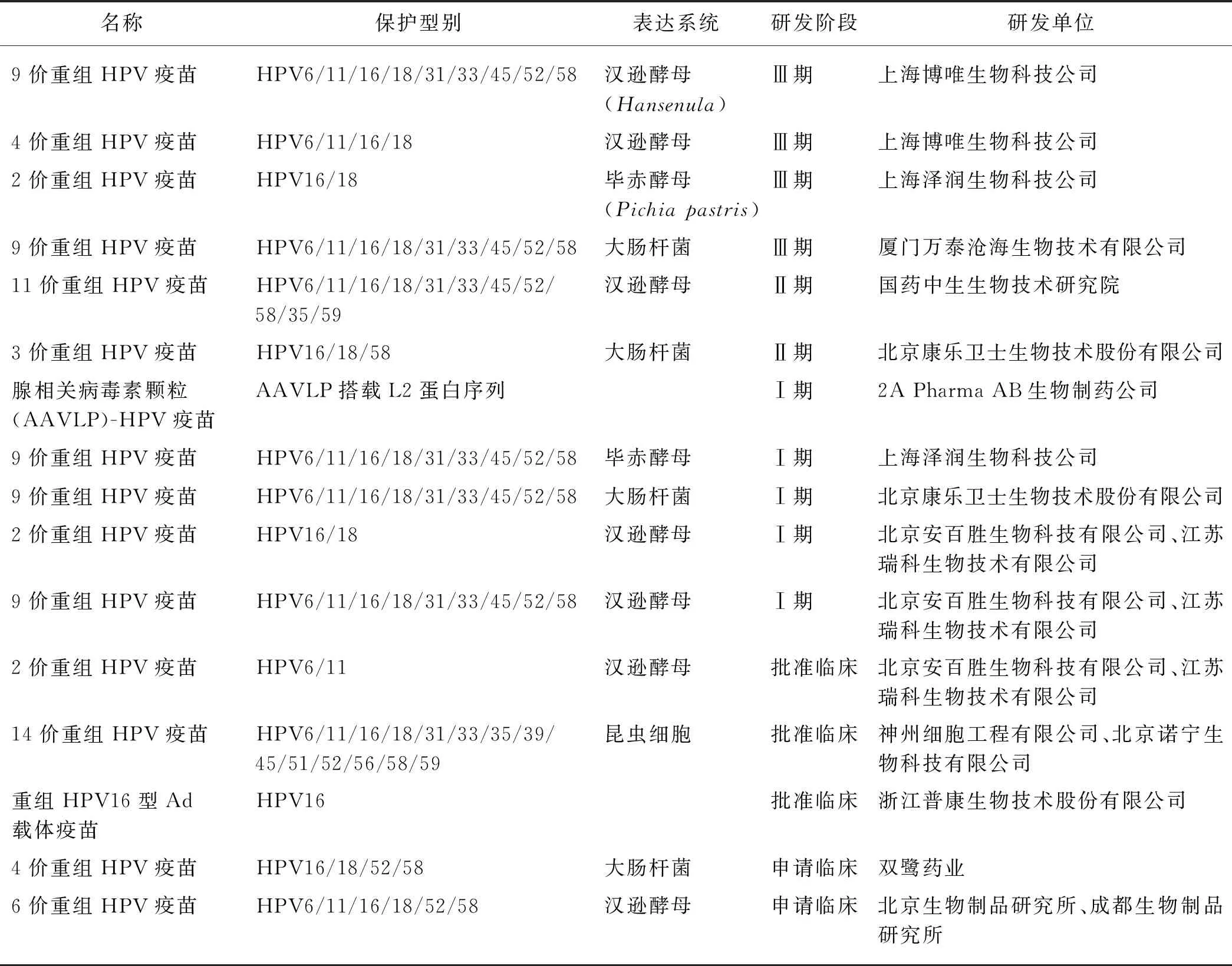
表1 我国临床阶段的HPV疫苗Tab.1 The HPV vaccines at clinical stages in China
厦门大学研究团队关于HPV58和59的型别特异性中和表位结构的研究表明[20]:1) HPV严格的型别特异性结构基础是型别特异性中和表位氨基酸在同一型别蛋白序列中高度保守,但在不同型别间有较大的差异,这些氨基酸与HPV感染宿主细胞相关;2) 型别特异中和表位氨基酸大多数位于HPV L1五聚体表面的环区,而不同型别的中和表位关键氨基酸所处的结构环区不尽相同[77-78];3) 将一种型别特异的中和表位关键氨基酸替换到型别进化亲缘关系近的HPV L1蛋白上,突变的VLP具有结合被移植型别的特异中和抗体的活性,表明型别特异性中和表位可以被移植重塑,型别间中和表位移植具有构建产生不同型别保护抗原的潜力.
根据上述结果,厦门大学研究团队进一步开展了新一代疫苗的理想设计:首先分析国际癌症研究机构(IARC)分类中20种危害较大型别HPV的主要结构蛋白L1的进化关系,并与其中8种型别HPV的衣壳粒五聚体晶体结构保守性进行比较,发现型别特异性的优势中和表位是由表面的型别特异性氨基酸和病毒颗粒保守性整体结构共同组成的;利用基于结构信息的同源替换方法,在一种经过分子改造的HPV58/33/52 3型别嵌合VLP上实现了各型别HPV的抗原性和免疫原性兼顾,并在非人灵长类动物体内诱导出与3倍剂量的野生型混合VLP相当的交叉免疫保护抗体滴度;进一步利用晶体结构和冷冻电镜(cryo-EM)结构测定揭示了这种嵌合型VLP产生交叉保护的结构基础;此外还成功设计出另外的4种3型别嵌合VLP(HPV16/31/35、HPV56/66/53、HPV39/68/70和HPV18/45/59),验证了这种分子设计策略的通用性,从而为研制7种嵌合VLP保护20种型别HPV感染的新一代HPV疫苗开辟了新途径[79].基于该设计的新型HPV疫苗与目前上市的预防性疫苗相比,减少了疫苗颗粒的种类,从而降低了免疫剂量、生产工艺难度以及生产成本,同时提高了疫苗保护范围.
早期研究发现,HPV L1的C末端存在一个伸入相邻五聚体的“折返”结构,该结构中的一个保守半胱氨酸与相邻五聚体中EF环的保守半胱氨酸形成二硫键[80],这两处突变会导致五聚体无法形成VLP;在HPV16中这两处位点为C175和C428,通过序列比对将其他型别的对应位置半胱氨酸也命名为C175和C428.为了进一步提高多型疫苗的覆盖范围,也考虑其他高变异病毒疫苗和靶向肿瘤新抗原的疫苗设计中所需的多种表位聚集,厦门大学研究团队对HPV VLP组装机制已有深入认识[81]:两个不同型别的L1-C175A五聚体和L1-C428A五聚体杂合组装可以恢复L1蛋白形成VLP的能力,且其颗粒形态与野生型VLP类似,均为T=7的二十面体对称结构,这种单一颗粒被称为杂合病毒样颗粒(chVLP).基于此,该团队设计了一种能够针对多种型别HPV同时产生免疫保护效果的chVLP,并证明该杂合组装方式是一种不限HPV型别的随机组装,实验测试中2~9种不同型别的L1五聚体均可杂合组装成chVLP,理论上一个chVLP中能容纳72种不同型别的L1五聚体.使用多种型别或chVLP特异的单克隆抗体分析颗粒抗原性发现,chVLP在保留了大部分型别特异性表位的同时也产生了不同于野生型的新表位.进一步使用该杂合组装策略将9种型别(HPV6、11、16、18、31、33、45、52和58)的L1五聚体装配至单颗粒中形成9型(nona-type)chVLP,在小鼠模型中能诱导得到与已上市的HPV 9价疫苗Gardasil®9相当的高中和抗体滴度,且在疫苗制备方法上具有一定优势:纯化过程中五聚体状态更稳定,颗粒组装过程更加可控且不需要加入还原剂(如二硫苏糖醇)[82].如果将该杂合组装技术与前期设计的3型别嵌合颗粒技术相结合,理论上可以通过在单一chVLP上簇集216种型别的HPV中和表位而制成pan-HPV广谱疫苗,可涵盖目前鉴定的200多种型别的HPV.
在新一代HPV疫苗研发中,新型佐剂可发挥增强免疫原性和延长免疫持久性的作用,如GSK公司在HPV 2价疫苗Cervarix®中使用的AS04佐剂.基于此,2019年厦门大学研究团队联合厦门万泰沧海生物技术有限公司,与GSK签署合作协议,利用厦门大学的创新抗原技术与GSK的新型佐剂系统联合研发新一代的HPV疫苗.这是中国疫苗行业首次借助独创技术与国际顶尖疫苗企业紧密合作,共同开发重磅疫苗品种并在全球商业化,也是中欧医药界推进合作共赢的一项代表性事件,标志着中国的疫苗关键核心技术已得到国际同行的高度认可.
2.4 基于L2的预防性疫苗研究进展
另一种HPV预防性疫苗的策略主要聚焦于具有潜在广谱保护性的L2蛋白.20世纪90年代,一些研究报道了重组表达的L2可以作为免疫原,抵抗动物PV的感染[83-84].也有研究发现L2 N端的肽段具有高度保守性,广谱中和表位位于L2 N端第17~120位氨基酸区域.Gambhira等[85]筛选获得一株可以中和HPV16型假病毒的单克隆抗体RG-1,其结合表位位于HPV16 L2肽段(第17~36位氨基酸),而采用该肽段进行免疫小鼠获得的血清可以中和多种HPV型别的假病毒以及BPV1型,表现出其具有成为广谱HPV预防性疫苗的潜力.BPV L2 N端的由88个氨基酸构成的肽段可以中和多种HPV型别的假病毒[86].将L2的第108~120位氨基酸肽段替换到HPV16 L1 C末端螺旋4,构建嵌合抗原,其小鼠免疫血清可以中和同源HPV16/52假病毒[87].
尽管HPV L2重组蛋白作为免疫原表现出较好的广谱保护性,但仍具有一定的局限性,如:其诱导产生的中和抗体滴度远低于L1 VLP抗原;虽然其具有保守性,但是缺乏充分的研究数据表明其广谱性优于上市的9价疫苗,且没有证据表明L2抗原疫苗能够预防所有的高危型HPV感染;L2蛋白在病毒感染的多个过程中起重要作用,作为疫苗抗原的安全性仍然需要进一步考察.目前基于L2蛋白的预防性疫苗研究主要集中于通过分子内佐剂、载体展示、表位串联等方式提高其诱导产生的中和抗体滴度,聚焦于中和表位,提高安全性.
有研究通过分子内佐剂增强体液免疫应答,从而提高交叉中和抗体滴度,如强黏膜佐剂大肠杆菌热不稳定肠毒素(LT),将其去毒突变体融合至L2 C端作为分子内佐剂[88];细菌鞭毛蛋白(Fla)融合L2也有类似效果[89].此外有研究使用钙网蛋白增强T细胞介导的免疫应答[90];或采用Toll样受体2(TLR2)配体Pam2Cys (P2C)联合日本血吸虫(Schistosomajaponicum)虫卵抗原Th1表位肽P25与HPV1 L2的第17~36位氨基酸肽段组合,提高其免疫原性,可中和多种HPV型别的假病毒[91].
利用载体蛋白或颗粒展示肽段是常用的增强肽段表位免疫原性的方法,VLP表面展示是其中的主要方法之一.颗粒性抗原有利于抗原呈递,表面多价表位容易刺激B细胞[92],并可促进B细胞受体交联[93].有研究采用HPV VLP展示L2肽段,同时将L2的不同肽段插入或替换L1的不同位置(如D-E环区[94-97]和h4[87]),相比单一肽段免疫,提高了L2中和抗体的滴度,还可诱导产生针对L1的高滴度抗体,具有产生L1和L2中和抗体的双重效果.也有利用其他病毒的VLP开展类似的L2疫苗研究,包括腺相关病毒(AAV)[98]、5型腺病毒(Ad5)[99]、乙肝病毒核心蛋白VLP[95]、马铃薯病毒X(PVX)[100]和噬菌体VLP[101]等.
最近一项载体表面展示结合多价混合的研究表明,HPV L1 VLP的D-E环区展示或MS2噬菌体、VLP展示HPV16 L2的第17~36位氨基酸肽段表位效果最好[94,102-103],可以诱导产生针对HPV6、11、16、18、26、31、33、34、35、39、43、44、45、51、52、53、56、58、59、66、68和73多达22种型别的中和抗体.然而,载体展示疫苗可能存在诸如难以产生高滴度抗体和VLP抗原的热稳定性降低[104]等问题,故基于L2的广谱预防性疫苗研究仍然充满挑战.
3 HPV治疗性疫苗的研究进展
目前的预防性HPV疫苗并不能消除先前存在的HPV感染和相关病变,受感染细胞的清除依赖于诱导细胞免疫反应.基于HPV致癌机制的研究,目前HPV治疗性疫苗针对的靶抗原蛋白主要是E6、E7、E2和E5.其中,E6和E7被认为是最重要的致瘤蛋白,当前大多数治疗性疫苗的研发是针对E6和E7,目的是以不同形式将E6和E7抗原递送到抗原提呈细胞(APC),以分别激活HPV抗原特异性的CD8+CTL反应或CD4+辅助T细胞反应,从而清除病毒及已感染病毒的细胞.目前已经开发了几种类型的治疗性疫苗,并在临床前和临床试验中进行了测试,包括活载体疫苗、亚单位疫苗、DNA疫苗和树突状细胞(DC)疫苗.
3.1 活载体疫苗
活载体疫苗是将编码HPV特异性抗原(E6和E7)的基因插入到无毒或减毒的病毒载体、细菌载体中,利用这些载体在体内复制并促进抗原的传播.其免疫原性高,可以诱导强烈的细胞和体液免疫反应,但也有如下缺点:对免疫功能缺失的个体不是100%安全;机体对载体本身的免疫反应使其不宜反复使用;外源性HPV抗原表达量过低,对载体的免疫反应可能超过对HPV抗原的免疫反应;表达的HPV抗原可能与天然抗原有差异.
3.1.1 细菌载体疫苗
减毒的细菌载体具有诱导黏膜、体液和细胞免疫的能力,且细菌载体的生产相对简单、便宜、稳定,易于大规模应用.目前单核细胞增生性李斯特菌(Listeriamonocytogenes)、乳酸乳球菌(Laciococcuslactis)、植物乳杆菌(L.plantarum)和干酪乳杆菌(L.casei)[105-108]等多种细菌载体被应用于HPV治疗性疫苗的研究,其中基于李斯特菌的疫苗Lm-LLO-E7包含截短的李斯特菌成孔蛋白O(LLO)和HPV16 E7蛋白.ADXS11-001是编码HPV16 E7的李斯特菌减毒活疫苗,2020年一项针对持续性或复发性宫颈鳞状细胞癌或非鳞状细胞癌患者覆盖50人的Ⅱ期临床试验(NCT01266460)结果显示:ADXS11-001疫苗是安全、可耐受的,并满足在宫颈癌志愿者中开展进一步调查所需协议规定的活性基准[109].
3.1.2 病毒载体疫苗
最广泛的病毒载体是Ad、AAV、甲型病毒和痘苗病毒(如改良安卡拉痘苗(MVA)病毒).1) TG4001疫苗是以减毒的重组牛痘病毒MVATG8042为载体,含有修饰过的HPV16E6/E7基因和IL-2基因.2011年Ⅰ期临床结果显示,21名HPV16相关CIN2级和3级的患者中,有10名患者(48%)显示疾病消退,8名患者的HPV DNA清除和7名患者的mRNA清除[110].2) 进展最快的MVA E2治疗性疫苗已经进入临床Ⅲ期研究,该疫苗能有效刺激机体产生针对HPV的免疫反应并使高级别病变减退.MVA E2疫苗是含有BPVE2基因的重组牛痘病毒,2014年Ⅲ期临床结果显示,在1 176例HPV引起上皮内病变的女性和180例仅患有疣的男性中, 89.3%女性的病变消退,100%男性的病变消退[111];但可能由于需要将MVA E2疫苗直接注射到子宫、尿道、外阴或肛门,这一治疗方式没有被广泛推广.3) 目前国内浙江普康生物技术股份有限公司的表达HPV16 E6和E7融合蛋白的重组腺病毒载体(Ad-HPV16 E6/E7)疫苗正在进行临床试验.
3.2 亚单位疫苗
亚单位疫苗是以多肽或蛋白形式递呈抗原.这类疫苗具有安全、稳定和易于生产的优点;但疫苗的免疫原性较低,限制了其对恶性肿瘤的治疗效果.因此需要辅以佐剂或免疫刺激分子,增强其免疫效应.
3.2.1 多肽疫苗
1) 合成长肽疫苗HPV16-SLP由E6和E7重叠多肽和Montanide ISA-51作为佐剂组成,多项临床试验研究证明其具有一定的治疗效果.在一项对9名HPV16高级别鳞状上皮内病变(HSIL)接种HPV16-SLP疫苗的Ⅱ期临床试验中,接种后均显示强烈的HPV特异性T细胞反应[112].2) PepCan疫苗由HPV16 E6蛋白的4种合成长肽及新型佐剂Candin组成.2016年31例HSIL患者的Ⅰ期临床试验结果显示,PepCan的安全性良好,且每肽50 μg的剂量显示出最好的组织学效果,50%的患者组织学完全恢复,85%的患者实现病毒清除[113].目前正在进行一项125名HSIL患者的Ⅱ期临床试验(NCT02481414),以进一步评估PepCan联合佐剂 Candin的有效性.
3.2.2 蛋白疫苗
多肽疫苗具有易生产、安全性高的特点,但受限于人类白细胞抗原(HLA)及需佐剂或高效给药系统辅助等缺点;而蛋白疫苗具有所有的抗原表位,因此不受HLA表型限制.目前文献报道主要有TA-CIN、GTL001和HSP65-E7融合蛋白疫苗.1) 国内上海泽润安珂生物制药有限公司的重组HPV 16型E7融合蛋白疫苗已获得临床试验批件.2) TA-CIN是一种融合了HPV16 L2、E6和E7的蛋白疫苗[114],已经在几项Ⅰ、Ⅱ期临床试验中被证明具有免疫原性和安全性[115-117].目前,另一项Ⅰ期研究计划评估TA-CIN联合GPI-0100佐剂治疗HPV16相关宫颈癌(NCT02405221)的安全性和有效性.3) GTL001是一种将HPV16 E7和HPV18 E7都融合到来自百日咳博德特氏菌(Borderellapertusis)的解毒腺苷酸环化酶中的2价治疗性HPV蛋白疫苗.但2016年Genticel发布了233名HPV16/18+细胞学未见上皮内细胞病变(NILM)、无明显意义的非典型鳞状上皮细胞异常(ASCUS)和低度鳞状上皮内病变(LSIL)的患者中使用GTL001的双盲、安慰剂对照的Ⅱ期研究的中期(18个月)结果(NCT01957878),显示接受GTL001疫苗的HPV16/18阳性患者的病毒清除与安慰剂没有显著差异.4)TVGV-1疫苗包括HPV16E7与铜绿假单胞菌(Pseudomonasaeruginosa)内质网靶向序列的融合蛋白和GPI-0100佐剂.目前正在进行一项10名宫颈HSIL患者的Ⅱa期临床试验(NCT02576561),研究该疫苗的安全性和有效性,评估其作为治疗性HPV蛋白疫苗候选的潜力.
3.3 DNA疫苗
DNA疫苗是将HPV的基因片段插入真核表达质粒中,用质粒进行免疫,通过人体细胞表达产生HPV抗原,由MHCⅠ类分子递呈激活免疫系统,以达到治疗HPV感染相关疾病的目的.1) GX-188E疫苗为共表达HPV16/18的E6和E7蛋白及FMS样酪氨酸激酶配体(Flt3L)的DNA疫苗,其中Flt3L为已知的DC激活剂,可以促进DC对抗原的加工和呈递.2014年Ⅰ期临床试验结果显示该疫苗具有较好的安全性和有效性[118],Ⅱ期临床试验正在进行中(NCT02596243和NCT02139267).2) VGX-3100是优化的HPV16/18的E6和E7两个质粒的组合[83-84],通过肌内注射递送,以小电荷形式进行电穿孔,也是目前最受瞩目的治疗性疫苗.该疫苗是全球首个开发用于治疗HPV癌前病变的疫苗,目前正在进行一项覆盖201名HPV16/18阳性的CIN2级和3级患者的Ⅲ期临床试验(NCT03185013),以证实VGX-3100的有效性、安全性和耐受性.
治疗性DNA疫苗有安全性高、稳定性高、易于生产等优势,具有潜在的研究价值.此外,与活载体疫苗不同,DNA疫苗在患者体内不会产生针对载体的中和抗体,可以反复加强[119].然而目前大多数HPV DNA疫苗还只针对HPV16/18这两个高危型别,对其他型别引起的宫颈癌还需要进一步的临床研究.
3.4 DC疫苗
DC是呈递能力最强的APC,可以通过各种不同的抗原加载策略来完成疫苗的准备,如用各种多肽或蛋白刺激DC,或直接将肿瘤抗原转移至DC,通过增强T细胞间的相互作用来增强其刺激免疫系统的能力,再将这些DC运送到受感染的宿主[120-124].针对HPV的DC疫苗可以通过两种策略进行准备:一种是将DC在体外培养并用HPV抗原刺激,另一种是用HPV抗原表达载体转染体外培养的DC,这些策略已经被证明可在小鼠中产生更大的抗原特异性CD8+T细胞激活和抗肿瘤效应[123,125].然而DC疫苗也存在一定的局限性:1) 由于技术的限制,从每个患者身上收获的DC数量及质量难以保证;2) 人体细胞离体培养需要高技术、高耗材、长耗时等条件,难以进行大规模产业化生产.因此DC疫苗的有效开发仍需更全面和深入的探索.
4 总结与展望
近20年来,HPV预防性疫苗的研究取得了长足进展,除了已经上市的4种疫苗外,许多疫苗已完成Ⅰ、Ⅱ期临床试验,正在进行更深入的研究.但HPV治疗性疫苗的研究与临床应用仍尚有距离,特别是存在临床可能产生的副作用和低免疫原性、HPV病毒严格的种属特异性、难以建立动物模型评价疫苗的免疫效果以及疫苗自身安全性等问题.另外,如何选择最佳的疫苗策略,如载体的优化、高效简便的表达系统的选择、整合染色体表达菌株的构建、剂量瓶颈的理性优化、利用结构生物学等交叉学科手段开展理性并高效的新型疫苗设计、疫苗递送方式的优化、高效新型佐剂的研发、各型别在人群中流行率的变化、联合治疗等策略的探索以及临床应用疫苗条件的合理选择等,都应该是研发HPV预防性和治疗性疫苗时应考虑的内容.
目前HPV预防性疫苗已取得相当不错的进展,从2价、4价到9价疫苗.在国内,以厦门大学研究团队的HPV系列疫苗研究为例,联合厦门万泰沧海生物技术有限公司的2价疫苗(HPV16/18)[126]已于2019年底上市,9价疫苗(HPV6/11/16/18/31/33/45/52/58)于2020年9月开展Ⅲ期临床试验;2018年提出 “七防二十”的HPV 20价疫苗[127]的理性设计,被《科技日报》等媒体誉为“率先敲开第三代宫颈癌疫苗研制大门”;2020年提出的单一chVLP预防216种HPV型别[82]的疫苗设计,体现了在我国疫苗创新领域具备赶超国外同行的能力.宫颈癌在贫穷偏远、欠发达地区发病率高,肿瘤的筛检普查条件不具备,这里是最需要HPV预防性疫苗的地方;但国内现在HPV预防性疫苗的接种主要在城市发达地区,价格昂贵且一苗难求.国产大肠杆菌疫苗为解决这一问题提供了解决方案,在保证疫苗有效性和安全性的同时,提高了产量,降低了价格,也为全球范围内低等收入和中等收入国家的宫颈癌有效预防提供了可能.
目前没有一种十分有效、安全性良好的HPV治疗性疫苗得到应用.虽然美国Inovio生物制药公司已将HPV DNA免疫疗法VGX-3100推至Ⅲ期临床试验,并于2019年6月完成Ⅲ期临床试验198名志愿者招募,研究的最终目标是宫颈HSIL的消退以及宫颈中HPV16和(或)18的病毒学清除,但目前临床效果尚未可知.
总之,HPV预防性疫苗已经在WHO发布的《2030年消除宫颈癌全球战略》中发挥了重要作用.新一代的HPV疫苗设计引入基于结构的疫苗理性设计方案,并已经取得一定进展,这些案例也将为其他复杂多变的病毒疫苗研发提供借鉴.HPV治疗性疫苗主要针对HPV的致癌性进行干预,并已取得初步进展,然而在对尖锐湿疣、不典型增生及宫颈癌的治疗方面尚未见成效,因此仍需加强对HPV病毒学和感染致病机制的研究.随着对HPV研究的进一步深入,期待不久的将来预防性和治疗性疫苗能够双管齐下,为保护人类免受HPV感染及其导致的恶性疾病困扰提供终极武器.
