细胞中同时检测特定标志物蛋白和基因表达方法的建立
2021-04-15贾坤苏建荣
贾坤,苏建荣
组织切片中常采用免疫组织化学(immunohistochemistry,IHC)和荧光原位杂交(fluorescence in situ hybridization,FISH)对特定标志物的蛋白和基因水平进行检测,其对生物医学基础研究、预防临床医学的研究、军事医学的应用研究以及病理的辅助诊断等方面都具有重要意义[1-2]。免疫组织化学是指利用抗原与抗体特异性结合的原理,通过化学反应使标记在抗体上的显色物质(荧光素、酶、金属离子、同位素)显色来检测组织细胞抗原,对其进行定位、定性和定量检测的技术[1]。荧光原位杂交是依据碱基互补原理,应用荧光素直接或间接标记的核酸探针在复制切片、细胞涂片、染色体辅片上检测间期细胞核染色质数量即结构变化,进行定性和相对定量的分析检测技术[2]。采用免疫组织化学和荧光原位杂交两种方法分别在蛋白和基因水平对特定标志物的表达进行检测,从而为临床提供辅助的诊断信息。在大多数情况下两者的检测结果是一致的,即标志物基因和蛋白水平的表达存在明确的相关性[3],然而在有些情况下,由于翻译后修饰和基因表达调控等原因,特定标志物基因和蛋白表达水平不完全一致,这种情况下就需要将两种方法联合起来进行检测[4-5]。常规的做法是在两张切片中分别进行 IHC 和 FISH的检测,首先在 IHC 染色片子上确定待复核的区域;然后在 FISH 标本上低倍镜下找到相同的组织细胞结构,采用高倍镜进一步的观察。该方法受切片质量、肿瘤异质性、染色过程等的影响[4-6]。
本文建立了一种在同一张片子上同时对特定标志物进行蛋白和基因水平检测的方法,联合蛋白的 IHC 和基因的 FISH 检测方法,在同一张片子上进行同一种标志物蛋白水平和基因水平的检测,提高这两种方法的匹配度和适用性,可为临床提供更好的辅助诊断方法。
1 材料和方法
1.1 材料
1.1.1 细胞 人乳腺癌细胞系 JIMT-1 购自上海子实生物科技有限公司。
1.1.2 主要试剂及仪器 兔抗人 HER2 单克隆抗体 ab214275、兔抗人 pan-CK 单克隆抗体ab234297、兔抗人 Ki67 单克隆抗体 ab92742、Alexa Fluor 488 标记山羊抗兔荧光二抗均购自Abcam 公司;抗兔二抗 SP 试剂盒、DAB 显色液购自北京中杉金桥公司;Alexa Fluor 555 标记的HER2 基因探针购自美国雅培公司;胎牛血清、RPMI1640 培养基、 胰蛋白酶均购自美国Sigma-Aldrich 公司;细胞培养箱购自美国 Napco公司;超净工作台购自北京冠鹤净化设备有限公司;原位杂交仪 Hydridizer 购自丹麦 Dako 公司;荧光显微镜 Nikon-Ni 购自日本尼康公司。
1.2 方法
1.2.1 JIMT-1 细胞培养和细胞涂片的制备 细胞采用含有 10% 胎牛血清和 1% 双抗(青霉素和链霉素)的 RPMI1640 完全培养基进行培养,待细胞融合度 80%~90% 时,采用 1×PBS 洗涤3 次后,胰蛋白酶消化 3 min,完全培养基终止后,800 r/min 离心 5 min,弃上清,得到细胞沉淀,然后采用培养基重悬后传至 2~3 个新的培养瓶中进行培养。
1.2.2 肿瘤细胞系涂片中 HER2 免疫荧光和荧光原位杂交检测 ①预处理:培养的 JIMT-1 细胞系,消化后离心,取细胞悬液涂片在 1 cm×1 cm组化框的载玻片上,自然干燥后,采用 4% 的多聚甲醛固定 10 min;②免疫组化检测:采用免疫组化染色 SP 三步法对细胞涂片进行染色,抗原在碱性柠檬酸钠缓冲液中高温高压修复,过氧化氢去除内源性过氧化物酶的干扰,山羊血清封闭后,加入一抗 37 ℃ 孵育 1 h,后续处理采用 SP 和 DAB 显色试剂盒中提供步骤对细胞涂片进行免疫组织化学染色;③荧光原位杂交检测:将载玻片浸入 37 ℃预热的 2×SSC 中 5 min,然后依次采用预冷的75%、85%、100% 乙醇脱水,切片风干后,加入HER2 探针,盖上盖玻片后用封片剂外封,置于杂交仪中,设置变性 76 ℃ 10 min,杂交 37 ℃ 24 h;杂交后洗涤,依次采用 43 ℃ 预热的甲酰胺和含有0.1% Triton X-100 的 2×SSC 分别洗涤 2 次,每次 5 min,采用含有防淬灭剂的 DAPI 染色液进行封片;④免疫荧光检测:将固定后的载玻片浸入1×PBS 中,浸泡 5 min,采用含有 0.2% Triton X-100 的 1×PBS 透化处理 5 min,然后加入10% 的山羊血清封闭 30 min;采用 2% 的山羊血清稀释 HER2 抗体,滴加在标本区,37 ℃ 孵育1 h,采用 PBST 洗涤后加入荧光二抗染色 37 ℃30 min,PBST 洗涤后采用含有防淬灭剂的 DAPI染色液进行封片;⑤免疫荧光和荧光原位杂交联合检测:采用先进行基因的 FISH 后进行蛋白的免疫荧光检测的方法进行联合检测,具体的步骤为:先参照 FISH 的检测方法,一直到杂交后的洗片,不进行 DAPI 封片,直接进行 IF 染色中的 PBS洗片和后续处理。
1.2.3 观察 染色后的片子采用荧光显微镜观察,分别在橙色通道、绿色通道和蓝色通道下对HER2 的基因扩增、蛋白的表达和细胞核进行观察。阳性结果判定:蓝色通道下细胞核聚集并且轮廓清晰;免疫荧光检测中绿色通道下目的蛋白检测为明显的一圈或者一片,细胞定位与理论相符,背景信号无或弱;荧光原位杂交检测中橙色通道下为细胞核区域的明显点状着色,靶点信号强,背景信号无或弱;阴性结果判定为:没有细胞核着色或者细胞核散、绿色通道无着色或者不是细胞膜定位、FISH 信号不是明显的点状着色而是一片,包含有以上任意情况均认为是阴性结果。
2 结果
2.1 免疫组化和免疫荧光法检测JIMT-1 细胞中HER2 表达
采用 JIMT-1 细胞系作为检测细胞,其为HER2 高表达乳腺癌细胞系,并且 HER2 基因大多为 4 倍体。JIMT-1 细胞涂片中 HER2 蛋白检测分别参照上述免疫组化和免疫荧光检测方法,二抗分别采用 Alexa Fluor 488 标记山羊抗兔荧光二抗和 HRP 标记的山羊抗兔酶标二抗。结果如图1所示:分别采用荧光二抗和酶标二抗均可以在JIMT-1 细胞中检测到 HER2 蛋白的细胞膜定位,两者在结果判读上没有明显差异。
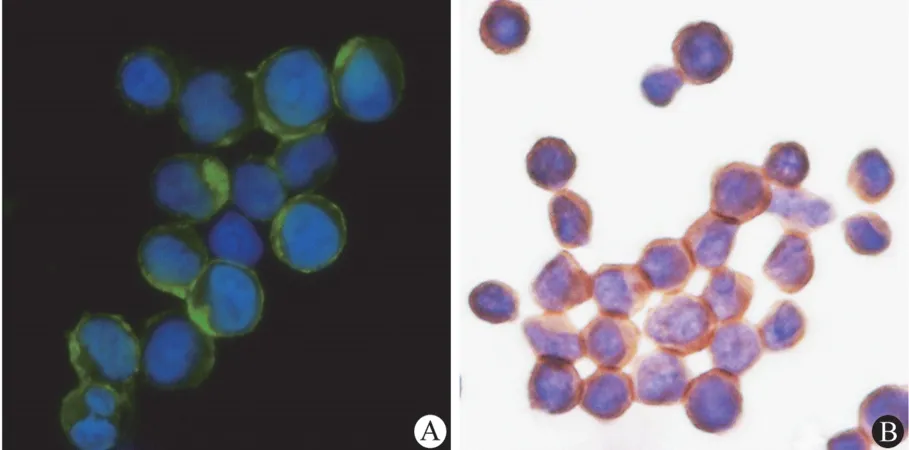
图1 JIMT-1 细胞中 HER2 蛋白表达检测(400 ×;A:免疫荧光染色;B:免疫组织化学染色)Figure 1 Detection of HER2 expression in JIMT-1 cell(400 ×; A:Immunofluorescence stain; B:Immunohistochemical stain)
2.2 免疫荧光和荧光原位杂交联合检测
由于免疫荧光和免疫组化对蛋白标志物的检测原理是相同的,并且两者在细胞定位和结果判读上没有明显差异,而特定标志物基因水平的检测一般采用的是荧光原位杂交,为将两者结合起来,采用免疫荧光作为特定标志物蛋白表达水平的检测方法,建立同时检测标志物蛋白和基因水平的方法。JIMT-1 细胞涂片分别采用上述方法进行HER2 蛋白的免疫荧光检测和 HER2 基因的荧光原位杂交检测以及两者的联合检测。结果如图2所示,JIMT-1 细胞中 HER2 蛋白围绕细胞的一圈,HER2 基因检测为细胞核内的多个信号点;HER2 蛋白和基因联合检测中,可在同一细胞,不同通道下分别检测到 HER2 蛋白和基因的表达情况,并且与单纯的免疫荧光检测 HER2 蛋白和荧光原位杂交检测 HER2 基因结果相同,不影响HER2 蛋白表达水平和细胞定位以及基因拷贝数的判读。两种方法的联合检测结果与单纯的蛋白和基因检测结果相比,HER2 蛋白的定位和荧光强度均不受影响。
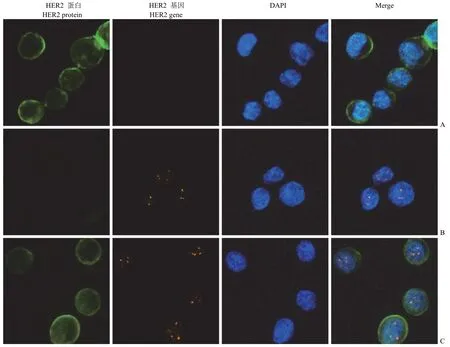
图2 JIMT-1 细胞中 HER2 蛋白和基因检测(400 ×;A:HER2 蛋白的 IF 检测;B:HER2 基因的 FISH 检测;C:IF 和FISH 联合检测)Figure 2 HER2 protein and gene detection of JTMT-1 cell (400 ×; A:IF stain of HER2 protein expression; B:FISH of HER2 gene expression; C:IF-FISH combined detection)
2.3 不同亚细胞定位靶标的蛋白和基因联合检测
分别对不同细胞亚定位的靶标进行蛋白和基因水平的联合检测,选取不同细胞定位的 HER2、pan-CK 和 Ki67,分别与 HER2 基因联合检测。结果如图3 所示,HER2 为细胞膜定位,在细胞中为围绕细胞的圈状着色;pan-CK 为细胞浆定位,在细胞中为胞浆的片状着色;Ki67 为细胞核定位,在细胞中为与细胞核重合的片状着色。采用该方法可以在 JIMT-1 细胞中对不同定位的蛋白和 HER2基因进行联合检测。
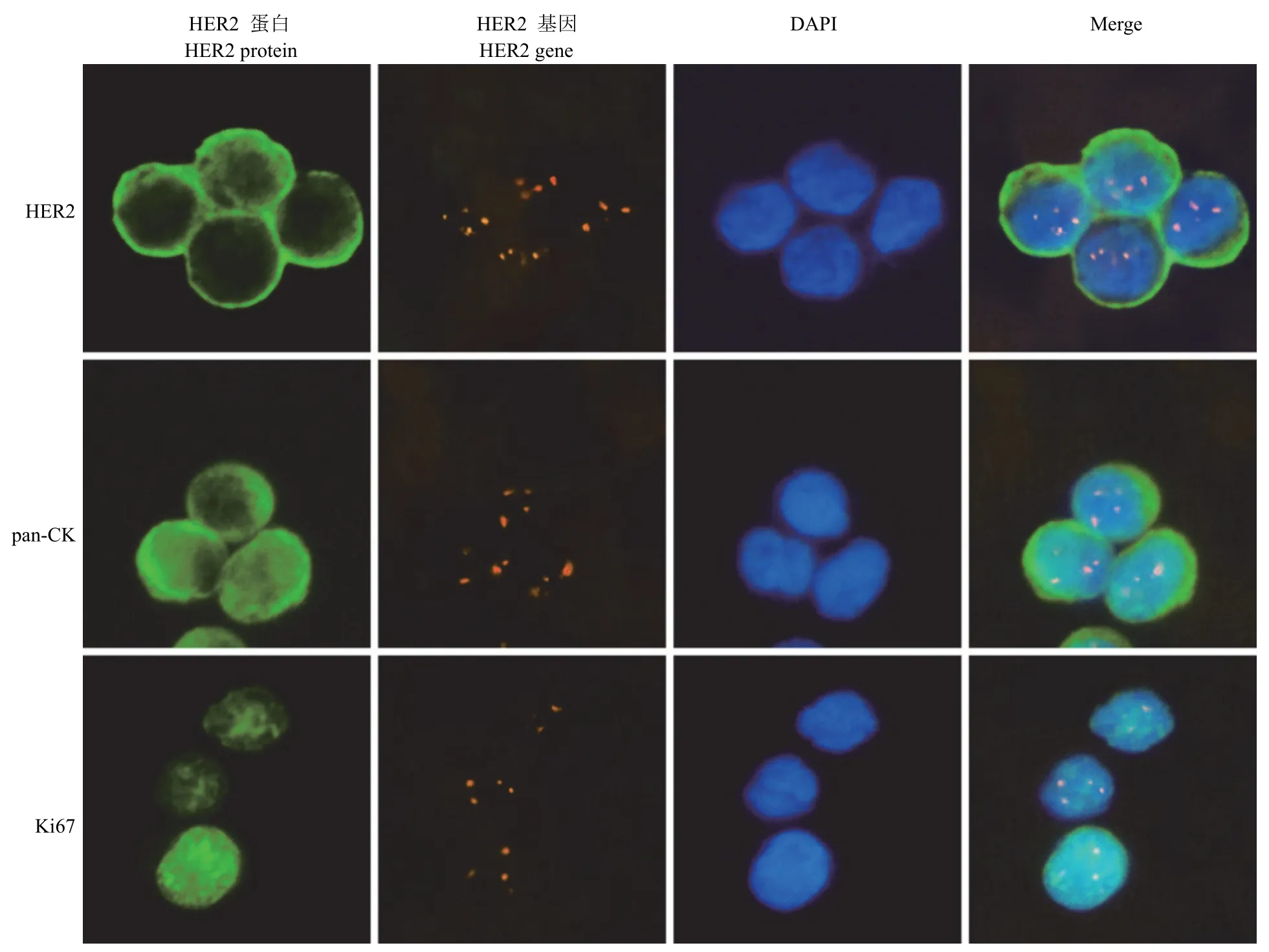
图3 细胞涂片中不同定位蛋白和 HER2 基因联合检测(400 ×)Figure 3 IF-FISH combined detection of different location protein in (400 ×)
3 讨论
免疫组织化学是指将显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应,对相应抗原进行定性、定位、定量测定的一项新技术,其在病理诊断中具有重要的临床意义,尤其是肿瘤的辅助诊断、标志物筛选和指导用药等方面[7-8]。荧光原位杂交主要用于病理的辅助诊断和鉴别诊断、疾病预后评估和指导临床靶向治疗等,是近十年来临床病理检测中运用最为广泛的一种分子遗传学诊断技术[2]。两者的应用领域和检测方法有很高的重复性,并且目前的一些诊疗指南中已将两者的应用联合起来。例如乳腺癌病理检测中 IHC 和 FISH 检测HER2 蛋白和基因的表达状态一致性很高,但也存在着差异,在不同研究中发现切片中进行 HER2蛋白和基因的检测,其符合性差异较大,尤其对IHC 结果为 ++ 的情况下,其大约有一半是 FISH阴性[9],《2014年NCCN 乳腺癌临床实践指南》和《乳腺癌 HER2 检测指南(2014 版)》均建议先进行 HER2 蛋白的 IHC 检测,HER2++ 样本进行 FISH 的检测。
免疫组织化学染色中通过显色底物的不同,可以将目的蛋白显示为不同的颜色[10]。文中比对了采用荧光二抗和酶标二抗对 HER2 蛋白进行检测。两者均可检测到 HER2 的细胞膜定位,没有明显差异,同时比对其他的研究,可以看出两种方法分别用于检测目的蛋白的表达没有明显差异[11]。由于显色原理的差异,染色后两者片子的读片情况和保存条件不同。IF 染色后显色为荧光信号,因此荧光信号随着观察的次数和曝光时间的长短而逐渐淬灭,添加防淬灭剂,可以在一定程度上减少荧光的淬灭,另外采用量子点等新型荧光基团作为标记荧光有更好的效果,总的来说,IF 染色后的片子应尽快读片并将其保存在避光、低温的环境中。酶标二抗显色的原理为 DAB 催化底物后,特定位置色素的沉积,其在封片后会一直保存在原来的位置,显微镜的观察不会对其产生影响,因此 IHC 染色的片子可以进行长期的观察,并且对其染色后片子的保存没有特定要求。关于结果的定性和半定量研究,与免疫组化相比,免疫荧光同样可以采用荧光强度值来显示蛋白的表达量[12]。同时 FISH 检测中多数为荧光素标记的探针识别目的基因特定片段,显色后在荧光显微镜下观察。同一细胞特定标志物不同表达层面的研究,对于基础研究和临床诊断都具有重要的意义,尤其在乳腺癌 HER2 的临床诊疗过程中。目前已有相关研究在 mRNA 水平研究中采用 FISH 和 IF 结合的方法来对标志物的表达进行检测[13],但是分别用于检测基因和蛋白表达水平的未见报道。本研究中优化 IF 和 FISH 检测方法,将蛋白和基因水平表达研究方法结合起来,采用HER2 蛋白高表达细胞系 JIMT-1,作为研究对象[14],选用荧光素标记的二抗作为显色底物进行特定标志物蛋白水平的检测,同时结合不同波长荧光素标记的基因探针,进行特定标志物基因水平的检测,可以达到同一细胞中特定标志物蛋白和基因水平两个层面的检测,排除了切片厚度、肿瘤异质性、染色差异等对特定标志物表达情况判读的影响。组织病理检测与细胞系涂片相比,前者需要的额外操作是组织切片的脱蜡和抗原的修复,而这些步骤的操作并不会影响细胞中 HER2 蛋白和基因的表达,同时不会影响方法中 IF 和 FISH 联合检测和结果的判读,只需要在前处理操作过程中添加相应步骤,因此本方法在组织病理上应用的可行性很高。
本文介绍的方法适用于细胞中所有标志物的检测,同时 FISH 检测中,同样可以对其他的基因探针和染色体探针进行检测,不局限于 HER2 基因。值得注意的是,采用该方法还可以对多个标志物同时检测,例如分别采用不同波长荧光素(647~700 nm 附近的近红外、594 nm 附近的红色、555 nm附近的橙色、488 nm 附近的绿色、360 nm 附近的蓝色等)标记的不同蛋白标志物或者基因[15],通过调整荧光素的选择和显微镜不同通道的波长选择,可以对多个标志物的蛋白和基因水平进行检测。
本文提供了一种用于细胞和组织中同时进行IF 和 FISH 的检测方法,以达到在同一细胞中对蛋白和基因水平的同时检测。该方法在组织中的应用和结果的判读方面还需要更多的研究,进一步完善该方法并将其真正应用到临床辅助诊断中,有希望减少临床的工作量同时提高结果的准确性,为临床诊断提供一种更方便、可靠的检测方法。
