P21蛋白表达与正常宫颈组织癌变关系的meta分析
2021-04-15沐超熊敏涵袁炜李丽红王婷胡新荣
沐超,熊敏涵,袁炜,李丽红,王婷,胡新荣
宫颈癌是起源于子宫颈上皮的恶性肿瘤。据2018年全球癌症统计,宫颈癌的发病率和死亡率排在女性恶性肿瘤的第四位,在发展指数较低的地区,宫颈癌的发病率和死亡率仅次于第一位的乳腺癌。人类乳头瘤病毒(HPV)的感染是宫颈癌的高危因素,其他危险因素还包括 HIV 感染、吸烟、怀孕次数和使用口服避孕药等[1]。P21waf1 蛋白(P21 蛋白)是抑癌基因 p21WAF1/CIP1的表达产物,属于细胞周期依赖激酶抑制因子。当细胞受到损伤后,P21 蛋白能够与细胞周期蛋白复合物相结合,致使其丧失活性,从而使细胞周期停滞在 G1 期,让受损的细胞有充分的时间修复,参与了细胞生长、发育、分化、衰老以及损伤修复等多种功能的调节[2-3]。已有研究显示P21 蛋白的异常表达可能与宫颈癌、宫颈上皮内瘤变(CIN)的发生发展有关[4]。
目前,有多项研究报道了 P21 蛋白在宫颈癌及 CIN 中的表达情况,但尚未见其在宫颈癌变中差异表达的系统评价。我们通过检索和筛选相关文献,系统评价了正常宫颈组织、CIN 和宫颈癌中P21 蛋白表达的阳性率,进而阐明 P21 蛋白表达与宫颈癌变的关系,为检测细胞周期紊乱、评估宫颈癌的恶性行为和预后提供分子标记及循证依据。
1 资料与方法
1.1 检索策略
检索数据库 Pubmed、Web of Science、Medline、CBMdisc、CNKI、维普中文期刊、万方数据,检索时间自建库至 2020年5月,中文检索关键词包括:P21waf1、宫颈癌、宫颈肿瘤。英文检索关键词包括:P21waf1、Cervical Neoplasms、Cervical Carcinoma。
1.2 纳入和排除标准
1.2.1 P21 蛋白检测方法 采用免疫组织化学法进行检测。
1.2.2 研究类型 P21 蛋白在宫颈病变组织中表达差异的病例-对照研究,对应文献已见刊并具有相应资料。文种限中文和英文。
1.2.3 研究对象:①所有病例经病理诊断明确;②全部受试者取材前都未经放化疗;③研究方法相似;④全部受试者不界定民族、种族、国籍等。
1.2.4 排除标准:①重复文献;②无相应对照组,数据提供不全;③非免疫组织化学法、非正常宫颈组织作为对照;④综述、动物研究、会议摘要及病例系列报道等。
1.2.5 文献筛选与资料提取 文献筛选和资料提取分别由两位研究人员独立进行,涉及不一致的地方,通过协商或第三方裁定。提取信息包括:题目、作者姓名、发表年限、纳入病例的年龄范围、病例总数、宫颈病变中 P21 蛋白表达阳性数等。
1.3 统计学处理
运用 Revman5.3 软件对所有纳入的研究进行分析。通过查找相关资料,选择比值比(odds ratio,OR)作为合并效应量,95% 为其可信区间(95%CI)。首先,对纳入的原始数据进行异质性检验(检验水准为 α = 0.05),采用森林图和I2统计量来判断研究间的异质性。根据《Cochrane 系统评价手册》,I2> 50% 则认为研究间存在异质性。对于存在异质性的结果,利用漏斗图进行发表偏倚的判断。最后,进行敏感性分析,如果敏感性分析前后结果没有本质上改变,则说明结果稳定且较为可信;如果敏感性分析得到的结果不同,则在排除异常的研究后重新分析,并探讨该研究影响合并效应的原因。
2 结果
2.1 文献检索结果
通过数据库检索,初步得到 497 篇文献,其中 Pubmed 227 篇、Web of Science 97 篇、Medline 56 篇、CBMdisc 32 篇、CNKI 26 篇、维普 24 篇、万方 35 篇,按照标准严格筛选后,总共纳入文献14 篇[5-18],共 1588 例受试者,包括正常宫颈组织269 例、CIN 390 例,宫颈癌 929 例。文献筛选流程见图1。

图1 文献筛选流程Figure 1 Literature screening process
2.2 纳入研究的基本特征和方法学质量评价
14 份研究报道了正常宫颈组织和宫颈癌中P21 蛋白表达的情况;8 份研究[6,8-10,12-13,17-18]报道了 CIN 中 P21 蛋白表达的情况。纳入研究的基本特征和方法学质量评价分别见表1 和表2。

表1 纳入研究的基本特征Table 1 Basic features of the included studies
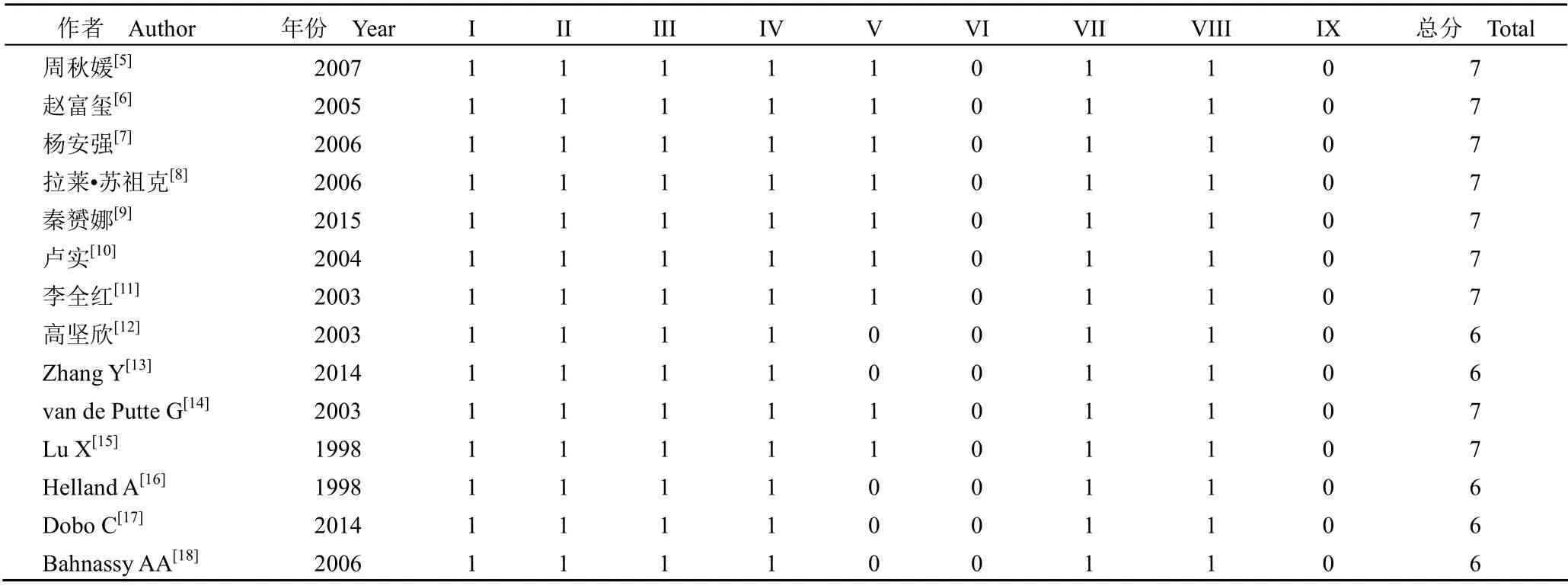
表2 纳入研究的方法学质量评价(纽卡斯尔-渥太华量表)Table 2 Methodological quality evaluation of included studies (Newcastle-Ottawa Scale)
2.3 Meta 分析结果
2.3.1 宫颈癌组与正常宫颈组共 14 个研究报道了宫颈癌组(929 例)与正常宫颈组(269 例)中 P21 蛋白的表达情况。森林图显示:I2= 86%,P< 0.00001,各项研究间存在异质性,采用随机效应模型;OR = 9.51,95%CI(2.82,32.11),P= 0.0003,可知宫颈癌组与正常宫颈组 P21 蛋白表达差异有统计学意义(图2)。

图2 宫颈癌组与正常宫颈组 P21 蛋白表达的比较Figure 2 Comparison of P21 protein expression between cervical cancer group and normal cervical group
2.3.2 宫颈癌组与 CIN 组共 8 个研究报道了宫颈癌组(404 例)与 CIN 组(390 例)中 P21 蛋白的表达情况。森林图显示:I2= 79%,P< 0.0001,各项研究间存在异质性,采用随机效应模型;OR =1.18,95%CI(0.54,2.55),P= 0.68,可知宫颈癌组与 CIN 组 P21 蛋白表达差异无统计学意义(图3)。

图3 宫颈癌组与 CIN 组 P21 蛋白表达的比较Figure 3 Comparison of P21 protein expression between cervical cancer group and CIN group
2.3.3 CIN 组与正常宫颈组 共 8 个研究报道了 CIN 组(390 例)与正常宫颈组(150 例)中 P21蛋白的表达情况。森林图显示:I2= 72%,P=0.0008,各项研究间存在异质性,采用随机效应模型;OR = 3.25,95%CI(0.97,10.87),P= 0.06,可知 CIN 组与正常宫颈组 P21 蛋白表达差异无统计学意义(图4)。
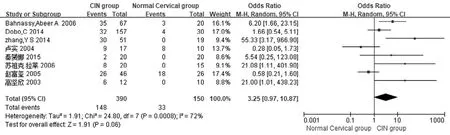
图4 CIN 组与正常宫颈组 P21 蛋白表达的比较Figure 4 Comparison of P21 protein expression between CIN group and normal cervical group
2.3.4 发表偏倚的识别 分别对宫颈癌组与正常宫颈组、宫颈癌组与 CIN 组、CIN 组与正常宫颈组进行漏斗图绘制,结果见图5A、B、C。由图知,三个比较组的漏斗图对称性欠佳,提示可能存在发表偏倚。
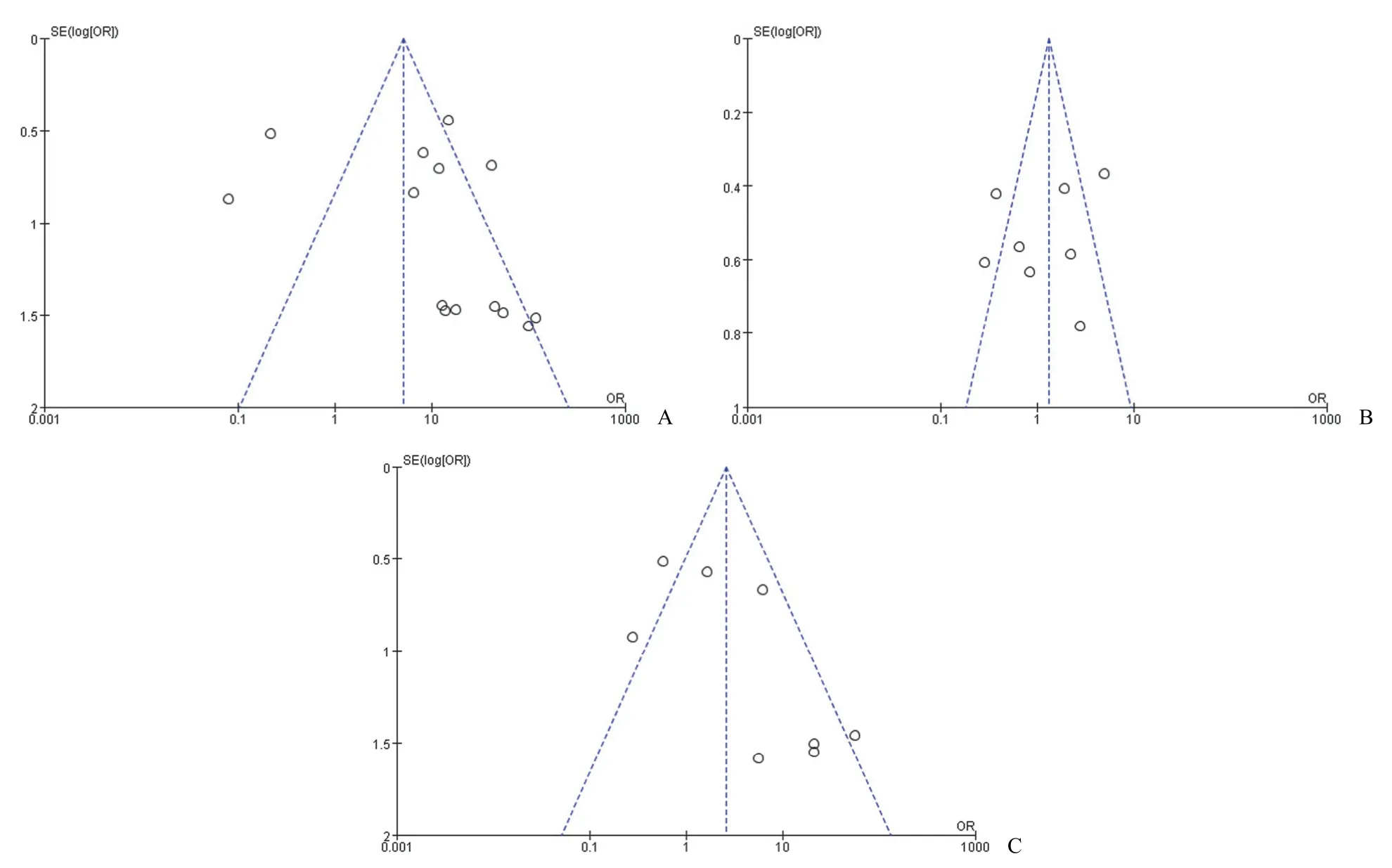
图5 漏斗图(A:宫颈癌组与正常宫颈组;B:宫颈癌组与 CIN 组;C:CIN 组与正常宫颈组)Figure 5 Funnel plot (A:Cervical cancer group versus normal cervical group; B:Cervical cancer group versus CIN group; C:CIN group versus normal cervical group)
2.3.5 敏感性分析 以 OR 为效应尺度指标,用“去除单项研究法”考察单项研究对总合并效应量的影响,发现当去除文献[6]和[10]两项研究后,重新进行分析,结果分别为:①宫颈癌组与正常宫颈组I2= 0%,P= 0.64,达到同质,符合固定效应模型条件,可知 P21 蛋白表达阳性率,宫颈癌组大于正常宫颈组[OR = 17.75,95%CI(10.87,28.99)],差异有统计学意义(P< 0.00001)(图6A)。②宫颈癌组与 CIN 组I2= 59%,P= 0.03,仍存在异质性,采用随机效应模型,可知 P21 蛋白表达阳性率,宫颈癌组与 CIN 组的差异无统计学意义[OR = 1.88,95%CI(0.97,3.62),P= 0.06](图6B)。③CIN 组和正常宫颈组I2= 43%,P= 0.12,异质性降低,符合固定效应模型条件,可知 P21 蛋白表达阳性率,CIN 组大于正常宫颈组[OR = 6.10,95%CI(3.03,12.32)],差异有统计学意义(P<0.00001)(图6C)。其余各个评价指标行敏感性分析,结果均一致。
3 讨论
宫颈癌是妇科常见的恶性肿瘤,严重威胁着女性的健康。目前宫颈癌的治疗包括手术切除、放化疗以及靶向治疗[19],为了提高宫颈癌患者无进展生存率,提高患者的生活质量,降低治疗毒副作用,在探讨宫颈癌最佳治疗方案的同时也需要探究能够评估宫颈癌恶性行为和预后的相关分子。p21WAF1/CIP1基因表达的 P21waf1 蛋白,定位于细胞核,是 P53 途径重要的下游蛋白[20]。作为细胞周期的负性调控因子,生理情况下,P21 蛋白参与了细胞生长、衰老以及受损后修复等过程。虽然P21 蛋白承担着抑癌的角色,但是在许多研究中发现,它在肿瘤中的表达是上调的,其通过作用于G1/S 检测点,参与了肿瘤的发生发展。P21 蛋白升高的原因可能是 P21 蛋白的表达被 p53 非依赖的通路诱导[21-22],或者肿瘤已变成 p21WAF1/CIP1介导的抑制信号细胞,逃避了衰老(终末分化)和生长停滞[3]。因此,它可以作为检测细胞周期紊乱、估计肿瘤恶性行为和预后的分子标记。
本次系统评价显示:当剔除文献[6]和[10]两项研究结果后,三个组的异质性都出现了下降,通过对比前后森林图和漏斗图,可知这两项研究出现了发表偏倚,对合并效应产生了较大的影响,同时也是异质性的来源,其原因可能与他们所报道的正常宫颈组织中 P21 蛋白表达阳性率高有关。在重新进行分析后,最后结果显示:与正常宫颈组织相比,P21 蛋白在宫颈癌组以及 CIN 组中均表达上调,与多数学者报道的研究[5,7-9,11-18]结果一致,提示 P21 蛋白异常高表达增加了正常宫颈上皮癌变的风险;然而在以往的研究中,也有学者报道 P21蛋白在宫颈癌中表达是降低的。例如,苗立业等[23]认为 P21 蛋白在 CIN 和宫颈癌中表达阳性率逐渐减低,表达强度与病变级别呈负相关,究其原因可能与组蛋白去乙酰化酶 1(HDAC1)的作用有关。另外,在动物试验中,Shin 等[24]发现与 p21(+/+)小鼠相比,p21(-/-) 小鼠宫颈病变更明显,原因可能与外源性雌激素的使用有关。本次分析结果在较大数据层面上支持了 P21 蛋白在宫颈癌组大于正常宫颈组、CIN 组大于正常宫颈组,且两组差异均有统计学意义。但是,宫颈癌组与 CIN 组比较的结果显示 P21 蛋白表达差异无统计学意义,可能与样本量较少有关,有待于更多的样本量来明确宫颈癌P21 蛋白的表达水平是否高于 CIN。综上所述,P21waf1 蛋白表达上调会促进正常宫颈组织癌变,检测 P21waf1 蛋白的表达有助于评估宫颈癌的恶性行为和预后。

图6 敏感性分析(A:宫颈癌组与正常宫颈组;B:宫颈癌组与 CIN 组;C:CIN 组与正常宫颈组)Figure 6 Sensitivity analysis (A:Cervical cancer group versus normal cervical group; B:Cervical cancer group versus CIN group;C:CIN group versus normal cervical group)
本次分析不排除有一定的局限性:①收集了公开发表的中、英文文献,但 CIN 组样本量仍较少;②国内、国外各个研究中的组织标本处理方法、免疫组化判定主观性等可能会对原始数据的一致性产生影响。
