体外模拟消化芝麻蛋白产生抗氧化肽的分离纯化与构效研究
2021-04-15高锦鸿张丽霞宋国辉黄纪念
芦 鑫 贾 聪 高锦鸿 张丽霞 孙 强 宋国辉 黄纪念
(1河南省农业科学院农副产品加工研究中心,河南 郑州 450002;2河南省农产品生物活性物质工程技术研究中心,河南 郑州 450002)
芝麻(Sesamum indicumL.)是重要的油料作物之一,2016年全球芝麻产量为611 万t。我国是芝麻的生产与消费大国,芝麻年产量在60 万t 左右,年消费量在100 万t 以上[1]。芝麻蛋白是芝麻的重要组分之一,约占芝麻质量的20%[2]。芝麻蛋白营养价值较高,且有较好的功能特性,具有开发利用的潜在价值[3-4]。
天然抗氧化肽能清除自由基,降低自氧化速率,减弱氧化应激对肌体的损伤,对维护健康具有积极意义[5],已经成为研究与应用的热点。目前,国内外研究人员已从不同来源的蛋白质中制备出多种具有抗氧化活性的肽类物质[6]。研究表明,芝麻蛋白经酶解可以产生抗氧化肽[7-9]。然而,采用外源蛋白酶(碱性蛋白酶为主)酶解芝麻蛋白制备的抗氧化肽,与人体内源蛋白酶(胃蛋白酶、胰蛋白酶、胰糜蛋白酶)在酶解位点上有明显差别,故形成的多肽有显著差异。此外,外源蛋白酶酶解形成的抗氧化肽进入人体消化系统后,可能被继续水解,破坏结构,进而影响其活性。因此,有必要对芝麻蛋白在体内消化过程中产生抗氧化肽的情况进行深入研究。
体外模拟消化具有操作简单、节省费用、无个体差异等优点,是研究食源蛋白消化形成功能肽的常用方法[5,10-11]。本研究以体外模拟消化芝麻蛋白的水解液为原料,以抗氧化活性为评价指标,采用超滤、制备液相色谱对水解液中抗氧化肽进行分离纯化,采用液质联用仪鉴定结构,合成相应多肽以验证抗氧化活性,最后对抗氧化活性最高的多肽进行构效分析与安全性预测,以揭示芝麻蛋白在体内消化过程中产生抗氧化肽的规律、抗氧化肽组成与构效关系,深化芝麻抗氧化肽的研究。
1 材料与方法
1.1 材料与试剂
白芝麻,驻马店平舆康博汇鑫油脂有限公司。胰蛋白酶(酶活1∶250)、糜蛋白酶(酶活1∶250)、胃蛋白酶(酶活≥250 U·mg-1),北京索莱宝科技有限公司;考马斯亮蓝G-250、1,1-二苯基-2-三硝基苯肼自由基[2,2-Di(4-tert-octylphenyl)-1-picrylhydrazyl,DPPH ]、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2′-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS]、2,4,6-三吡啶基三嗪[2,4,6-Tris(2-pyridyl)-s-triazine,TPTZ]自由基,美国Sigma-Aldrich 公司;平膜RO4、NFM、UE003、UE005、UE008、UE010,中科瑞阳膜技术有限公司;氢氧化钠、盐酸等,国药集团化学试剂有限公司。
1.2 仪器与设备
LC-500 型制备液相,杭州旭昱有限公司;Testcell C-70 平膜装置,日本东电集团;TGL20M-Ⅱ高速冷冻离心机,湖南凯达科学仪器有限公司;Infinite M 酶标仪,瑞士Tecan 集团有限公司;UV-6300 双光束型紫外可见分光光度计,上海美谱达仪器有限公司;XS205 电子天平,梅特勒-托利多仪器有限公司。
1.3 试验方法
1.3.1 芝麻蛋白制备 取1 000 g 芝麻,按照固液比1∶6 (w∶v)加入1 mol·L-1NaOH 溶液,剧烈搅拌10 min后,搓芝麻,漂洗去除芝麻皮后,将去皮芝麻于60℃干燥,粉碎,过80 目筛,备用。采用索氏抽提脱脂后,采用袁东振等[12]的方法提取芝麻蛋白,芝麻蛋白浓度为92.26%±0.21%。
1.3.2 模拟体内消化 参照文献[11,13],并稍作修改。取芝麻蛋白加入蒸馏水制成8%(w∶v)芝麻蛋白溶液,90℃加热30 min,随后降至37.7℃,用3 mol·L-1HCl 调节pH 值至1.5,加入0.32%(w∶v)的胃蛋白酶水解4 h,随后加入3 mol·L-1NaOH 调节pH 值至8.3,加入0.32%(w∶v)胰糜蛋白酶(胰蛋白酶与糜蛋白酶酶活比为10∶3[14-15])水解6 h。沸水浴10 min 终止反应后,冷却至室温,中和至pH 值7.0,4℃条件下8 000 r·min-1离心30 min,取芝麻蛋白水解物上清液(sesame protein supernatant,SPS)备用。
1.3.3 酶解液纳滤脱盐与超滤分离 采用前人条件用配置NFM 纳滤膜的Testcell C-70 平膜装置对SPS进行纳滤脱盐[9]。脱盐后芝麻蛋白酶解液(sesame protein supernatant by nanofiltration,SPSN),依次通过UE030(截留分子量30 kDa)、UE020(截留分子量20 kDa)、UE010 (截留分子量10 kDa)、UE005(截留分子量5 kDa)、UE003(截留分子量3 kDa)进行超滤,超滤条件:温度25℃,压力3 MPa,转速400 r·min-1,分成7个组分(<3 kDa,3~5 kDa,5~10 kDa,10~20 kDa,20~30 kDa >30 kDa SPSN),分别测定各组分DPPH 和ABTS 的半抑制浓度(50% inhibiting concentration,IC50)。
1.3.4 制备液相分离酶解液 将活性最高的超滤组分,首先采用反渗透膜RO4浓缩至5 mg·mL-1,随后用0.25 μm 针头过滤器过滤,备用。制备液相条件:色谱柱Ultimate AQ-C18 (250 mm×20 mm,5 μm),55%(v∶v)甲醇溶液[含0.1% (v∶v) 三氟乙酸],流速8 mL·min-1,上样量4 mL,检测波长220 nm,30 s/管收集流动相,分别测定各色谱峰DPPH 和ABTS 的IC50[8]。
1.3.5 液质联用分析芝麻抗氧化肽序列 将高活性色谱峰组分采用氮吹仪45℃吹干,送至苏州普泰公司,通过Nano liquid chromatography-electrospray ionizationtandem mass spectrometry (Nano-LC-ESI-MS/MS)分析多肽组成,色谱系统为安捷伦1100 高效液相系统,ESIMS/MS 为Thermo LTQ 离子阱质谱仪,其中高效液相的流动相A 为2%(v∶v)乙腈水溶液(含0.5%甲酸),流动相B 为90%(v∶v)乙腈水溶液(含0.5%甲酸)。测定时,流动相B 从初始组成的2%在60 min 内增加至90%,维持40 min。质谱数据采用ProtTech’s ProtQuest(Norristown,PA,USA) 软件分析[9]。
1.3.6 多肽合成 将下述多肽序列GLQVISPPLQR、AFPAGAAHW、SLPNYHPSPR、PAGAAHW、GHIITVAR、QGDIVAIPSGAAHW、AEEAF、ISGAQPSL、HLFLSGVACFG、FPAGAAHW、IQAEGGVSEF、NKLPILK、VAVSINDVNHL、GTVVIIPAGHPF、QGDIVAIPSGAAH、INTLL、SQTLPIL、GLPADVIANAY、HEEGGIWPF、ASQDEGLEW 进行固态合成(上海吉尔生物公司合成),纯度为95%。分别加入蒸馏水配成溶液,测定DPPH 和ABTS 的IC50。
1.3.7 3 D-QSAR 建模 为揭示HLFLSGVACFG 的活性中心与构效关系,将该多肽分成三个区域:N 端、中段、C 端,分别合成HLFL、SGV、ACFG,比较抗氧化活性,以初步确定活性中心位置。随后在控制肽链长度的前提下,考察N 末端、C 末端氨基酸残基类型及其他区域的芳香族氨基酸影响,合成ELFLSGVACFA、HLFLSGVACFR、HLFLSGVAMFG、HLYLSGVACGG、HWFLSGVACFG、GLFLSGACFG、HLFLSGVACFE,测定其DPPH 和ABTS 的IC50,计算-lg(DPPH 的IC50)、-lg(ABTS 的IC50)。多肽通过SYBYL-X 构建3DQSAR 模型[16],多肽的原子电荷采用MMFF94 计算,在MMFF94 力场利用Powell 共轭梯度算法对多肽能量优化(最大计算次数为10 000,能量优化终止标准为0.000 5 kcal·mol-1Å)[8,17]。以活性最高的HLFLSGVACFE 为模板,SGV 为骨架,构建CoMFA 模型,分子叠加图见图1。采用留一法进行交互验证,以模型的交叉验证系数(Q2)和预测误差标准偏差(R2)作为评价模型成立的指标[17-18]。
1.3.8 多肽的致敏性与毒性预测 多肽HLFLSGVACFG 的致敏性预测采用AlgPred (https:/ /webs.iiitd.edu.in/raghava/algpred/sub-mission.html),预测方法基于氨基酸组成的SVM 模型;毒性预测采用ToxinPred (https:/ /webs.iiitd.edu.in/raghava/toxinpred/design.php),预测方法基于Swiss-Prot[19]。
1.3.9 DPPH 自由基清除能力测定 参照Lu 等[8]的方法,测定酶解液或多肽溶液的DPPH 自由基清除率,采用IBM SPSS 25 的probit 回归计算IC50,即DPPH 清除率达到50%时对应的浓度。
1.3.10 ABTS 自由基清除能力测定 参照Lu 等[8]的方法,测定酶解液或多肽溶液的ABTS 自由基清除率,采用IBM SPSS 25 的probit 回归计算IC50,即ABTS清除率达到50%时对应的浓度。
1.4 数据处理
采用IBM SPSS 25 进行单因素方差分析(Duncan算法),显著水平为0.05,极显著水平为0.01。
2 结果与分析
2.1 超滤分离芝麻蛋白水解液
由表1可知,芝麻多肽的抗氧化活性随着分子量减少而增强,SPSN-Ⅰ(分子量<3 kDa)呈现最强的抗氧化活性。这与前人研究结果基本一致[20-21],推测是短肽体积小,结构简单,空间位阻小,活性基团较暴露,有利于与自由基发生反应,从而显示较强的抗氧化活性[21]。
与芦鑫等[9]的结果相比,本研究获得芝麻蛋白水解液呈现的抗氧化性较强,一方面可能是研究采用的蛋白酶种类不同,因此形成的多肽组成有差异,造成活性上也有差别;另一方面,芦鑫等[9]的水解芝麻蛋白采用的是单酶酶解,即胰蛋白酶水解(水解位点为Arg 和Lys),而本研究采用胃蛋白酶(水解位点主要在Phe、Tyr、Trp和Leu)、胰蛋白酶、胰糜蛋白酶(可作用于Trp、Tyr、Phe、Leu、Met、His)3 种酶水解芝麻蛋白,且芝麻蛋白在水解前,还进行了热变性处理,有助于芝麻蛋白分子伸展,酶切位点暴露,更利于酶解。因此,本研究中芝麻蛋白水解更彻底,形成的肽段更短,从而呈现更强的抗氧化性。
2.2 制备液相分离芝麻蛋白水解液
由图2可知,对高活性的超滤组分SPSN-Ⅰ进行制备液相分离,共发现14 个色谱峰,其中P2 和P6 组分是主要色谱峰,其余色谱峰相对峰面积较小。分析不同色谱峰组分的抗氧化活性发现,色谱峰P6 和P8组分有最高的抗氧化活性(表2)。考虑色谱峰P8 组分所占比例小,开发利用价值不高,故对色谱峰P6 进行后续纯化鉴定。
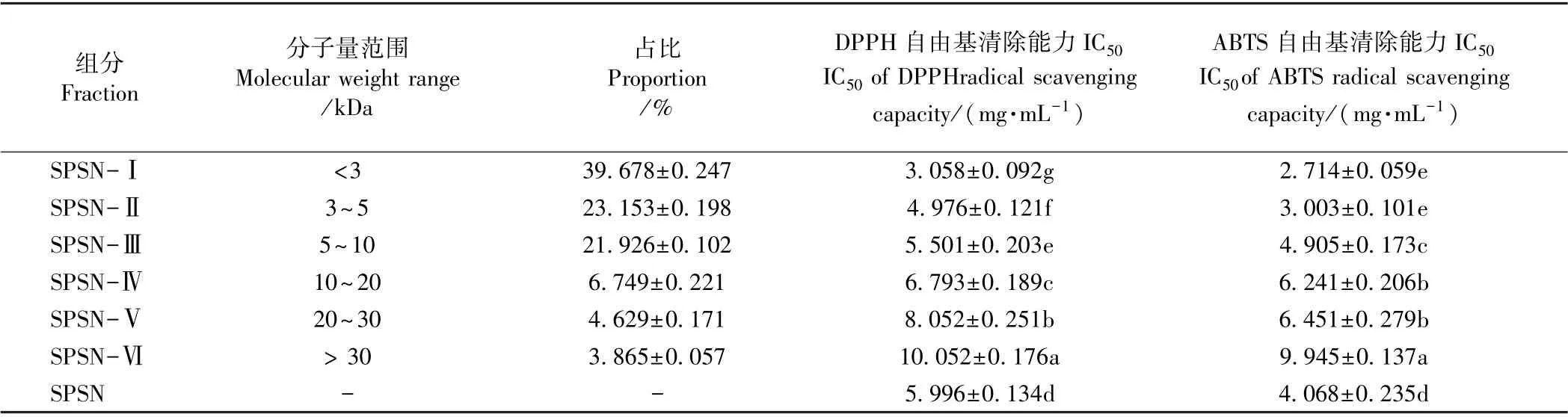
表1 超滤分离体外模拟消化芝麻蛋白水解液的组成与抗氧化性Table 1 Ultrafiltration fractions separated from in vitro digestion hydrolysis of sesame protein and their antioxidant capacity
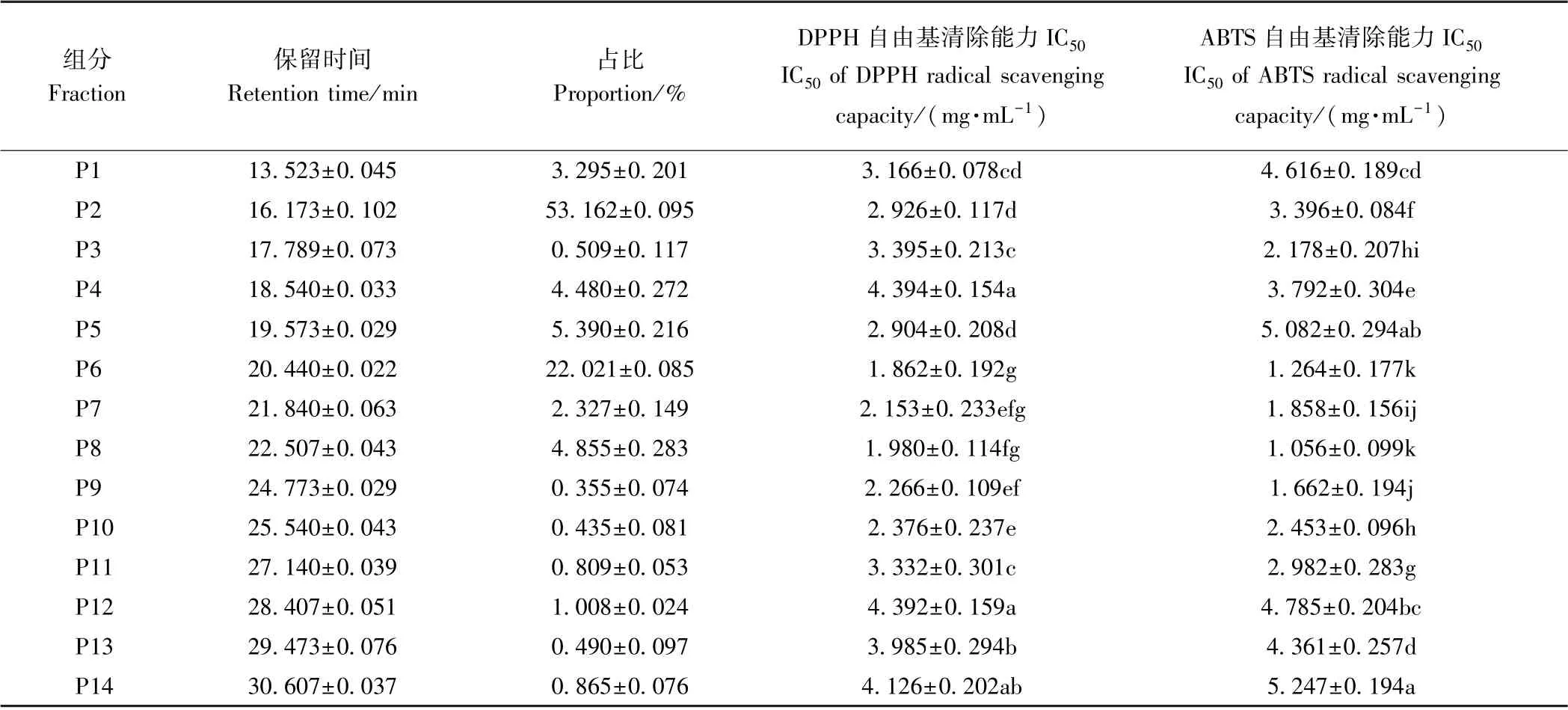
表2 制备液相分离SPSN-Ⅰ的组成及抗氧化活性Table 2 Fractions separated from SPSN-Ⅰby preparative HPLC and their antioxidant capacity
2.3 液质联用鉴定芝麻抗氧化肽
采用Nano-LC-ESI-MS/MS 对SPSN-Ⅰ-P6 中的多肽组分进行结构鉴定,其总离子流图见图3,色谱主要出峰时间集中在25~55 min,对应的流动相中乙腈浓度为34.26%~66.53%,表明SPSN-Ⅰ-P6 中芝麻多肽呈现非极性,推测多肽中含有一定量疏水性氨基酸。
从m/z 300.26~1 878.62 中,选取峰面积前20 的碎片进行二级质谱分析,共鉴定出20 条多肽(表3)。上述20 条多肽理论分子量范围为565.2~1 420.7 Da,其中5 肽有2 条,7 肽有3 条,8 肽有3 条,9 肽有3 条,10 肽有2条,11 肽有4 条,12 肽、13 肽、14 肽各1 条。除INTLL 以外,其他多肽均呈现抗氧化活性,其中HLFLSGVACFG具有极强的抗氧化活性(其二级后谱见图4)。对比芦鑫等[9]报道的芝麻抗氧化肽,本研究鉴定出的芝麻抗氧化肽分子量更小、活性更高。可能是由于多酶水解芝麻蛋白时,酶切位点更多,导致形成的肽段短,活性基团暴露,有利于活性提升。观察多肽序列发现,Phe(F)、His(H)、Trp(W)、Cys(C)、Tyr(Y)等疏水氨基酸残基高频率出现。有研究指出,疏水性氨基酸[如Met(M)、C、H和芳香族]对多肽的抗氧化活性具有积极贡献[6,21-22]。
芝麻蛋白主要由2S、7S、11S 球蛋白和少量非贮藏蛋白组成,其中11S 球蛋白是芝麻蛋白的主体,约占70%[23]。观察芝麻抗氧化肽的来源蛋白发现,15 条抗氧化肽来自芝麻11S 球蛋白族(7 条来自芝麻11S 球蛋白亚型4、6 条来自芝麻11S 球蛋白的贮藏蛋白2、1条来自芝麻11S 球蛋白亚型3、1 条来自芝麻11S 球蛋白)、2 条来自芝麻7S 球蛋白、2 条来自芝麻酶蛋白。芝麻抗氧化肽主要来源于芝麻11S 球蛋白的原因可能是,当蛋白酶消化芝麻蛋白时,源自芝麻11S 球蛋白产生的肽段含量较高,其在液质联用鉴定过程中,产生的离子峰信号高,故获得的多肽源自芝麻11S 球蛋白居多[8-9]。此外,由表3可知,低含量的芝麻非贮藏蛋白也产生高活性的抗氧化肽(HLFLSGVACFG),表明芝麻非贮藏蛋白也是重要的抗氧化肽前体。
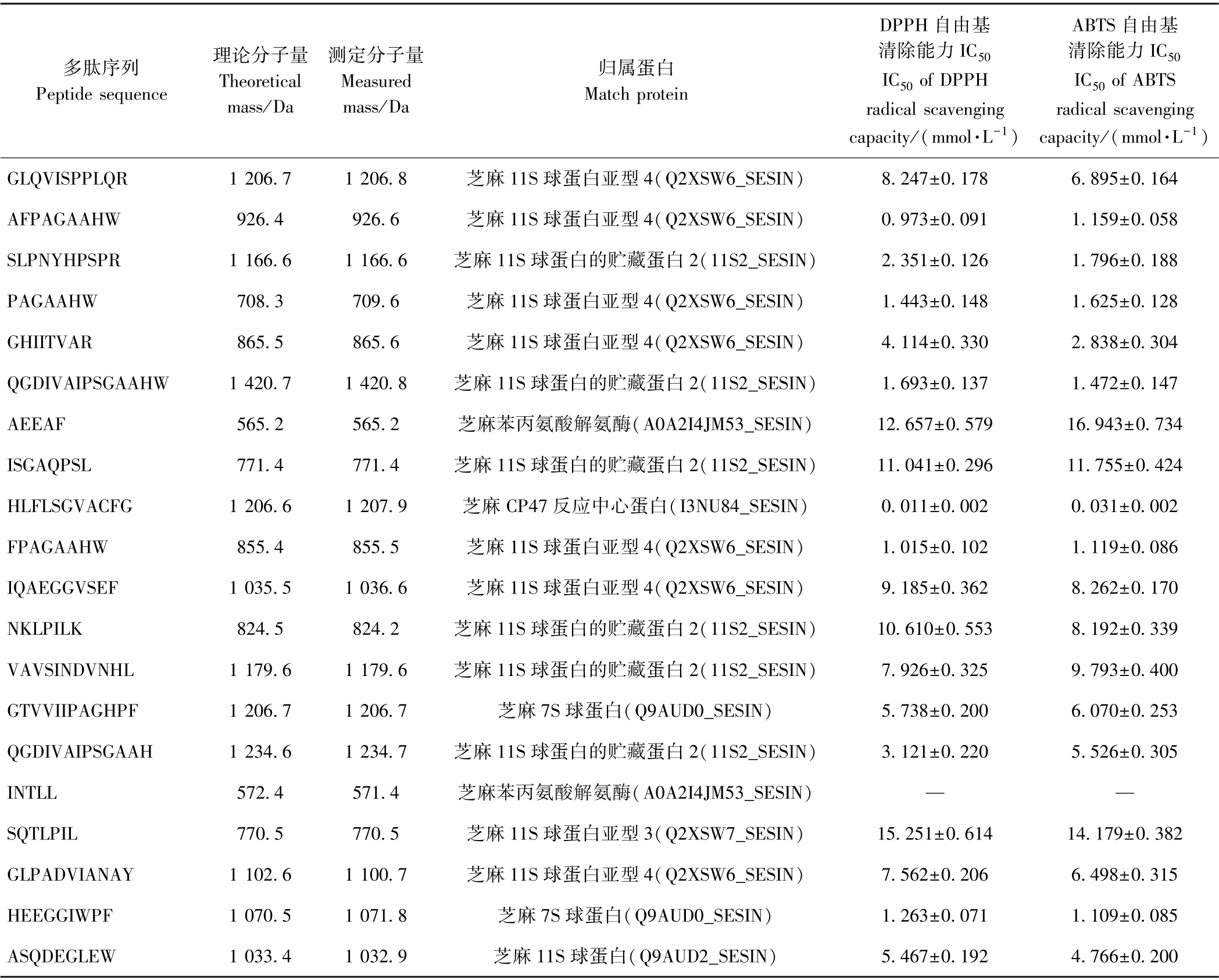
表3 从SPSN-I-P6 中鉴定的多肽的序列分子量、归属蛋白与抗氧化活性Table 3 Sequence,mass weight,original protein and antioxidant activity of peptide identified from SPSN-I-P6
2.4 抗氧化肽HLFLSGVACFG 构效关系分析
由于HLFLSGVACFG 的抗氧化活性明显高于其他多肽,故对该肽的构效关系进行研究。分别基于对DPPH 和ABTS 自由基的清除能力,建立CoMFA 模型。
对比HLFL、SGV、ACFG 对DPPH 和ABTS 自由基的清除能力,推测HLFLSGVACFG 的活性中心在ACFG 片段上,HLFL 片段也对其抗氧化活性有影响(表4)。Cys 的巯基、His 的咪唑基可以提供孤对电子给亲电试剂(自由基),从而中和自由基,起到抗氧化作用[24-26]。Phe 中苯环可供氢,减慢或终止自由基链式反应,而自身可以通过共振维持稳定,从而显示抗氧化作用[27],推测C(Cys)、H(His)、F(Phe)是形成抗氧化活性的关键氨基酸残基。
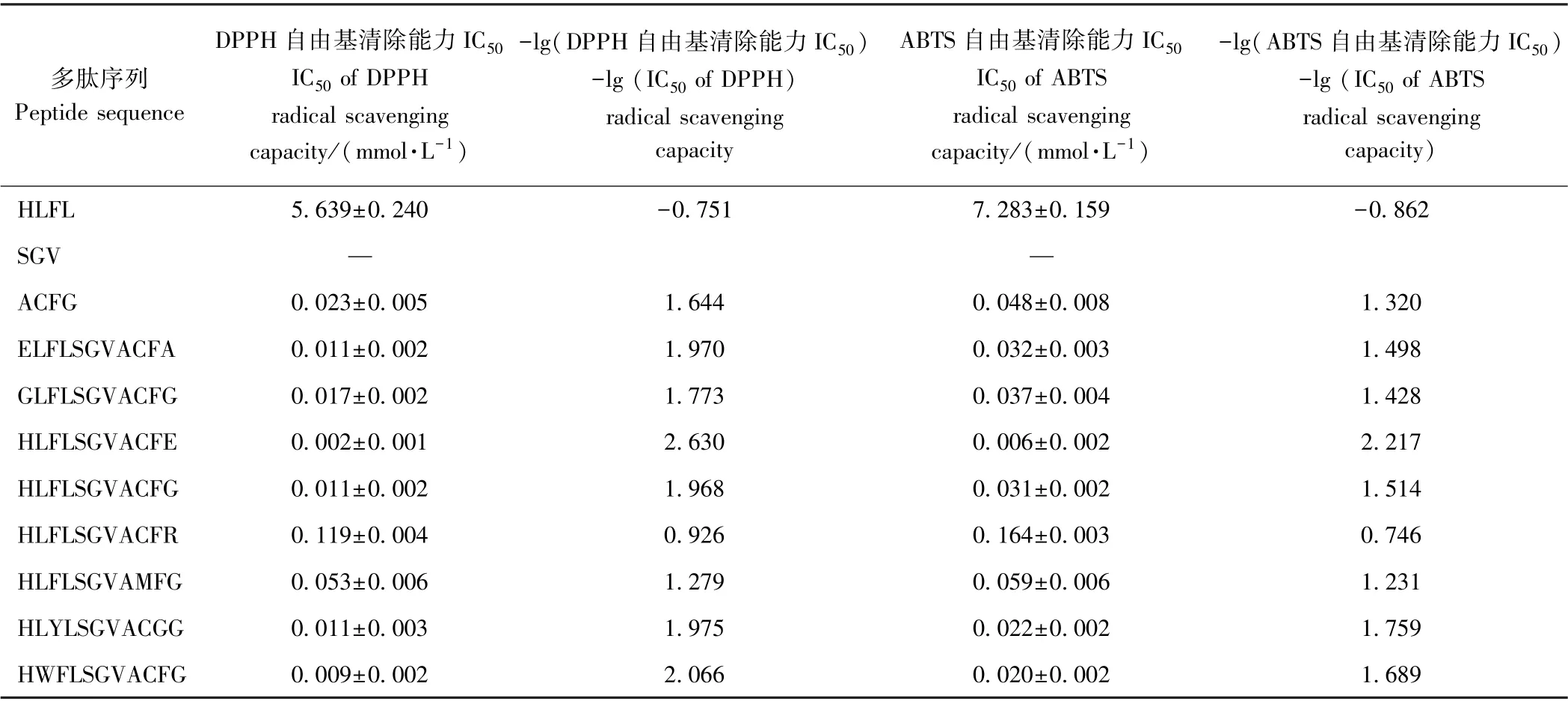
表4 HLFLSGVACFG 及其衍生肽的DPPH 和ABTS 自由基清除能力Table 4 DPPH and ABTS radical scavenging activities of HLFLSGVACFG and its derived peptides
Q2>0.5 是CoMFA 模型成立的条件之一[8]。由表5可知,基于DPPH 自由基清除能力的CoMFA 模型不成立,而基于ABTS 自由基清除能力的模型成立,因此,采用基于ABTS 清除能力建立的CoMFA 模型来揭示空间位阻与电荷极性对HLFLSGVACFG 活性的影响。电荷极性对HLFLSGVACFG 抗氧化肽的贡献要高于空间位阻,这可能是因为该肽是11 肽,分子尺寸较大,改变分子中某个氨基酸残基对于整个分子体积的影响较小,故空间位阻对于抗氧化活性的影响较弱。
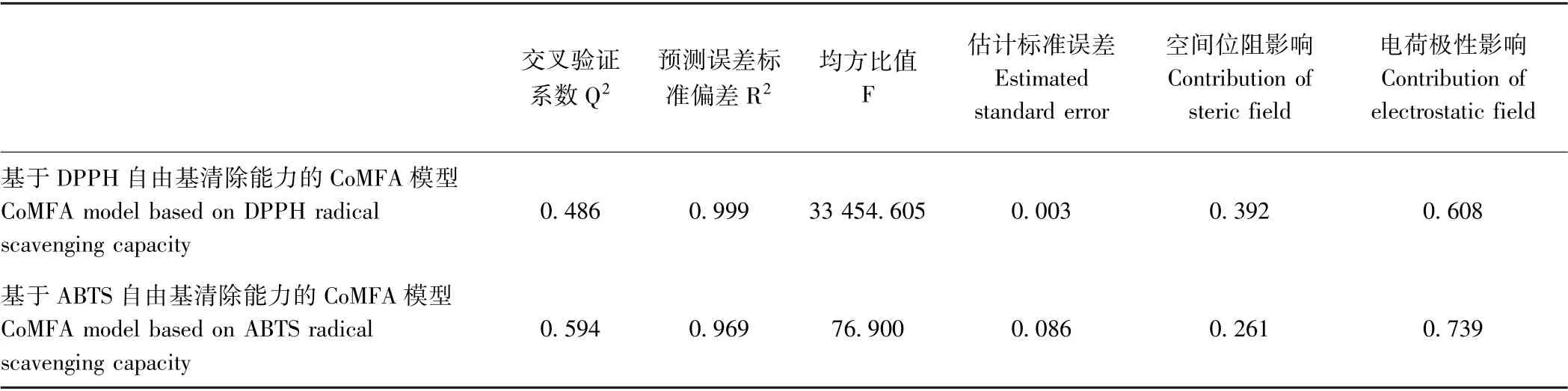
表5 HLFLSGVCFG 的CoMFA 模型特征Table 5 The characters of CoMFA model of HLFLSGVCFG
由图5-A 可知,图中粉点表示基于Connolly 算法模拟的分子表面,黄色区域表示小体积取代基有利于增强抗氧化活性,绿色区域表示大体积取代基有利于提升抗氧化活性,即减少Cys9 羧基端基团体积,有利于暴露巯基基团,从而有利于自由基接近巯基发生反应。而增加Leu2 所在区域的体积会导致主链弯曲,使His1 和Phe3 相互接近,增加此区域的电子云密度,从而增加与自由基反应的机率。
由图5-B 可知,蓝色区域表示正电荷有利于增强抗氧化活性,红色区域表示负电荷有利于增强抗氧化活性,即在N 端和Phe10 增加带正电的取代基,C 端增加带负电的取代基,在电荷斥力与引力的作用下,带正电的自由基向Cys9 的巯基靠拢,从而增加反应机率,显示更强的抗氧化活性。
2.5 抗氧化肽HLFLSGVACFG 的致敏性与毒性预测
自然界中,某些多肽具有毒性,如鹅膏毒肽类、蜂毒肽类、蛇毒肽类、微囊藻毒素等,有些多肽毒性可致死[28],有些多肽具有致敏性[29]。因此,有必要对芝麻蛋白源的抗氧化肽HLFLSGVACFG 进行安全性评估。由表6可知,基于氨基酸序列预测,HLFLSGVACFG 无致敏性、无毒性,安全性较高,可应用于食品、医药等行业。

表6 HLFLSGVACFG 的安全性预测Table 6 Safety prediction of HLFLSGVACFG
3 讨论
抗氧化肽既可以用作保健食品中的功能组分,也可以用作食品中的抗氧化剂,用途广泛,已成为功能性肽的热门研究领域。研究发现,芝麻蛋白经过体外酶解可以产生抗氧化肽,如 SYPTECRMR、AGEQGFEYVTFR[8-9]。但前人研究采用的蛋白酶多为碱性蛋白酶[7-8],这与人体内消化酶(胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶)的作用位点有明显差异,从而造成本研究发现的强抗氧化肽HLFLSGVACFG 与前人报道的芝麻抗氧化肽在结构组成上有差别。
结合前人研究,分析芝麻抗氧化肽的来源蛋白发现,多数芝麻抗氧化肽来源于芝麻贮藏蛋白[8-9],如芝麻11S 球蛋白,非贮藏蛋白也会生产种类较少的强抗氧化肽,如SYPTECRMR 来源于芝麻2S 蛋白[8],HLFLSGVACFG 来源于芝麻CP47 反应中心蛋白。因此,芝麻蛋白的贮藏蛋白与非贮藏蛋白均对抗氧化肽的生成做出了贡献。由于芝麻非贮藏蛋白在芝麻蛋白中所占比例较小,其产生的多肽含量也较低,因此在分离纯化过程中,非贮藏蛋白源多肽所产生的信号极可能被贮藏蛋白源多肽的信号所掩盖或干扰,导致部分多肽发生漏检。后续研究有必要结合蛋白组学、计算机辅助酶解等技术揭示芝麻非贮藏蛋白源抗氧化肽的组成。
大量研究证明,抗氧化肽的活性由多肽的氨基酸序列、链长和构型决定[30],其中氨基酸序列主要通过氨基酸残基结构来影响抗氧化肽的活性。研究发现对多肽抗氧化活性的贡献较突出的氨基酸残基为Tyr、Trp、Cys 及Met,这是由于其结构中酚羟基、吲哚基、巯基和巯甲基可以作为电子供体清除自由基[6];同时,氨基酸残基中氨基与羧基可以螯合金属离子或作为质子供体[31];疏水与亲水基团使短肽分布在油水界面,保护脂质不受氧化损害。本研究比较HLFL、SGV、ACFG 的DPPH 和ABTS 自由基清除能力发现,ACFG具有较强的抗氧化能力,再次证实了Cys 中巯基对多肽抗氧化活性的重要贡献。HLFLSGVACFG 抗氧化活性强于ACFG,表明其他氨基酸残基通过空间位阻或电荷极性等对抗氧化活性也有所贡献。此外,将Cys9更改成Met9 时,多肽的抗氧化活性明显减弱,表明巯基清除自由基的能力强于巯甲基,这可能是巯甲基中甲基的空间位阻大于氢原子,从而增加了巯甲基与自由基结合的难度。将Phe3 替换成Tyr3,或将Leu2 替换成Trp2 后,多肽的抗氧化活性都有所增强,也再次证实芳香族氨基酸Tyr、Trp 对多肽抗氧化活性的积极贡献。采用CoMFA 模型揭示构效关系,发现电荷极性对抗氧化活性的影响大于空间位阻,因此,引入合适的带电基团可以更有效地增强抗氧化活性。
抗原决定簇是一段氨基酸序列,含有抗原决定簇会导致蛋白或多肽具有致敏性[19,29]。芝麻蛋白具有一定的致敏性,目前,检测出的芝麻过敏蛋白有7种[28]。因此,以芝麻蛋白为原料制备的多肽具有致敏的可能性,需要做安全性评价。基于氨基酸序列预测,HLFLSGVACFG 无过敏性、无毒性,但仍需要后续相关研究以证实。
4 结论
本研究结果表明,芝麻蛋白经过体外模拟消化可以产生抗氧化肽,推测芝麻蛋白也对芝麻在人体消化过程中的抗氧化作用有所贡献。芝麻11S 球蛋白、7S球蛋白以及非贮藏蛋白均参与抗氧化肽的形成,虽然芝麻11S 球蛋白是生成抗氧化肽的主体,但非贮藏蛋白是高活性抗氧化肽的前体蛋白。从芝麻蛋白水解液中共鉴定出19 个芝麻抗氧化肽,其中HLFLSGVACFG的抗氧化活性最强,由CoMFA 模型可知,缩小Cys9 羧基端取代基团,增大Leu2 区域的取代基,增强N 端带正电取代基和C 端带负电取代基,有利于提高HLFLSGVACFG 的抗氧化活性。此外,经预测,HLFLSGVACFG 无毒、无致敏性。HLFLSGVACFG 抗氧化能力强、安全性高、稳定性高,具有研究与开发利用价值。
