水稻早衰快腐突变体ad1衰老特性的研究
2021-04-15姜鸿瑞叶亚峰陶亮之吴跃进刘斌美
何 丹 姜鸿瑞 叶亚峰 杨 阳 任 艳 陶亮之 吴跃进 刘斌美
(1中国科学院合肥物质科学研究院,安徽 合肥 230031;2安徽大学物质科学与信息技术研究院,安徽 合肥 230031)
水稻早衰是制约水稻产量提高的主要因素。我国水稻种植面积约占粮食作物种植面积的30%,总产量约占全国粮食产量的38%,排名世界第一[1]。田间实践表明,灌浆期水稻叶片衰老每推迟1 d,可使稻谷增产1%左右[2]。因此,研究水稻衰老相关生理生化及分子机理具有重要的现实意义。水稻衰老的机制复杂,受到多个基因调控并经历一系列的生理生化变化。目前已经提出多个早衰假设,如基因调控假说、自由基损失学说、光碳失衡假说、营养亏损学说、糖诱导假说、和激素平衡假说等[1],但是单一假说无法对水稻的衰老机制进行全面深入的阐述。因此,对水稻衰老突变体的发掘和生物学特性研究有助于了解水稻衰老的机制,而且对培养高产水稻、发掘水稻高产新品种具有重要意义。水稻衰老突变体分为早衰和迟衰两大类,衰老突变体分为叶片早衰、叶鞘早衰、穗早衰等类型[3]。截至目前,叶片衰老数据库(http:/ /eplantsenescence.org)中已经鉴定出与水稻衰老相关的基因188 个。通过对现有水稻种质资源进行定向诱变,筛选出衰老相关突变体,有望在基因水平上改良水稻早衰的现象,如将限速酶异戊烯基转移酶(isopentenyl transferase,IPT) 导入水稻可以使叶片衰老得到有效改善,提高结实率和穗数[4]。
衰老特性在一定程度上受到环境影响,如一些早衰突变体lmes3[5]、lmes4[5]、OsLMs[6]等在营养生长时期发生自然早衰现象的同时叶片也出现类病斑。但目前大多数突变体的早衰是受到基因调控生长到一定阶段而发生的自然早衰,受环境调控的早衰突变体报道较少。水稻作为单子叶植物,极易受环境影响。水稻对环境温度、光照的感知和耐受性涉及诸多基因和耐高温机制协调作用的生理过程。植物细胞膜将高温胁迫信号传递到细胞内,细胞核通过调控相关基因的表达产生短期的适应机制,例如活性氧(reactive oxygen species,ROS)的清除、膜脂不饱和现象及热休克蛋白的保护等均与植物的耐热性有关[7]。全年温度每提升1℃,估测水稻会减产3.2%[8]。目前水稻环境响应突变体的研究主要集中在筛选耐高温、耐低温水稻品种以及选育温敏、光敏不育系等方面,如水稻耐低温基因COLD1 功能标记的开发及应用[9],水稻温度超敏突变体ths1 的鉴定[10],水稻阶段性温敏白化转绿突变体stgra254 的鉴定[11],水稻温敏感失绿突变体tcd51 的鉴定[12]等。
本研究通过重离子辐射脆秆水稻品种科辐粳7号,在M2群体中筛选到一个早衰突变体ad1,遗传稳定。与其他早衰突变体相比,ad1 的衰老特性受环境诱导。在海南三亚南繁生长时早衰特征表现较弱,未出现植株腐解现象,仅少量叶片枯黄;在合肥试验田播种时植株早衰现象严重,最终几乎完全腐解,仅能收获极少量种子。目前鲜见相关突变体的报道。因此,探究该突变体衰老的发生及产生不同衰老程度的原因,有助于更加全面地解释环境影响水稻衰老以及植物感受外界环境变化的分子生理机制。
1 材料与方法
1.1 试验材料
重离子辐射脆秆水稻品种科辐粳7 号,在25 000株M2群体中筛选到与衰老特性相关的突变体并命名为早衰自腐突变体ad1。早衰自腐突变体ad1 以及野生型科辐粳7 号(WT)均由中国科学院合肥物质科学研究院技术生物与农业工程研究所保留。
1.2 试验设计及方法
1.2.1 试验设计 2018年11月20日在海南三亚南繁播种WT 以及突变体ad1,12月10日移栽;2019年5月9日在合肥科学岛试验田播种WT 以及突变体ad1,5月30日移栽;株行距20 cm×20 cm,采用随机区组设计,田间种植,3 次重复,每个小区5 行,每行20株,按正常田间肥水管理,及时防治水稻病虫害。
1.2.2 遮光试验 2019年7月20日,在合肥试验田对WT 及突变体ad1 中部分材料用遮光网进行遮光处理,遮光处理40 d 后选取WT 与突变体ad1 各5 株。采用SPAD-502Plus 叶绿素测定仪[Konica Minolta,柯尼卡美能达(中国)投资有限公司]测定水稻倒2 叶上部、中部和基部的SPAD 值,求得每个单株倒2 叶的SPAD 平均值,再对WT 与突变体ad1 的5 个单株结果进行数据统计及处理,检测突变体和WT 在叶绿素相对含量上的变化。
1.2.3 叶绿素含量测定 在合肥试验田分别选分蘖期、拔节期、孕穗期、抽穗期、开花期5 个时期的WT 和突变体ad1 材料,每个时期选择3 个单株的倒2 叶去掉中脉,剪碎,混匀。称取剪碎的样品0.1 g,采用乙醇提取比色法[13]测定叶绿素和类胡萝卜素的含量,每个样品设3 个重复。
1.2.4 光合速率测定 选取合肥试验田抽穗期WT和突变体ad1 植株,田间测量各项光合作用指标。田间条件下,在抽穗期晴天上午9:00~11:00,取长势相对一致的WT 和突变体ad1 各3 株,利用Yaxin-1102型便携式光合作用测定仪(北京雅欣理仪科技有限公司)分别测定WT 和突变体ad1 倒2 叶的各项光合作用指标。每株测定5 片剑叶,每叶重复测定3 次;测量时为开路测量,温度30℃,CO2浓度、湿度与大气保持一致[14-15]。
1.2.5 石蜡切片观察 切取合肥试验田抽穗期WT和突变体ad1 倒2 叶中间部位1 cm 组织,抽穗期WT和突变体ad1 茎秆倒2 节中间部位1 cm 组织;先固定样品,经冲洗、脱水、透明、浸蜡、包埋、切片、贴片、拷片[16],叶片使用番红-固绿染色,茎秆使用甲苯胺蓝染色,用切片数字扫描(Pannoramic DESK,P-MIDI,P250,P1000,匈牙利3D HISTECH 公司)进行普通白光切片扫描。
1.2.6 透射电镜观察 取合肥试验田抽穗期WT 和突变体ad1 倒2 叶,沿叶脉切成1 mm 的小块。在2.5%戊二醛固定液中抽真空,室温固定12 h,用蒸馏水冲洗后,1%锇酸溶液再固定4 h,经不同浓度梯度的乙醇脱水,用环氧树脂包埋、聚合、修块、切片、醋酸铀染色,经透射电镜(Hitachi HT7700,日本日立高新技术公司)观察、拍照[17]。
1.2.7 染色试验 取合肥试验田抽穗期WT 倒2 叶,突变体ad1 剑叶、倒2 叶、倒3 叶、倒4 叶进行染色试验。参考Mahalingam 等[18]的方法,利用二氨基联苯胺(diamino benzidine,DAB)染色,直接观察水稻叶片组织中H2O2的积累;参照Kong 等[19]的方法,使用伊文思蓝(evans blue,EB) 染色死细胞;氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)染色组织中超氧阴离子[20]。
1.2.8 酶活性和衰老相关参数测定 在2019年8月9日分别剪取合肥试验田抽穗期WT 和突变体ad1 的剑叶、倒2 叶、倒3 叶。参考李合生[21]的方法,每份叶片称取0.5 g,放入液氮研磨成粉,加入磷酸缓冲溶液(phosphate buffer saline,PBS)4.5 mL,配制成10%的组织匀浆。在4℃下3 500 r·min-1离心15 min,取上清液。用南京建成试剂盒测定上清液总超氧化物岐化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT) 和总抗氧化力(total antioxidant capacity,T-AOC) 活性,以及可溶性蛋白(soluble protein,SP)和丙二醛(malonaldehyde,MDA)含量。每个样品3 个重复,取平均值。
1.2.9 遗传分析 突变体ad1 与WT、武运粳7 号(粳稻)、日本晴(粳稻)、9311(籼稻)、华粳籼74(籼稻)、明恢63(籼稻)6 个亲本分别自交或杂交收获F1,F1自花授粉收获F2。对F1和F2进行表型和遗传分析。统计F2群体中早衰植株与正常植株的分离情况,用卡方适应性检测。
1.2.10 数据统计分析 采用SPSS 13.0 软件进行数据分析及卡方检验。
2 结果与分析
2.1 突变体ad1 的表型
海南试验田中,WT 未出现衰老特性;突变体ad1前期未出现衰老特性,成熟期叶片出现少量麻黄色斑点,早衰现象不明显(图1-A、B)。合肥试验田中,WT未出现衰老特性;突变体ad1 抽穗期出现衰老特性,从老叶的叶尖开始出现麻黄色,再从叶尖逐步向叶片基部扩展直至整片叶完全枯死,衰老现象从老叶向新叶扩展,最终完全死亡(图1-C)。
通过采集不同时期突变体ad1 倒2 叶进行比较发现,突变体在孕穗期出现衰老现象后,灌浆期完全枯死。突变体ad1 在灌浆期完全枯死后,茎秆仍不断变薄,最终呈薄纸状态,叶片自然分裂破碎(图1-D)。最终,突变体ad1 整个植株坍塌,茎秆和叶片逐渐腐解(图1-E),基本与秸秆在土壤中的腐解特征类似。
2.2 突变体ad1 的农艺性状
由表1可知,海南生长的突变体ad1 有效穗数、每穗粒数分别较WT 高5.71%、23.46%,株高、千粒重分别较WT 降低3.97%、4.60%,结实率降低10.67 个百分点,每穗粒数差异显著增高,株高及结实率显著降低。合肥生长的突变体ad1 成熟期整个植株坍塌腐解无法进行考种,因此从分蘖期开始对突变体进行农艺性状考察,结果表明,分蘖期突变体株高、地上部干物质重、分蘖数分别较WT 提高0.47%、69.71%、117.28%,成熟期突变体株高、地上部干物质重分蘖数分别较WT 降低8.05%、50.00%、64.66%(图2)。
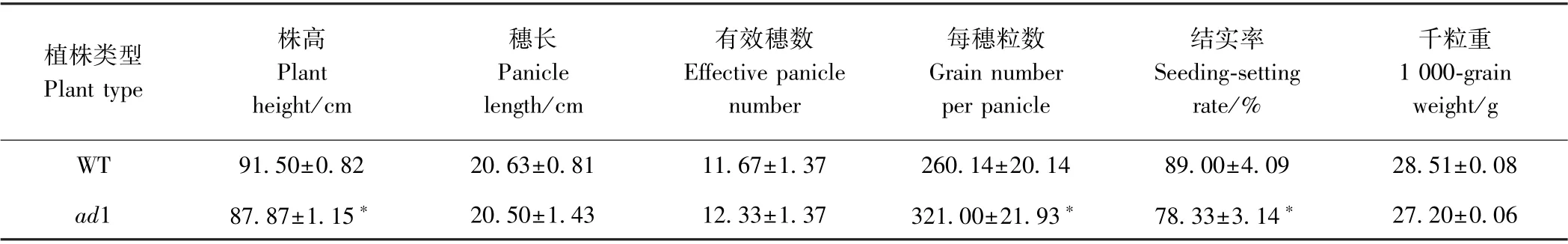
表1 野生型(WT)和突变体ad1 的农艺性状鉴定(海南)Table 1 Identification of agronomic characteristics of the wild type and mutant ad1 (Hainan)
2.3 光照对突变体ad1 的影响
对突变体ad1 和WT 大田材料进行遮光处理40 d后发现,遮光条件下WT 植株表型并未产生差异,而突变体ad1 的衰老仍然发生,但衰老情况明显减弱。通过测定叶绿素含量发现,未遮光条件下WT 的SPAD值为42.6,突变体ad1 的SPAD 值为8.6(表2,图3-A);遮光条件下WT 的SPAD 值为41.8,突变体ad1 的SPAD 值为28.9(表2,图3-B)。证明强光会使突变体ad1 中叶绿素含量大幅减少,从而使突变体ad1 衰老更为严重。

表2 遮光条件下野生型(WT)和突变体ad1 的SPAD 值Table 2 SPAD values of wild type (WT) and mutant ad1 under shading conditions
2.4 光合特性相关指标与光合色素含量的测定
光合特性指标测量结果显示抽穗期突变体ad1 的净光合速率、气孔导度和蒸腾速率极显著低于WT,胞间CO2浓度显著高于WT。表明突变体ad1 的光合作用相对于WT 减弱(表3)。光合色素含量分析发现,突变体ad1 总叶绿素含量从分蘖期到开花期分别是WT 的66.10%、30.68%、23.27%、17.34%、14.67%。突变体ad1 类胡萝卜素含量从分蘖期到开花期分别为WT 的87.86%、57.82%、61.89%、52.43%、58.80%(图4)。
2.5 组织细胞切片观察
对突变体ad1 和WT 的倒2 叶中间部位横切面石蜡切片观察,发现WT 叶肉细胞结构清晰、排列致密,气孔及孔下室结构完整,泡状细胞结构完整,表皮毛多(图5-A);而突变体ad1 叶肉细胞结构模糊,排列松散,气孔及孔下室结构受损且气孔附近叶肉细胞受损严重,泡状细胞结构受损,表皮毛少且模糊(图5-B)。
对突变体ad1 和WT 的茎杆倒2 节中间部位横切面进行组织观察发现,WT 茎杆表皮厚,厚壁组织细胞排列致密、细胞层数多、细胞形状无规则、细胞大小从外层到内层逐渐变大(图6-A);而突变体ad1 表皮薄,厚壁组织细胞排列松散、细胞层数减少、细胞形状为椭圆型、细胞大小一致且排列均匀(图6-B)。WT薄壁细胞结构清晰,细胞间隙明显;而突变体ad1 薄壁细胞结构模糊且细胞间隙减小,排列松散,部分细胞的细胞结构受损。

表3 野生型(WT)和突变体ad1 光合特性Table 3 Photosynthetic characteristics of the wild type(WT) and mutant ad1
2.6 透射电镜观察叶绿体
利用透射电子显微镜观察抽穗期WT 和突变体ad1 倒2 叶叶绿体超微结构。结果显示,WT 叶片叶肉细胞内叶绿体发育正常,结构完整,呈纺锤状,基质浓厚,基 粒 丰 富,片 层 垛 叠 排 列 紧 密、厚 实(图7-A、B、C)。而突变体ad1 叶片内部,叶绿体结构异常,淀粉颗粒明显增多,类囊体排列紊乱,片层结构模糊,基粒垛叠松散(图7-D、E、F)。说明突变体ad1中叶绿体降解加快,从而影响光合能力,导致产量降低。
2.7 组织化学染色
叶片衰老伴随着大量细胞死亡,会造成机体细胞内累积大量ROS。通过EB 染色(图8-A)、DAB 染色(图8-B)、NBT (图8-C)染色结果,对比WT 和突变体ad1 倒2 叶发现,WT 倒2 叶叶片上均未染上颜色,突变体ad1 倒2 叶染色结果较深。说明WT 叶片中死细胞含量、H2O2含量、超氧阴离子含量较少,而突变体ad1 中死细胞含量、H2O2含量、超氧阴离子含量增多。对比突变体ad1 从剑叶到倒4 叶染色结果发现,染色逐渐加深。说明突变体ad1 叶片中死细胞含量、H2O2含量、超氧阴离子含量从新叶到老叶逐渐升高。
2.8 衰老相关参数的测定
在水稻衰老过程中,叶片内ROS 大量积累,当ROS 水平超出防御机制所及范围,细胞会处于氧化胁迫状态,引发脂质过氧化、蛋白质氧化、核酸损伤和酶失活,并能激活程序性细胞死亡[22]。抽穗期突变体ad1 剑叶、倒2 叶、倒3 叶中MDA 含量分别是WT 的2.99、3.11、1.40 倍。表明突变体ad1 叶片中机体脂质过氧化的程度高,受到ROS 攻击损失更严重。同时,抽穗期突变体ad1 的剑叶、倒2 叶、倒3 叶中SP 含量仅占WT 的49.24%、44.84%、47.58%。
通过检测植物细胞内ROS 相关清除机制发现,抽穗期突变体ad1 剑叶、倒2 叶、倒3 叶中的下T-SOD活性分别是WT 的144.56、5.01、1.66 倍;CAT 活性分别是WT 的10.15、3.14、3.36 倍;T-AOC 活性分别是WT 的0.58、1.25、3.12 倍(图9)。说明伴随突变体ad1 体内ROS 的产生,突变体ad1 体内抗氧化酶活性增加,使得突变体清除自由基能力增强。
2.9 遗传分析
将突变体ad1 杂交,F1植株叶片为正常表型。F1自交得到出现性状分裂的F2群体,对正常株和突变株数目进行卡方分析,不同组合的χ2<χ20.05=3.84,均符合3∶1 的分离比(表4)。表明ad1 突变体表型特征由一对核隐性基因控制。
3 讨论
水稻的衰老受到多种因素的调控影响。目前已经鉴定出与水稻衰老有关的突变体,如esl6[23]、ospse1[24]、Psd128[25]、spl33[26]、es1-1[27]、spl3[28]、psd128[29]、rsl3[30]、lts1[31]、es3 (t)[32]、psls1[33]、spl29[34]、del1[35]、OsELF3.1[36]等,其早衰或迟衰现象的差异主要集中在生育期及表型的不同,这些差异受到基因调控,与环境无关,目前有关环境响应的衰老突变体研究较少。本研究的突变体ad1 在海南、合肥两地种植的田间表型差异明显。通过考察两地环境气差异候发现,温度和光照可能是最主要的影响因素。在突变体ad1 抽穗成熟期,合肥最高温度达到38℃,而海南最高温度仅为33℃。同时田间观察发现突变体ad1 衰老现象的发生伴随着气温升高,且持续高温天气下(32℃以上),突变体ad1 迅速衰老,推测突变体ad1 的衰老在受到光照影响的同时也受到高温影响。由于海南、合肥两地也存在气候、生态等条件差异,因此后续计划克隆相关的突变基因,通过对不同环境因子的响应试验(高温、光照、湿度等),揭示这种早衰特性发生的具体机理。
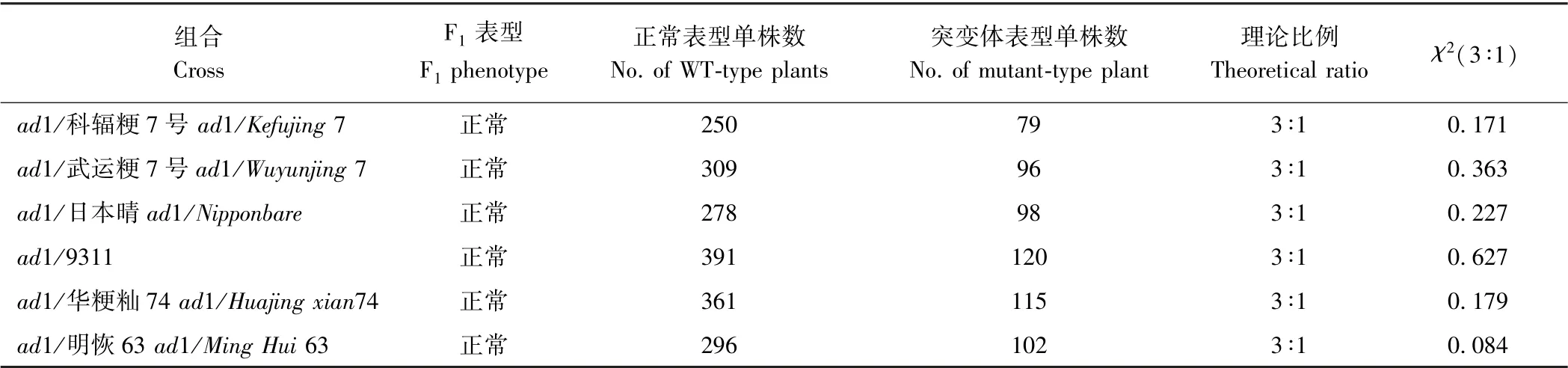
表4 突变体ad1 的遗传分析Table 4 Genetic analysis of mutant ad1
已有研究表明环境诱发水稻衰老主要通过高温、强光等诱发产生自由基,引起生物膜相变和膜脂过氧化,加速植物衰老,同时叶片中SP 含量随叶片衰老降低[37]。本研究通过染色及化学检测发现突变体ad1体内相关ROS:过氧化氢,超氧阴离子,MDA 含量升高;突变体ad1 叶片SP 含量降低,死细胞含量增多,证明突变体ad1 叶片衰老程度更高。在很多表型类似的早衰突变体中,如早衰突变体lmes3 和lmes4[4]的ROS相关清除机制受到了损伤。而本研究通过化学检测发现,衰老突变体ad1 中ROS 相关的清除机制未受损,表现为CAT、T-SOD、T-AOC 含量均高于WT,因此,突变体ad1 衰老虽然受到自由基离子作用,但并不是突变体ad1 体内ROS 清除机制受损造成的。可能由于环境诱导突变体产生过量ROS,导致突变体中ROS 与其清除机制间的平衡被打破,ROS 水平超出防御机制所及范围,细胞会处于氧化胁迫状态,引发脂质过氧化,并通过链式或链式支链反应放大ROS 的作用[38],最终导致突变体ad1 主要的膜组织叶绿体受损,叶肉细胞减少,细胞死亡,引发植株早衰。
突变体ad1 在合肥生长产生衰老并且最终产生植株整体腐解现象,通过观察突变体ad1 茎秆组织发现:(1)腐解使突变体表皮变薄,厚壁组织细胞排列变得松散、细胞层数减少、细胞变大且排列均匀;(2)薄壁细胞结构模糊,细胞间隙变小,排列松散。推测突变体秸秆的结构改变是造成其最终发生完全腐解的原因。目前关于秸秆快速腐解的研究主要借助于相关理化技术以及微生物的作用[39],从品种材料研究水稻秸秆腐解特性的报道相对较少。本研究通过对突变体ad1 衰老腐解的生物学研究,为探究水稻植株快速腐解提供了新材料。目前正在进行突变体目的基因定位相关工作,后续将进一步对该突变体基因进行克隆,从而从分子水平上进一步解释造成该突变体衰老的原因,以及从分子机制上解释高温调控该突变体发生衰老腐解的机制。
4 结论
本研究结果表明,突变体ad1 是环境响应的早衰腐解植株,衰老程度受光照影响。与野生型水稻相比,突变体ad1 叶片叶肉细胞及气孔受损,茎秆厚壁细胞减少,叶绿体结构异常,光合色素减少,植株光合作用受到明显抑制。突变体ad1 衰老过程中叶片内清除ROS 的相关保护酶CAT、T-SOD、T-AOC 活性上升,但是ROS 仍然大量积累,死细胞、过氧化氢以及超氧阴离子增多,MDA 含量升高,SP 含量降低,最终造成农艺性状受损。遗传分析表明ad1 突变表型受一对隐性核基因控制。本研究结果为突变体ad1 基因定位和基因功能研究奠定了一定的理论基础。
