彩色油菜花瓣色素成分研究
2021-04-15林宝刚朱建方张冬青王军威华水金
柳 寒 任 韵 林宝刚 朱建方 程 辉 张冬青 王军威 华水金
(1浙江省农业科学院作物与核技术利用研究所,浙江 杭州 310021;2湖州市农业科学研究院,浙江 湖州 313000;3信阳市农业科学院,河南 信阳 464000)
油菜(Brassica napusL.)是我国重要的油料作物。油菜除榨油外,还具有蔬用、观赏用、饲用、蜜用、盐碱地改良、肥用和药用等功能[1-2]。油菜作为观赏用或者观赏-油料两用的历史悠久,且具有独特的优势,如浙江仙居和江西婺源的梯田油菜花海[3-4],以花为媒,打造美丽乡村,促进三产融合潜力极大。传统油菜花为黄色系,如奶黄、土黄、深黄等。之后通过育种培育出白色、橙色、红色和紫色等色系的彩色油菜花。白色系主要有纯白、乳白、翠绿。黄色和白色系育成较早,而且色系稳定,在生产上已有较大面积的推广与应用[4]。橙色系、红色系和紫色系颜色丰富,但是生产上色泽稳定。
虽然彩色油菜已广泛应用于创意农业,但是,关于不同色系彩色油菜色素形成机理鲜有报道。橙色和红色系是近年来新育成的彩色油菜类型,具有极高的观赏价值。然而,这些彩色油菜花瓣中积累的色素尚未知晓。推测彩色油菜花瓣中可能含有花青素或能够呈色的次生代谢化合物。植株中花青素的合成途径已经较为明确,且在部分物种中进行了详细的研究[5-7]。花青素属于黄酮类化合物,其合成分三个阶段:第一阶段以苯丙氨酸为底物合成4-香豆酰CoA;第二阶段由4-香豆酰CoA 和丙二酰CoA 在一系列酶促反应下合成二氢黄酮醇;第三阶段由二氢黄酮醇在二氢黄酮还原酶(dihydroflavonol reductase,DFR)、花青素合成酶(anthocyanidin synthase,ANS)等酶作用下合成各种花青素,如芍药素、矢车菊素、天竺葵素和飞燕草素等[8-10]。最后在合适的pH 值和转录因子调控等作用下呈色[11-13]。目前,对于彩色油菜花瓣色素的种类、成分及相应的代谢途径调控、相关酶类活性、编码基因表达情况等问题需要进一步探索。本研究采用红色、橙色、黄色和白色4 种色系彩色油菜为材料,首先对彩色油菜花瓣中与色素积累有关的花色素次生代谢产物进行测定,然后采用液质联用仪对类胡萝卜素和花青素进行组分鉴定和定量分析,同时分析花青素合成过程中关键酶活性,最后从基因表达水平探究油菜花瓣色素积累的特征,旨在为彩色油菜育种提供理论依据。
1 材料与方法
1.1 材料
试验材料为花瓣颜色稳定遗传的红色、肉红色、肉橙色、橙黄色、橙色、深黄色、土黄色、翠绿、白色和黄色(常规颜色)共10 种彩色油菜品系(图1),由浙江省农业科学院作物与核技术利用研究所油菜育种与栽培研究室选育和提供,常规黄色油菜品种为浙油51。
1.2 试验设计
试验于2018—2019年在浙江省杭州市余杭区良渚麟海蔬果专业合作社基地进行。以9 个品系材料为处理组,以常规黄色品种(浙油51)为对照组。2018年10月7日直播(穴播),每穴约5 粒种子。播种3 d后灌溉1 次跑马水(傍晚灌溉,边灌边排,水沟水面低于畦面,保持12 h)。待油菜出苗后,立即用70%噁霉灵可湿性粉剂(3.5 g·L-1)喷施,以防治油菜猝倒病和立枯病等病害。11月1日间苗,11月15日定苗,使油菜群体密度达到每公顷300 000 株,株距与行距分别为10 和30 cm,小区面积13 m2。采用油菜专用肥(湖北宜施壮农业科技有限公司,N-P2O3-K2O:25-7-8)作为底肥,施用量为750 kg·hm-2;其他时期不灌水,病虫害和田间管理按照常规栽培管理方式进行。
1.3 取样与检测
1.3.1 取样 当油菜进入盛花期,75%以上植株开花后开始取样,只选取主花序开5 朵花以内、花蕾饱满的主花序花蕾,每小区随机选取150~200 个花蕾。将开过的花朵丢弃,选择尚未开放的花骨朵,用镊子剥去花苞,取下花瓣,分装于2 mL 离心管,用液氮冷冻后-80℃超低温冰箱保存备用。
1.3.2 黄酮类和类胡萝卜素次生代谢物含量检测取烘干花瓣100 mg,用15 mL 70%乙醇洗入棕色离心管中,30℃超声30 min,冷却至室温,10 000×g离心5 min,上清液洗入棕色容量瓶中;残渣用15 mL 70%乙醇重复提取1 次,合并两次上清液,以没食子酸和单宁为标准品,Folin-Ciocalteu 法[14]测定总酚和单宁含量。取100 mg 冷冻鲜花瓣,液氮中粉碎,用5 mL 80%丙酮提取,室温下超声波提取30 min,10 000×g离心5 min,上清液洗入容量瓶中;残渣用5 mL 80%丙酮重复提取1 次,合并两次上清液,以表儿茶素为标准品,香草醛比色法[15]测定原花青素含量。取烘干花瓣100 mg,粉碎,用10 mL 70%乙醇于70℃下水浴回流1 h 后,抽滤,滤液用70%乙醇定容至50 mL,以芦丁为标准样品,采用亚硝酸盐-氯化铝法测定类黄酮含量[16]。取烘干花瓣100 mg,粉碎,用1%盐酸乙醇溶液5 mL 于4℃浸提24 h,8 000×g离心10 min,取上清液,重复提取3 次,上清液合并后减压蒸干,并用10 mL 甲醇溶液定容,用pH 示差法[17]测定花色苷含量。
根据花色苷测定结果,采用液质联用仪(1290 高效液相色谱仪,美国安捷伦公司;Qtrap6500 质谱仪,美国AB 公司)进一步对红色、黄色和橙色油菜花瓣中的4 种主要花青素成分进行定量(矢车菊素、飞燕草素、天竺葵素和芍药素)。4 种花青素标准品购自美国Sigma 公司。液相条件:poroshell 120 SB-C18 反相色谱柱(2.1 mm×150 mm×2.7 μm,美国安捷伦公司),流动相为甲醇(含0.1%甲酸)∶水(0.1%甲酸)。质谱条件:气帘气15 psi,喷雾电压4 500 V,雾化气压力65 psi,辅助气压力70 psi,雾化温度400℃。
红色、橙色、黄色和白色油菜花瓣采用高效液相色谱法测定类胡萝卜素组分;包括α-,β-胡萝卜素和番茄红素(标准品购自美国Sigma 公司),液相条件:色谱柱,Waters Symmetry Shield RP18 反相色谱柱(4.6 mm×250 mm×5 μm),流动相为甲醇∶乙腈∶三氯甲烷=20∶75∶5(体积比)。
1.3.3 花青素合成相关酶活性检测 红色、白色、翠绿和黄色4 种彩色油菜花青素还原酶(anthoayanidin reductase,AVR)、DFR 活性采用比色法测定,ANS 活性采用ELISA 法测定,采用苏州科铭生物技术有限公司试剂盒检测,具体操作按照说明书进行。
1.3.4 花青素合成关键酶基因qRT-PCR 检测 以红色、橙色、橙黄色、黄色、土黄色、深黄色、白色和翠绿色油菜为材料。取-80℃超低温冰箱保存的花瓣用于提取RNA,RNA 提取试剂盒为QIGEN RNeasy Plant Mini kit(Qiagen 74903,德国)。提取的RNA 经反转录合成cDNA 备用。采用PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)(RR407A)反转录试剂盒(北京TaKaRa 公司)进行反转录。选择查尔酮合成酶基因(chalcone synthase,CHS),查尔酮异构酶基因(chalcone isomerase,CHI),黄烷酮3-羟基化酶基因(flavanone 3-hydroxylase,F3H),类黄酮3’-羟化酶基因(flavanoid 3-hydroxylase,F3’H),二氢黄酮醇还原酶基因(DFR)和花青素合成酶基因(ANS),进行表达量分析。采用实时定量PCR(real-time quantitative PCR,qRT-PCR)对花青素合成关键酶基因表达检测时,以油菜ACTIN作为参考基因。所选择的基因首先与相对应的拟南芥基因比对,然后在油菜基因组数据库中搜寻对应基因 (http:/ /www.genoscope.cns.fr/brassicanapus/)。qRT-PCR 所使用的引物见表1。qRT-PCR 分析采用罗氏LightCycler 480 实时荧光定量PCR 仪(Roche,瑞士)。检测方法如下:将反应混合物(2×)、反转录cDNA、基因特异引物(表1)依次加入反应板,用无RNase 蒸馏水补足至20 μL,均匀混合后上机检测。反应程序:95℃30 s 循环1 次;95℃5 s,60℃45 s,循环35 次。

表1 编码油菜花青合成关键酶基因qRT-PCR 的引物序列Table 1 Primer sequences of qRT-PCR for genes encoding key enzymes in Anthocyanin
1.4 统计分析
采用2-ΔΔCt法计算基因表达量,结果以黄色油菜花瓣中的表达量为对照加以表征(即以黄色油菜花瓣中基因表达量为1,其余花色油菜花瓣中的表达量为相对于黄色油菜花瓣表达量的倍数)。试验测定的各指标平均值采用单因素方差分析,各平均值之间的差异采用Duncan’s 法分析。彩色油菜花瓣中花色苷含量与DFR和ANS基因的表达量进行Person’s 相关性分析,并进行显著检验。数据统计分析采用R3.6.0 软件。
2 结果与分析
2.1 彩色油菜花瓣次生代谢物含量比较
由表2可知,各色系油菜花瓣中含有丰富的酚类物质,其含量介于8.87(深黄)~16.79(红色)mg·g-1DW 之间;红色系和橙色系油菜花瓣中的总酚含量无显著差异,但显著高于黄色、深黄色和白色油菜。黄色油菜花瓣中的单宁含量最低,仅为含量最高的肉红色油菜58.0%。彩色油菜中的原花青素仅在红色系和橙色系油菜花瓣中检测到,且橙色和红色油菜花瓣中的原花青素含量显著高于其衍生色系(肉红、肉橙和橙黄)。同时,红色和橙色油菜花瓣中的原花青素含量分别占单宁类化合物的85.5%和84.1%,说明红色和橙色油菜花瓣中的单宁类化合物主要成分是原花青素。橙色油菜花瓣中积累的类黄酮最多,而黄色油菜花瓣中的类黄酮含量最低,仅为橙色油菜花瓣中的45.4%。红色系和橙色系(除橙黄)油菜花瓣含有大量的花色苷,橙色油菜花瓣中的花色苷含量是黄色、土黄和深黄油菜花瓣中的5.8、25.0 和27.3 倍。虽然红色系和橙色系花瓣中的花色苷含量很高,但只占类黄酮物质的5.4%~10.2%。因此,相比于常规的黄色系以及选育的白色系油菜,红色系和橙色系油菜花瓣中含有更多的酚类和黄酮类次生代谢产物。
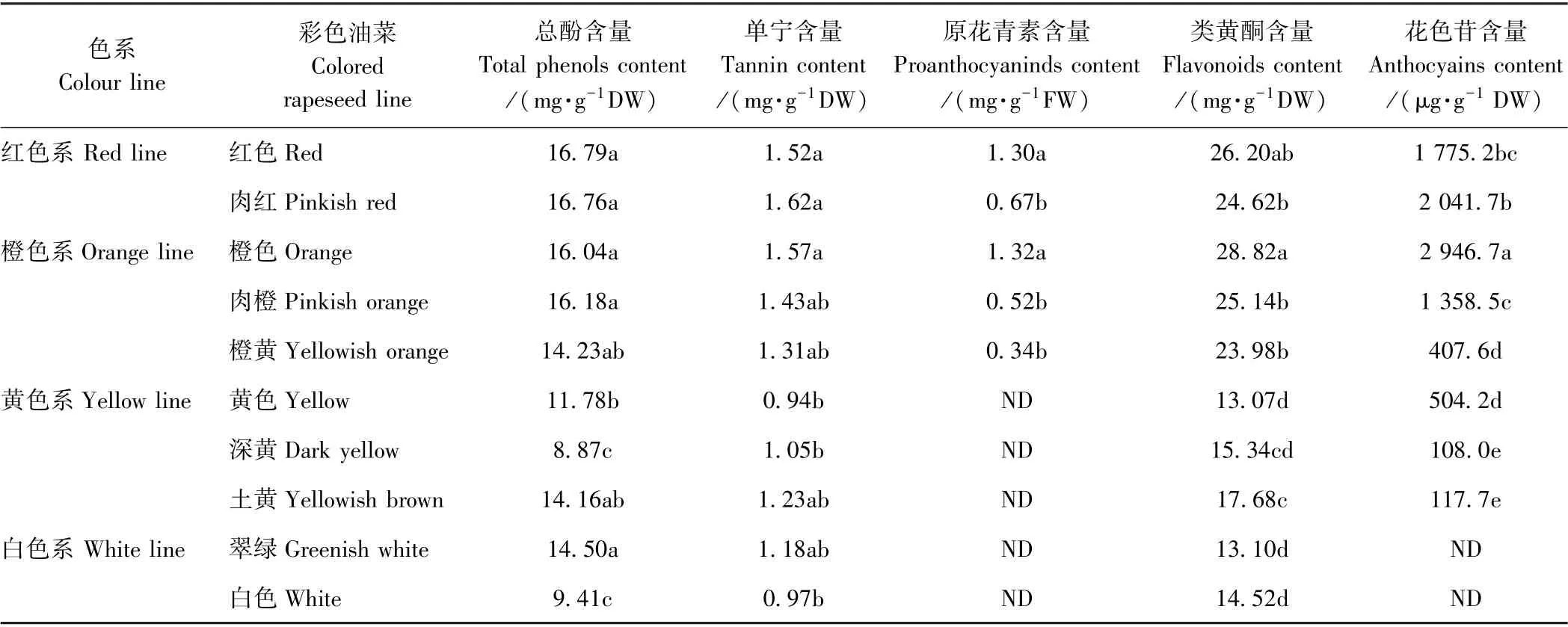
表2 彩色油菜花瓣色素代谢次生代谢物含量Table 2 Contents of pigment secondary metabolites in the petal of colored rapeseed lines
2.2 彩色油菜花瓣类胡萝卜素和花青素组分定量分析
为了进一步明确彩色油菜花瓣中的色素成分,对有可能呈色的类胡萝卜和花青素两种成分进行了定量分析(表3)。结果表明,三种类胡萝卜素成分在彩色油菜花瓣中的趋势与黄酮类次生代谢产物一致,即橙花>红花>白花>黄花。就三种类胡萝卜素成分而言,番茄红素含量最高,α-胡萝卜素和β-胡萝卜素含量在红色和橙色油菜花瓣中基本一致。黄色油菜花瓣以α-胡萝卜素为主,是β-胡萝卜素含量的6 倍;白花油菜则相反,β-胡萝卜素是α-胡萝卜素的1.6 倍。
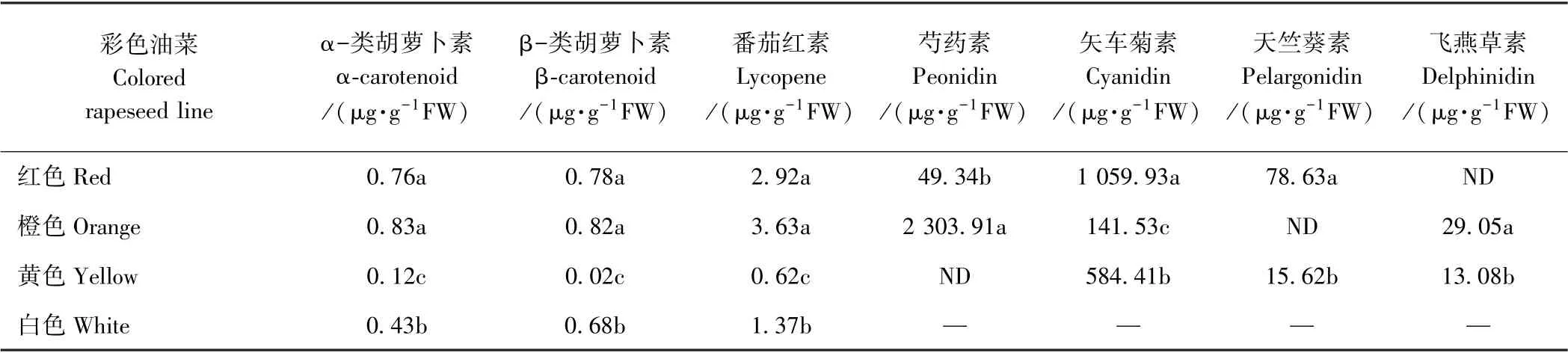
表3 彩色油菜类胡萝卜素和花青素成分Table 3 Content of components of carotenoids and anthocyanins in colored rapeseed lines
红色油菜花瓣的主要花青素成分为矢车菊素,芍药素和天竺葵素含量较少。红色油菜花瓣中的矢车菊素分别是芍药素和天竺葵素的21.5 倍和13.5 倍。而橙色油菜花瓣的主要成为芍药素,含有少量矢车菊素和飞燕草素,其芍药素分别是矢车菊素和飞燕草素的16.3 倍和79.3 倍。黄色油菜花瓣以矢车菊素为主,含少量天竺葵素和飞燕草素,芍药素未检测到。红色油菜花瓣中的矢车菊素是橙色和黄色油菜花瓣的7.5倍和1.8 倍,而橙色油菜花瓣中芍药素是红色油菜花瓣的46.7 倍。由此可见,红色与橙色、黄色油菜花瓣中的花青素组分不同。
2.3 彩色油菜花瓣花青素合成酶关键酶活性比较
比较花青素生物合成途径中的关键酶活性发现(表4),4 种彩色油菜中ANR、DFR 和ANS 活性均未存在显著差异(P>0.05)。ANR 活性在不同颜色油菜花瓣中的强弱依次为红色>橙色>黄色>白色,红色油菜花瓣中的ANR 活性比白色油菜增加了9.4%。DFR活性在不同颜色油菜花瓣中的强弱依次为白色>红色>橙色>黄色,白色油菜花瓣中DFR 活性比黄色油菜增加了18.2%。ANS 活性在黄色油菜花瓣中最强,白色油菜花瓣中最弱。黄色油菜花瓣中的ANS 活性是白色油菜花瓣的1.5 倍。
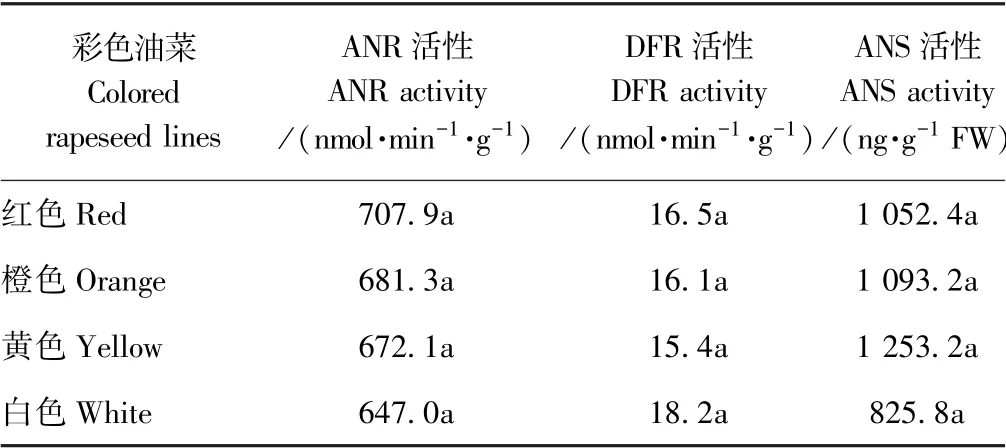
表4 彩色油菜花瓣ANR、DFR 和ANS 活性比较Table 4 Comparison on the activity of ANR,DFR,and ANS in colored rapeseed lines
2.4 彩色油菜花瓣中花青素合成酶关键基因表达量
由表5可知,编码花青素合成关键酶基因的表达量差异主要集中在DFR和ANS,即后期花青素合成的关键酶,且这两个基因在红色、橙色和橙黄色油菜花瓣中表达量较高,其中ANS基因的表达量是黄色油菜花的1 000 倍以上,而DFR基因则是黄色油菜花瓣中的表达量油菜花的100 倍以上。编码花青素合成前期关键酶基因在红花和白色油菜花瓣中表达量有显著差异,但总体表达量比较弱,彩色油菜花瓣中的表达量仅为黄色油菜花瓣中表达量的0.39~2.34 倍,且大部分低于2 倍。以上结果说明彩色油菜花瓣色素的积累在基因表达水平上主要在于后期花青素的合成。
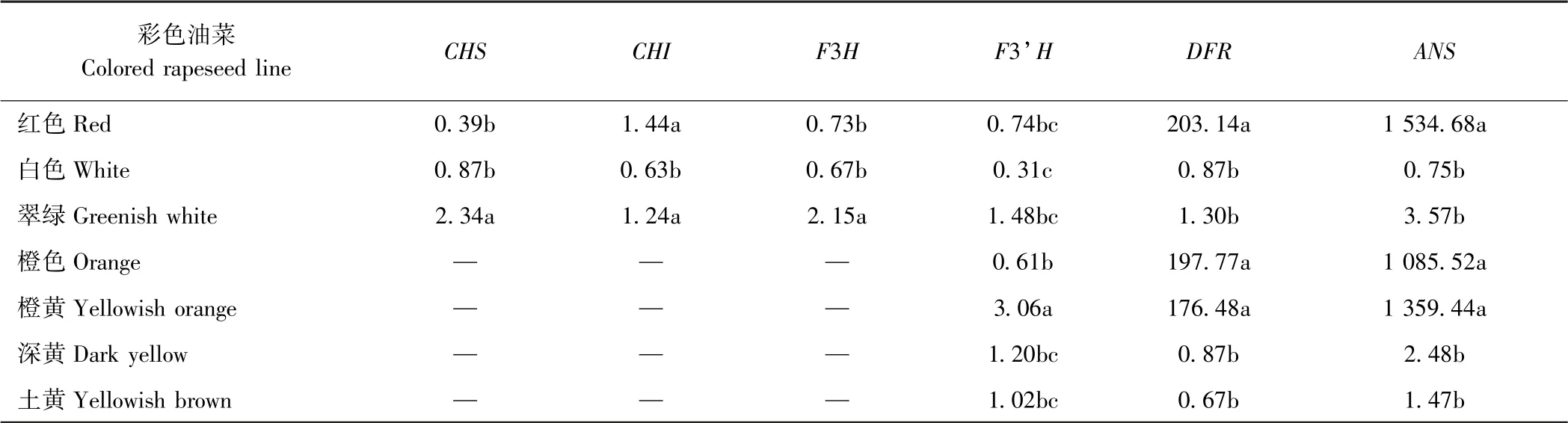
表5 彩色油菜花瓣花青素代谢关键基因表达量分析Table 5 Expression analysis of key genes in the anthocyanin biosynthesis in colored rapeseed lines
2.5 花青素合成与基因表达量的相关性分析
由表6可知,ANS和DFR的表达量与彩色油菜花瓣的花色苷含量呈正相关。ANS表达量与花色苷含量的相关性达到0.69,但不显著,而DFR的表达量与花色苷含量显著相关,相关系数达0.80。ANS基因和DFR基因的表达量极显著相关,以上结果说明随着花瓣颜色从白色、黄色向橙色、红色转化,花色苷的积累与花青素合成关键基因ANS和DFR密切相关。
3 讨论
彩色油菜作为赏-油兼用型经济作物在油菜种植区域具有较大的应用潜力,如长江流域冬油菜区和甘肃、青海、内蒙等春油菜区。近期,部分研究者新育成了红色系、橙色系和紫色系等多种色系的彩色油菜,突破了彩色油菜花瓣色彩只有黄色系和白色系的限制,加快了彩色油菜在生产上的进一步应用。
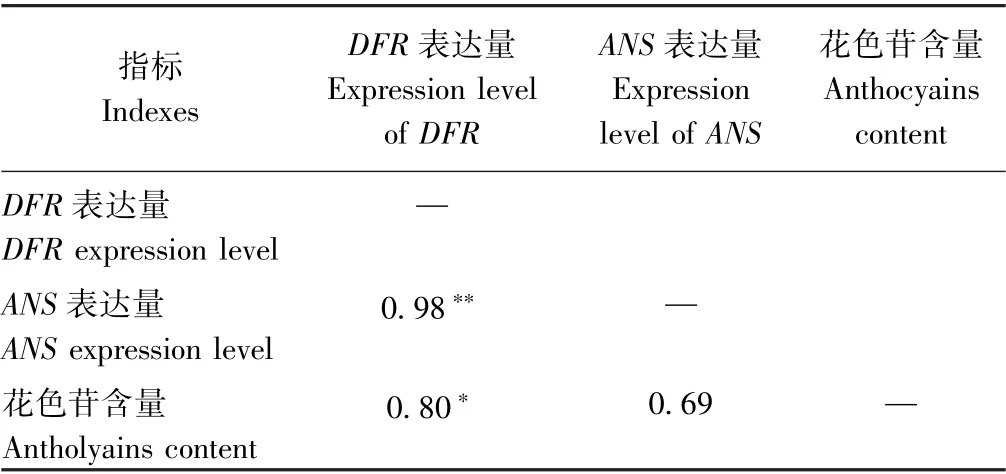
表6 DFR、ANS 平均表达量和花色苷含量相关性分析Table 6 Correlation analysis among the expression level of DFR,ANS and anthocyains content
目前鲜有关于油菜花瓣色素方面的研究报道。曾德志等[18]对白花、黄色深浅程度不同的油菜花瓣中类胡萝卜素成分进行分析,发现常规黄色油菜花瓣积累大量类胡萝卜素,其成分以番茄红素为主。因此,番茄红素可能是影响黄色油菜花瓣色素的主要因素。然而,该结果是基于白色和黄色系油菜花瓣的色素成分研究而得出,未涉及橙色系和红色系油菜。田间观察发现,黄色系中的常规黄色、土黄和深黄色花瓣颜色稳定,花瓣白色和翠绿在一定程度上会发生转化,但红色和橙色系油菜花瓣中的颜色容易褪色(图3),说明红色和橙色花瓣中的色素成分可能与黄色系不同,且具有花青素的特征。基于此,本研究对红色系、橙色系、黄色系和白色系油菜花瓣中的色素成分、催化色素合成关键酶活性和编码色素合成关键酶活性基因的表达量进行了系统分析和比较。
植物花瓣能够呈色的次生代谢物质种类较多,如单宁类的原花青素是许多水果表皮(如葡萄)等呈色的主要化合物之一[19-21]。本研究中,尽管各色系花瓣中能够积累大量的酚类物质,但单宁类化合物含量较少,而且与细胞呈色有关的原花青素在黄色系和白色系中未检测到,说明这两种色系花瓣中不合成原花青素。因此,在黄色和白色系油菜花瓣中以积累原花青素途径显现红色至紫色的可能性较低。相反,红色油菜的花瓣中原花青素含量非常高,总量超过了1 000 μg·g-1FW,说明红色和橙色油菜花瓣显色的色素可能为原花青素和花青素的混合色素;而橙黄色油菜则以花青素为主。介于红色和橙色的衍生系油菜花瓣的呈色代谢与红色和橙色发生了一定程度的改变,主要表现为这些衍生系花瓣中的原花青素含量降低;花色苷含量则有升有降。这可能是由于红色和橙色与黄色和白色油菜杂交过程中,渗入了与花色素代谢相关的基因所致,其具体机理还需要结合遗传学手段加以验证。除了酚类物质,彩色油菜花瓣中还积累了大量的类黄酮色素,一部分用于花瓣显色,可吸引昆虫,助其授粉[22-23];一部分则可能合成香气,释放强烈的特殊香味[24-25];还有一部分黄酮类物质作为抵御外界病虫的侵害和逆境而起作用[26-27]。本研究中检测到的花色苷含量占类黄酮含量并不高,说明在油菜花瓣中用于呈黄色和白色之外颜色的色素物质仅占一小部分。
通过液质联用仪进一步检测发现红色和橙色油菜花瓣中的花青素成分并不一致。红花油菜以矢车菊素为主,而橙色油菜以芍药素为主。不同的色素成分可能是导致红色和橙黄色油菜花瓣最终呈色不同的重要原因。矢车菊素是许多果实如桑葚,蓝莓、樱桃等果实的主要色素成分,其颜色多为红色[28]。而芍药素在pH 值3.0 时,呈现强烈的橙红色,但pH 值不是呈色的唯一条件[29]。此外,本研究对花瓣可能呈红色的类胡萝卜素成分也进行了检测,结果显示番茄红素、α-胡萝卜素和β-胡萝卜素含量均很低。红色油菜花瓣中的矢车菊素和橙色油菜花瓣中的芍药素是番茄红素的300 倍和700 倍以上,因此,推断红色和橙色油菜花瓣呈色过程中,类胡萝卜素所起作用较小。在黄色油菜花瓣中各种类胡萝卜素含量也不高,这与前人研究结果并不一致[18],可能是取样时期不一致造成的。值得注意的是,前人研究认为黄色油菜花瓣呈现黄色的主要色素为番茄红素,其含量最高达到200 μg·g-1FW[20],或者类胡萝卜素总量,最高为700 μg·g-1FW 左右,本研究中,黄色油菜花瓣中检测到较高含量的矢车菊素,与其他花瓣中含有一定量的花色苷一致(>500 μg·g-1DW),但花瓣仍然是黄色。其未能呈其他色彩的原因可能与黄色花瓣和红色或橙色花瓣的呈色环境和调控机理不相同有关,如花瓣细胞中的pH 值、金属离子种类和数量等[30]。黄色油菜花瓣呈现黄色可能是大量类黄酮物质积累和某些类胡萝卜素成分共同作用所致。由于白色油菜花瓣中原花青素和花色苷等显色物质均未检测到,因此,其花瓣中的酚类和类黄酮物质的主要作用可能不是使花瓣显色。张豹[31]采用图位克隆技术,克隆到控制白色油菜花瓣色素形成的类胡萝卜素裂解双加氧酶基因,进一步证实了白色油菜花瓣色素很有可能不是原花青素和花青素。
为了进一步了解红色和橙色油菜花瓣中花青素的呈色机理,对花青素合成的关键酶活性和编码这些关键酶类基因的表达进行了研究。红色和橙色油菜花瓣中DFR和ANS表达量非常高,与花青素含量相关。然而,花青素合成途径过程的早中期基因如CHS、CH1、F3H等表达量在红色、白色等油菜花瓣中很低,因此推断,红色和橙色系油菜花瓣花青素积累的差异发生在后期催化花青素的合成步骤上。这与前人研究结果一致。Fu 等[32]通过转入OvPAP2 基因,导致黄色油菜花瓣部分显现红色,且诱导DFR和ANS基因的表达量剧增。紫色甘薯薯块在花青素大量积累阶段,DFR基因表达也随之上调[33]。本研究在检测花青素合成的关键酶DFR 和ANS 活性时发现,各色系油菜花瓣中的差异不显著,其与基因表达不一致的可能原因较多,如DFR 和ANS 基因合成酶的过程中受到磷酸的调控,导致酶活性在不同花色油菜花瓣中无显著差异[34]。
本研究虽然明确了红色系和橙色系油菜花瓣中的主要花青素成分,但因涉及到呈色的复杂性,有必要通过生物技术手段,如RNAi、基因组编辑,将花青素合成关键基因敲除,进一步明确彩色花瓣的呈色机理,为彩色油菜育种提供理论依据。
4 结论
本研究通过对彩色油菜花瓣色素成分的分析,明确了彩色油菜花瓣中含有丰富的酚类物质和黄酮类物质。红色和橙色油菜花瓣含有大量的原花青素和花色苷;红色和橙色油菜衍生系花瓣中则主要以花色苷为主。白色系油菜花瓣中不含原花青素和花色苷,黄色系油菜花瓣中也不含原花青素,但含有少量的花色苷。各色系油菜花瓣中的类胡萝卜素以番茄红素为主,但其含量很低。红色油菜花瓣的花青素主要成分为矢车菊素,而橙黄色和黄色油菜花瓣中的花青素主要成分为芍药素。红色和橙色油菜花花青素合成过程中,DFR和ANS表达量激增,分别是黄色油菜花的1 000倍和100 倍以上,表明红色和橙色油菜花瓣与花青素的合成有密切关系。本研究为彩色油菜采用基因改良油菜花色和育种提供了理论依据。
