TRV介导的葡萄叶片VvANR基因瞬时表达分析
2021-04-15刘海霞牛铁泉张鹏飞梁长梅赵旗峰温鹏飞
杨 波 刘海霞 牛铁泉 张鹏飞 梁长梅 赵旗峰 温鹏飞
(1山西农业大学园艺学院,山西 太谷 030801;2山西农业大学信息科学与工程院,山西 太谷 030801;3山西农业大学果树研究所,山西 太谷 030801)
葡萄(Vitis viniferaL.)是世界上重要的经济作物之一[1],其果实、叶片富含多酚类物质,具有防癌、抗癌的功能。目前,葡萄叶片已被广泛用于止血、止痛、消炎和止泻[2],在欧洲,已被广泛用于制药、化妆品、茶和其他食品的生产中[3]。原花青素(proanthocyanidin,PA)作为重要的一种多酚类物质,广泛存在于葡萄果实、种子[4]和叶片[5]中,具有明显的保健功能,可有效降低患心血管疾病的风险,具有一定的药理和治疗功能[6]。
原花青素的生物合成受到结构基因(如VvDFR、VvANR、VvLAR1、VvLAR2 等)及调节基因的调控。二氢黄酮醇还原酶(dihydroflavonol-4-reductase,DFR)催化二氢黄酮醇形成无色花青素(leucoanthocyanidin),花色素合成酶(anthocyanidin synthase,ANS)将无色花青素转变为花青素(anthocyanidin),无色花青素和花青系分别经隐色花色素还原酶(leucoanthocyanidin reductase,LAR) 和花色素还原酶(anthocyanidin reductase,ANR)催化形成原花青素[7]。其中ANR 作为原花青素合成关键酶,可催化花青素还原形成表儿茶素,在生物合成途径的下游发挥关键作用[8]。
病毒诱导基因沉默技术(virus induces gene silencing,VIGS)是一种快速、经济的反向遗传技术[9]。作为植物中广泛应用的一种瞬时表达技术,VIGS 是基于植物病毒的特性来触发与转录后基因沉默相关的防御机制(post-transcriptional gene silencing,PTGS),引发内源基因沉默,可通过下调基因表达和分析产生的表型的方法来研究基因功能[10]。该技术用于检测目的基因功能[11],容易分析出突变分析无法研究的植物生存所需的关键代谢和调节基因[12]。VIGS 避开了植物转化,方法简单[13],已被研究者广泛采用,沉默后表现生长迟缓、发黄和光漂白现象[14]。VIGS 侵染方式及侵染部位多种多样,可用于研究包括花冠[15]、花瓣[16]、果实[17]、叶片[18]在内的多种植物器官的基因功能。VIGS 病毒载体也有很多,在小麦[19]、大麦[20]、燕麦[21]、玉米[22]等单子叶植物上常采用大麦条纹花叶病毒(Barley stripe mosaic virus,BSMV)为病毒诱导基因沉默载体,香蕉[23]、草莓[24]等草本植物采用黄瓜花叶病毒(Cucumbermosaicvirus,CMV),水稻[25]、狗牙草、结缕草[26]等草本植物采用水稻东格鲁杆状病毒(Rice tungro bacilliform virus,RTBV)。研究发现,烟草脆裂病毒(Tobacco rattle virus,TRV)载体可以克服宿主范围窄的缺点,是目前使用最广泛的VIGS 病毒载体[27],也成为植物中最常用的VIGS 载体[28],在柑橘[28]、棉花[29]、甜樱桃[30]、大豆[31]、番茄[32]等双子叶植物以及灌木牡丹[33]、桑树[34]等植物中均有报道。在葡萄上,利用农杆菌介导微繁殖葡萄可以沉默葡萄试管苗的PDS基因[35],但利用TRV 介导的VIGS 技术开展葡萄次生代谢研究,特别是原花青素合成关键基因VvANR鲜见报道。
本研究利用TRV 介导的基因沉默技术,构建携带VvANR特异基因序列的TRV 载体,通过真空侵染和主叶脉针孔注射法两种方式对葡萄叶片中ANR基因进行沉默并对基因沉默后葡萄叶片进行表型观察,旨在建立葡萄叶片的TRV-VIGS 系统,进而丰富和完善原花青素积累机制。
1 材料与方法
1.1 材料
前期研究发现,在无核早红、早黑宝等葡萄叶片中进行VIGS 侵染,早黑宝叶片侵染漂白表型变化较为明显,故选用山西省农业科学院果树研究所育成的四倍体欧亚种鲜食品种早黑宝为试验材料。早黑宝葡萄栽植于山西农业大学园艺站温室,篱架,株行距2.5 m×1.0 m,常规管理。2019年7月17日15 时分别采集带茎新梢作为侵染材料,现采现用。
VIGS 烟草脆裂病毒载体pTRV1 与pTRV2,根癌农杆菌菌种GV3101 及实时荧光定量引物(表1)由山西农业大学园艺学院实验室保存。克隆载体pMD18T、D2000 Marker、限制性内切酶EcoRⅠ、BamHⅠ购自北京宝日医生物技术有限公司,DH5α 大肠杆菌感受态购自北京全式生物公司,凝胶回收试剂盒、质粒中提试剂盒购自北京天根公司,反转录试剂购自北京索莱宝生物科技公司。
1.2 方法
1.2.1 载体构建 设计特异性引物(VvANR-F:5′-CGGGATCCAGTCTCCATTGCACATG-3′,VvANR-R:5′-CGG AATTCTCAATTCTGCAATAGCC-3′,划线处为酶切位点),以本实验室前期反转录获得的葡萄叶片cDNA(浓度100 ng·μL-1)为模板,94℃预变5 min、变性30 s,55.1℃退火30 s,72℃延伸50 s,34 个循环后再延伸5 min,PCR 扩增出307 bp 的VvANR片段,割胶回收此片段作为插入目的片段,16℃过夜连接克隆载体pMD18T,提取验证正确序列的克隆载体pMD18T-ANR质粒。经EcoRⅠ和BamHⅠ双酶切,将VvANR基因片段反向插入pTRV2 中过夜连接获得重组pTRV2-ANR质粒并转入大肠杆菌DH5α 转感受态细胞中,双酶切验证,华大基因科技股份有限公司测序,转入农杆菌GV3101 感受态中保存备用。
1.2.2 葡萄叶片病毒诱导基因沉默 取pTRV1、pTRV2、pTRV2-ANR的农杆菌菌液各10 μL 接种到2 mL 的LB(Luria-Bertani)液体培养基(含50 mg·L-1卡那霉素)中,28℃、200 r·min-1活化17 h。将菌液活化后转接到70 mL 的LB 液体培养基(含50 mg·L-1卡那霉素)中,28℃、180 r·min-1培养6 h 左右。当OD600约为1.0 时,取50 mL 菌液,4℃、5 000 r·min-1离心5 min,收集菌液,在含200 μmol·L-1乙酰丁香酮、10 mmol·L-1氯化镁和10 mmol·L-12-吗啉乙磺酸的诱导液中重悬菌液,计算并调整重悬菌液OD600至1.0。将pTRV1 菌液与pTRV2 菌液以等体积(1∶1)混合作为对照组,pTRV1 菌液与pTRV2-ANR菌液以等体积(1∶1)混合作为试验组,黑暗室温条件下静置3~4 h。
式中,Vt:重悬菌液终体积;N:测量吸光值时的稀释倍数;C0:稀释N倍后的浓度,以OD600表示;V0:重悬菌液初体积;Ct:重悬菌液初浓度。
采集长势健壮一致的早黑宝葡萄新梢90 个,幼嫩和成熟叶片各45 个,15 个叶片为一组,重复3 次。采用一次性无菌针孔器注射叶背主叶脉法时,左手戴一次性塑料手套,用大拇指轻轻固定叶背,右手持一次性无菌针孔器注射主叶脉,注射程度以针孔处出现液滴为宜。真空侵染法侵染葡萄幼嫩和成熟叶片10 min后取出,用滤纸轻轻擦拭叶面侵染液,将茎段插入盛有120 mL 蒸馏水的锥形瓶中,放于LED 型光照培养箱(光照强度2 000 lx,相对湿度70%,温度25℃)中16 h/8 h 光暗交替培养,待叶片漂白表型出现后用液氮速冻叶片,-80℃超低温保存待用。
1.2.3 原花青素含量测定 原花青素测定采用正丁醇-盐酸法[36]并稍作修改,总酚提取参照陈建业[37]的方法。取总酚提取上清液50 μL,加入3.5 mL 正丁醇-盐酸混合液(含0.3 g·L-1硫酸亚铁)和1 mL 65%丙酮溶液,加热煮沸30 min 后迅速放入冰盒降温,室温放置25 min 后在550 nm 下测定其吸光值,按标准曲线计算总酚提取液中的原花青素含量。
1.2.4VvANR基因瞬时表达分析 采用改良CTAB法[38]提取空载体pTRV1:pTRV2 和pTRV1:pTRV2-ANR侵染的阳性早黑宝葡萄叶片的总RNA,去除基因组DNA,反转录获得cDNA,利用实时荧光定量PCR分析pTRV2-ANR侵染后VvANR基因的相对表达量及其相关基因VvDFR、VvLAR1、VvLAR2、VvANS、VvUFGT、VvMYBPA1、VvMYBPA2 表达量,以空载体pTRV1:pTRV2 作为对照。以葡萄Actin为内参基因。参照TB Green Premix Ex Taq Ⅱ北京宝日医生物技术有限公司试剂盒说明,95℃预变性1 min;95℃变性30 s,55℃复性30 s,45 个循环,72℃收集荧光30 s,2-△△CT法计算基因相对表达量。
1.2.5 数据统计分析 采用Excel 2019 软件进行数据处理,使用SAS 8.0 软件进行差异显著性分析,P<0.01 代表极显著性差异,P<0.05 代表显著性差异。
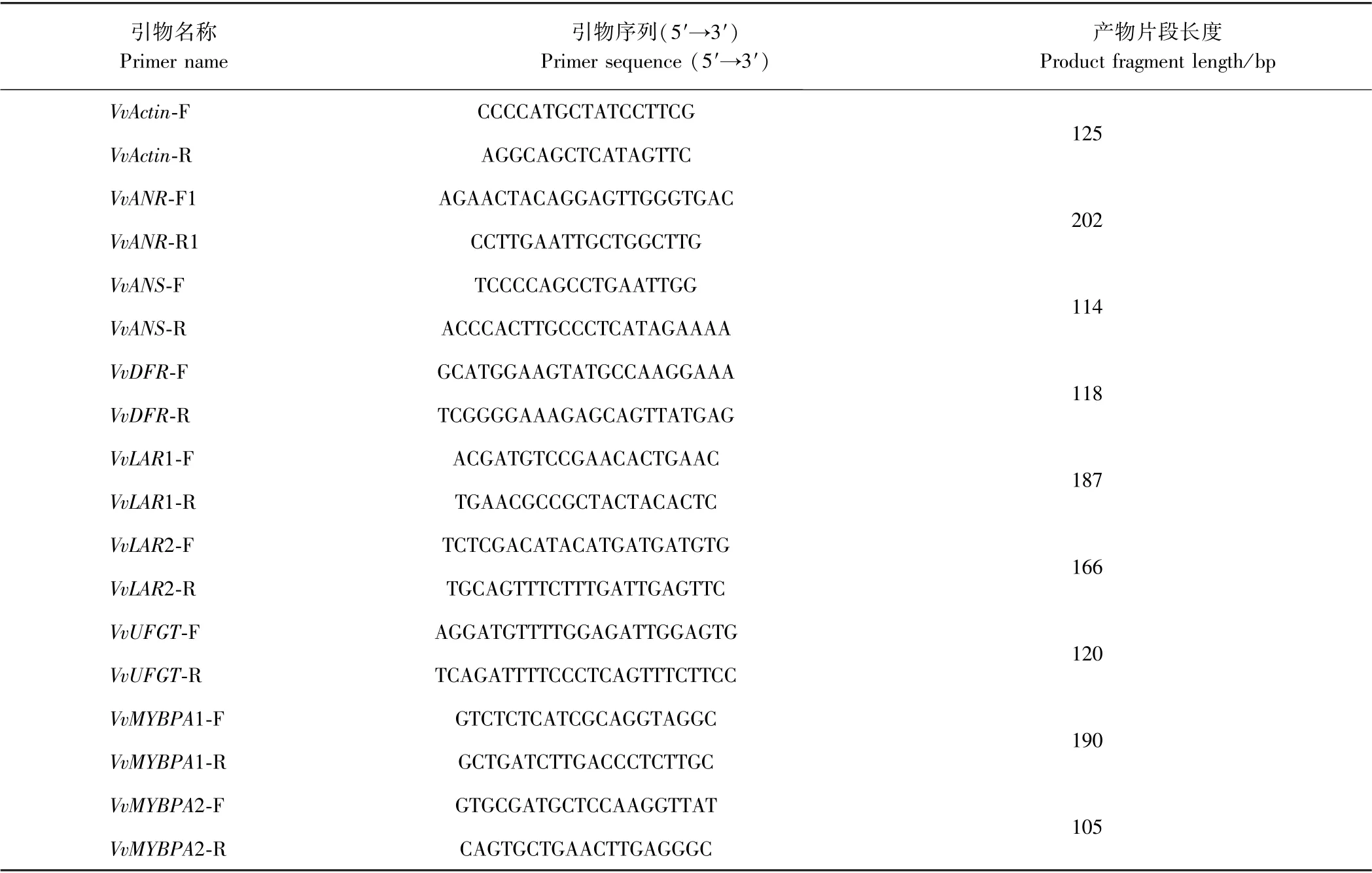
表1 实时荧光定量PCR 引物序列Table 1 Real-time fluorescence quantitative PCR primer sequence
2 结果与分析
2.1 pTRV2-ANR 载体构建
以葡萄叶片cDNA 为模板,利用特异性引物VvANR-F/VvANR-R扩增出大约307 bp 的ANR片段(图1-A),将扩增的ANR片段回收后连接克隆载体pMD18T(图1-B),16℃过夜连接,成功构建pTRV2-ANR载体,并经EcoRⅠ和BamHⅠ双酶切验证(图1-C),测序一致性达91.53%(图1-E)。将含有pTRV2-ANR载体的质粒转入农杆菌GV3101 并进行菌液PCR鉴定,结果显示扩增出ANR的目标片段(图1-D),表明pTRV2-ANR载体构建成功且转入农杆菌GV3101中。
2.2 pTRV2-ANR 沉默表型
2.2.1 幼嫩叶片表型 真空侵染后早黑宝幼嫩叶片表型变化如图2所示。6 d 后,叶片出现轻微漂白现象,侵染15 d 后幼嫩叶片几乎全部漂白。主叶脉针孔注射幼嫩叶片表型变化如图3所示。侵染17 d 后,幼嫩叶片出现漂白现象,在注射处沿主叶脉逐渐扩展到整个叶面,25 d 后,叶片几乎全部漂白。
2.2.2 成熟叶片表型变化 真空侵染后早黑宝成熟叶片表型变化如图4所示。7 d 后,叶片出现漂白现象,侵染15 d 后,成熟叶片出现大面积漂白。主叶脉针孔注射成熟叶片表型变化如图5所示。侵染19 d后,成熟叶片出现漂白现象,25 d 后,叶片几乎全部漂白。
2.3 原花青素含量
分别采用真空渗透法和主叶脉注射法沉默VvANR后,葡萄叶片中原花青素含量如图6、图7所示。真空侵染早黑宝幼嫩叶片和成熟叶片15 d 后,主叶脉针孔注射幼嫩叶片和成熟叶片25 d 后,原花青素含量相比对照下降,表现极显著差异(P<0.01)。
2.4 VvANR 基因及相关基因瞬时表达量分析
2.4.1VvANR基因表达分析 实时荧光定量PCR 结果表明,pTRV2-ANR沉默后,叶片中VvANR表达量极显著降低(图8),表明本试验所采用的真空渗透/主叶脉注射法,利用TRV 导致葡萄叶片中目标基因瞬时表达量显著降低,成功实现了目标基因沉默。
2.4.2VvDFR、VvANS、VvLAR1、VvLAR2 表达分析 葡萄中,二氢黄酮醇还原酶(DFR)催化合成无色花色素,同时为ANS、LAR 提供合成底物[7]。沉默VvANR后,VvDFR表达量略有增加(图9-A),但差异不显著,表明VvANR表达降低对VvDFR表达影响不大,或者说VvANR对VvDFR表达不存在调控作用。花色素合成酶ANS 作为ANR 的上游酶,催化合成花青素,为ANR提供合成底物。VvANR沉默后,VvANS表达量上调,但差异不显著(图9-B)。表明VvANR下调并未影响VvANS的表达。
隐色花色素还原酶(LAR)以无色花色素为底物,催化合成(+)-儿茶素,为原花青素合成提供底物。VvANR沉默后,VvLAR1、VvLAR2 表达量明显降低,且差异极显著(图9-C、D)。表明VvANR表达与VvLAR1、VvLAR2 表达存在协同,推测可能是由于ANR 催化产物表儿茶素和LAR 催化产物儿茶素均是原花青素的合成底物,同时原花青素中儿茶素、表儿茶素组成因物种而不同[39],说明VvANR表达与VvLAR1、VvLAR2 表达密切相关。
2.4.3VvUFGT表达 类黄酮葡萄糖基转移酶(UDPglucose:flavonoid-3-O-glucosyltransferase,UFGT) 以ANS 合成的花青素为底物,使不稳定的花青素转变为稳定的花色苷[39-40]。沉默VvANR后,VvUFGT表达量下调,且差异显著(图10),表明VvANR表达降低对VvUFGT表达具有一定的调控作用。其原因可能是,VvANR沉默使ANR 的活性降低,而UFGT 与ANR 竞争同一底物ANS,底物过量抑制了UFGT 的表达,导致VvUFGT表达降低,或者可能在沉默VvANR后,诱使VvUFGT表达降低的调节基因下调了VvUFGT表达。
2.4.4 转录因子VvMYBPA1、VvMYBPA2 表达 原花色素合成特异性转录因子VvMYBPA1、VvMYBPA2 表达量下调,差异极显著(图11)。这可能是由于VvANR表达极显著下调后,导致原花青素生物合成因表儿茶素底物不足而受抑。表明VvANR作为原花青素合成中的关键结构基因,对整个原花青素的生物合成具有决定性的作用。
3 讨论
前人研究表明,葡萄病毒A(Grapevine virus A,GVA)可用于沉默烟草植物内源八氢番茄红素去饱和酶(phytoene desaturase,PDS)基因[35],通过根癌农杆菌接种体外微繁殖植株,而不是通过接种叶片或其他地上器官来建立病毒感染[41]。农杆菌介导接种微繁殖葡萄可以沉默内源PDS基因。PDS 是光合作用过程中类胡萝卜素合成的关键酶,沉默PDS会引起沉默区域失绿,因此常作为VIGS 体系的指示基因。相比之下,TRV 具有高度易感性[42],体内外均可建立病毒感染。本试验首次建立了葡萄叶片的TRV-VIGS 系统,证实了利用TRV 介导VIGS 载体接种葡萄叶片,可达到沉默葡萄VvANR基因的效果。农杆菌介导接种可以通过农杆菌注射、真空侵染等多种方式来实现[43]。本研究分别采用真空侵染法和针孔主叶脉注射法在葡萄叶片接种TRV-VIGS 构建体,实现了VvANR基因沉默。
真空侵染法是一种高效的渗透方法。相比拟南芥摩擦接种后7~10 d 观察到白化表型[44],本研究真空侵染葡萄叶片6~15 d 即可观察到漂白现象。这与Zhang 等[45]的结果相似,真空侵染极大地增加了VIGS有效性和持续时间[26],比摩擦接种方式具有更完全的渗透效果,其侵染效果可能受植物叶龄的影响,叶龄太年轻或太年老会导致沉默效率低下[46]。VIGS 不仅用于成熟叶片的研究[47]。幼嫩植物的研究发现,在番茄2~3 片真叶期,农杆菌渗透14 d 开始出现漂白,20 d出现特征性光漂白[48]。本研究发现,葡萄幼嫩叶片对真空渗透非常敏感,侵染6 d 即出现叶片漂白,比成熟叶片漂白现象出现较早,且侵染15 d 后,幼嫩叶片比成熟叶片表现更均匀的特征性漂白现象。表明幼嫩叶片比成熟叶片更容易受到VIGS 的侵染,这与Wang等[18]和Zhang 等[45]的研究结果相同。
本研究采用的主叶脉针孔注射法,用于葡萄叶片基因沉默的研究,与叶柄、茎干注射2~3 周会引发沉默的结果相似[49],可达到基因沉默。且辣椒在叶片主静脉两侧打孔,21 d 后出现沉默[50],而本研究葡萄幼嫩叶片、成熟叶片分别于17、19 d 出现漂白沉默,两者出现沉默的时间均较早于叶背注射法,且幼嫩叶片出现沉默时间早于成熟叶片。前者可能是主叶脉疏导组织输送病毒的能力比叶肉细胞强,病毒沿主叶脉快速到达各个分支叶脉,再扩展至整个叶片的叶肉细胞。后者可能由于幼嫩组织生长能力强于成熟组织,病毒蔓延能力也随之快于成熟组织。由主叶脉针孔注射的表型变化可见,沉默从注射处开始,逐渐扩展到整个叶面直至全部漂白,这与Jeyabharathy 等[51]的研究结果类似。
此外,沉默效应在大多数情况下都是短暂的,其出现及持续时间因物种而异。例如,棉花、玉米幼苗[52]分别在2~3 周、10 d~3 周观察到表型,大麦的VIGS效应会持续1~2 周。本试验发现葡萄叶片真空侵染、主叶脉注射的沉默效应分别能持续6~15 d、17~25 d。相较之下,真空侵染比主叶脉注射出现沉默的时间较早,沉默持续时间稍长。沉默不同组织(如营养组织和生殖组织)的表型不同,沉默效应也通常在整株植物的部分或者几个相连的植物器官中出现[53]。无效病毒的运动可以通过维持有利于系统病毒运动的条件来解决VIGS 不均匀或局部化[54]。例如,Burch-Smith等[55]为了在拟南芥中达到高效的沉默效果,均匀地手工接种整个叶片,而不使叶片老化。但对于2 周龄相对较小的真叶,手工接种通常会导致幼苗逃避接种或严重受伤。本研究通过主叶脉注射法能有效避免叶片的叶肉组织严重受伤,病毒从主叶脉较快且较均匀地沿网状脉序蔓延至整个叶片,并可实现长期沉默,25 d后叶片不枯萎老化。
Jochen 等[56]发现葡萄叶片中编码ANR、LAR 和LDOX 的基因在叶片生长过程中积累PA。烟草中的异位表达证实VvANR会导致PAs 相应增加,趋向于原花青素合成方向,ANR和LAR基因表达相应增加。同时,VvANR在全叶叶片发育中表达较高[56]。本研究表明,VvANR沉默后,幼嫩叶和成熟叶的原花青素含量均显著降低,VvANR基因表达量相比对照也显著降低,证实ANR 是导致原花青素积累的分支酶,正向调控催化原花青素生物合成。此外,VvANR沉默极显著降低了VvLAR1、VvLAR2 表达量,也导致其下游基因VvUFGT表达量显著降低。而其上游基因VvDFR和并列基因VvANS表达量略有上调,但差异不显著。表明,VvANR沉默后对原花青素生物合成结构基因都存在明显的抑制作用,或者说VvANR对VvLAR和VvUFGT具有一定的调节作用。
Jochen 等[57]研究表明,VvMYBPA1 激活原花青素特异性分支基因VvANR和VvLAR1,而VvMYBPA2 对VvMYBPA1 的功能发挥也起到一定的协同作用。因此,VvMYBPA1 能通过调节VvANR的表达,从而影响原花青素的含量。本研究结果表明,VvANR沉默后,VvMYBPA1、VvMYBPA2 表达量极显著降低。这表明特异性分支基因VvANR对VvMYBPA1、VvMYBPA2 表达具有一定的作用,可能存在反馈调节。推测其原因可能为,VvANR沉默导致VvDFR表达上调,其他MYB 类转录因子VvMYB5a、VvMYB5b等与VvMYBPA1、VvMYBPA2 竞争性表达,从而抑制了VvMYBPA1、VvMYBPA2 的作用。
4 结论
本研究建立了葡萄叶片的TRV-VIGS 系统。真空侵染和主叶脉注射均能在葡萄叶片中实现TRV 介导的基因沉默。主叶脉注射法侵染葡萄幼嫩叶片和成熟叶片,能短时间内迅速漂白,漂白耗时少于真空侵染法。VvANR沉默后,叶片中原花青素含量极显著降低,VvANR基因瞬时表达量极显著降低;VvANR可能对VvDFR、VvANS不具有调控作用,但其对VvLAR和VvUFGT具有一定调节作用,且VvANR对原花青素调节基因VvMYBPA1、VvMYBPA2 具有反馈调节作用。
