百香果低温胁迫转录组及茉莉酸代谢基因分析
2021-04-15韦晓霞王小安赖瑞联吴如健
韦晓霞 王小安 陈 瑾 赖瑞联 吴如健
(福建省农业科学院果树研究所,福建福州 350013)
百香果(Passiflora eduliaSims)也称鸡蛋果、紫果西番莲、黄果西番莲,广泛种植于我国热带与亚热带地区,其果实多汁、香气浓郁,且富含类黄酮、生物碱等生物活性成分,是一种广受欢迎的水果[1]。此外,百香果花大而独特,多样性丰富,具备较好的观赏价值。因此,百香果是一种兼具食用、药用与观赏价值的藤本果类,具有较高的研究开发价值。百香果种植于高纬度或高海拔地区易遭受低温冻害,即使在现有主产区,也常受到异常极端低温天气的危害。低温冻害已成为百香果产业面临的重要限制因子,影响其产业的可持续发展和辐射推广。然而,目前百香果的研究主要集中在引种、栽培、果实品质以及采后加工等方面[1-3],在抗寒和低温胁迫方面的研究较少[4-6]。在已有报道中,陈颖等[7]研究了百香果在低温胁迫下生理生化及显微结构变化,认为低温预冷是提高其抗冻性的有效措施之一;董万鹏等[6]研究发现在一定温度范围内随着处理温度的下降,百香果枝条中相对电导率、可溶性糖及脯氨酸含量呈上升的趋势,抗寒性较好的叶片栅/海比例较高、组织结构较为紧密以及具有更大的叶脉突起且叶脉厚而叶片薄的结构特点。然而,关于百香果低温胁迫响应或抗寒机理方面的研究较少,一定程度上影响了生物技术手段在百香果育种和产业中的应用。
低温寒害是热带亚热带作物产业中普遍存在的自然限制因子。研究表明,植物受到冷胁迫后,能够诱导一系列的信号转导,启动或抑制相关基因的表达,从而改变细胞膜特性、调节气孔开闭以及调控脯氨酸等物质的合成与降解等,进而提高植物的抗寒能力[8-10]。水稻细胞膜上的低温感受器能够在感知低温刺激后触发钙信号产生,进而对钙/钙调素调控类受体激酶(calcium/calmodulin-regulated receptor-like kinase,CRLKs)、钙依赖性蛋白激酶(Ca2+-dependent protein kinases,CPKs)、钙调磷酸酶B 类蛋白(calcineurin Blike protein,CBLs)、钙调磷酸酶B 类蛋白激酶(CBLinteracting protein kinase,CIPKs)的表达水平产生影响,然后通过ICE1(inducer of CBF expression1) 或CAMTA(calmodulin-binding transcription activator)等转录因子影响相关基因表达[11];植物中SnRK2s(sucrose non-fermenting-related protein kinase 2s)在收到低温信号后可通过直接调控ICE1 或间接调控HOS1(high expression of osmotically responsive genes 1)转录[12],ICE1 再通过CBFs(C-repeat-binding factors)调控下游COR(cold-regulated gene)的表达水平,从而响应低温胁迫[13]。此外,MYBs(v-myb avian myeloblastosis viral oncogene homolog transcription factors)、WRKYs(WRKYtype transcription factors) 及ZATs(zinc finger protein transcription factors)等转录因子家族在植物抗寒或低温胁迫响应过程中也发挥了重要作用[14]。
茉莉酸(jasmonic acid,JA)是植物体内非常重要的一类激素。在香蕉(Musa nanaLour.)[15]、水稻(Oryza sativaL.)[16]、菠菜(Spinacia oleraceaL.)[17]及甜瓜(Cucumis meloL.)[18]等植物上的研究表明,茉莉酸类物质可以提高植物对冷胁迫的抗性,且能够与脱落酸(abscisic acid,ABA)代谢途径相互影响[19]。植物茉莉酸代谢过程较为明确,其中丙二烯氧化物合成酶(allene oxide synthase,AOS)与丙二烯氧化物环化酶(allene oxide cyclase,AOC)调控茉莉酸类物质生物合成[20-24],茉莉酸氨基合酶(jasmonate resistant 1,JAR1)参与茉莉酸代谢的信号传递[25],茉莉酸信号受体蛋白(coronatine-insensitive protein 1,COI1)参与茉莉酸介导的防御响应[26],JAZ 蛋白(jasmonate ZIM-domain)参与茉莉酸信号传递且与MYB、AOC 及MYC2 存在互作关系[27-32],MYC2 转录因子(transcription factor MYC2)是茉莉酸信号传递的核心转录因子,且可与COI1 及JAZ形成复合体作为茉莉酸信号的核心模块[33],同时MYC2在ABA 信号转导途径中可能通过ABA 受体类蛋白PYL (pyrabactin resistance like )/PYR (pyrabactin resistance)建立联系[34]。目前,百香果低温胁迫下JA代谢途径在其中的响应方式鲜见报道。因此,本研究以紫果百香果为材料,开展百香果低温胁迫转录组研究,并从中挖掘JA 代谢途径相关的差异表达基因,以期为进一步研究百香果抗寒机制提供科学参考。
1 材料与方法
1.1 材料与试剂
选用同一株生长正常的百香果植株剪取枝条进行扦插,同一水平下进行管理,选择生长相对一致、苗高约为60 cm 的扦插苗为试验材料,分别进行低温胁迫处理(LT,0℃处理24 h)和常温处理(CK,25℃处理24 h)。每个处理进行3 次生物学重复。处理后采集顶端向下第3 和第4 片叶片液氮速冻,置于-80℃超低温冰箱中保存备用。
多糖多酚植物总RNA 提取试剂盒(离心柱型),北京全式金生物技术有限公司;mRNA 富集用的磁珠mRNA Capture BeadsRNA,南京诺唯赞生物科技有限公司;文库构建试剂盒NEBNext® UltraTMRNA Library Prep Kit,美国New England Biolabs 公司;逆转录试剂盒TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removel),北京全式金生物技术有限公司;实时荧光定量 PCR(quantitative real-time PCR,qRT-PCR) 试剂盒TransStart® Top Green qPCR SuperMix,北京全式金生物技术有限公司。
1.2 仪器与设备
Eppendorf 高速冷冻离心机,德国Eppendorf 公司;2720 PCR 仪,美国Thermo Fisher Scientific 公司;Vortex-Genie 2 漩涡震荡器,北京中西远大科技有限公司;BE-1100 四维旋转仪,海门市其林贝尔仪器制造有限公司;Illumina HiSeq X-Ten 高通量测序仪,美国Illumina 公司;Eppendorf Realplex4荧光定量PCR 仪,德国Eppendorf 公司。
1.3 试验方法
1.3.1 转录组文库构建和数据组装 提取样品总RNA,去除核糖体RNA 后分离纯化mRNA 样品检测合格后,基于Illumina HiSeq X Ten 测序平台,构建百香果转录组文库。使用Illumina Hiseq 高通量测序平台对cDNA 文库进行测序。对获得的数据进行质量检测,截除Reads 中的测序接头以及引物序列并过滤低质量值数据,最终获得高质量Reads。
1.3.2 基因表丰度检测与差异表达基因(differentially expressed genes,DEGs)筛选 采用Bowtie 将测序得到的Reads 与Unigene 库进行比对,根据比对结果,结合RSEM 进行表达量水平估计。利用FPKM(fragments per kilobase per million reads)值表示对应Unigene 的表达丰度。随后,采用DESeq2 进行样品组间的差异表达分析,采用Benjamini-Hochberg 方法对原有假设检验得到的显著性P值进行校正,并最终采用校正后的P值,即FDR(false discovery rate)作为差异表达基因筛选的关键指标。在筛选过程中,将FDR 小于0.01且差异倍数FC(fold change)大于等于2 作为筛选标准。其中,FC 表示两样品(组)间表达量的比值。
1.3.3 DEGs 功能注释与代谢途径富集分析 使用BLAST 软件将Unigene 序列与NR、Swiss-Prot、GO、COG、KOG、eggNOG4.5、KEGG 数据库比对,使用KOBAS 得到Unigene 在KEGG 中的KEGG Orthology结果[35],预测完Unigene 的氨基酸序列之后使用HMMER 软件与Pfam 数据库比对获得Unigene 的注释信息[36]。此外,对差异表达基因进行GO 分类[37]。
1.3.4 JA 代谢途径相关基因筛选与验证 通过分析DEGs 的功能注释,筛选百香果茉莉酸代谢途径相关基因。参照试剂盒说明书获得逆转录cDNA。根据筛选出的基因的Unigene 序列设计并合成引物进行qRTPCR。检测引物的特异性和扩增效率后,根据qRTPCR 试剂盒说明书配置反应液,20 μL 反应体系中包含反应液10 μL、10 μmol·L-1的上下游引物各0.4 μL、荧光染料Ⅰ(50×) 0.4 μL、cDNA 模板2.0 μL、ddH2O 6.8 μL。引物序列见表1。qRT-PCR 扩增程序:94℃预变性30 s;94℃变性10 s,退火15 s,72℃延伸10 s,循环40 次;之后温度回升至94℃保持15 s,随后降至60℃保持15 s,再以0.11℃·s-1的速度升温至94℃保持15 s,绘制溶解曲线。所采集的数据采用2-ΔΔCt法[38]计算基因的相对表达量。

表1 百香果低温胁迫下茉莉酸代谢途径相关基因qRT-PCR 引物Table 1 Primers for qRT-PCR of genes related to JA metabolism pathway of P.edulia under low temperature stress
2 结果与分析
2.1 测序数据组装与分析
由表2可知,CK 的碱基数量介于6.83 G~7.36 G之间,LT 的碱基数量介于6.59 G~7.35 G 之间。各样品的Q20 碱基百分比均大于98%,Q30 碱基百分比均大于94%,说明所获得的转录组数据质量较好。在碱基成分方面,GC 介于45%~46%之间。组装共得到39 521条Unigene,N50 值为1 991(5.04%),平均长度为1 145.47 bp,其中长度介于300~500 bp 的Unigene 数量为16 019,占比最大,达40.53%(表3)。由图1所示的6 个样品主成分分析(principal component analysis,PCA)结果可知,CK 与LT 分别聚为一类,即生物学重复样品间重复性好。由此可见,百香果低温胁迫转录组的组装结果的完整性较高,可用于后续分析。
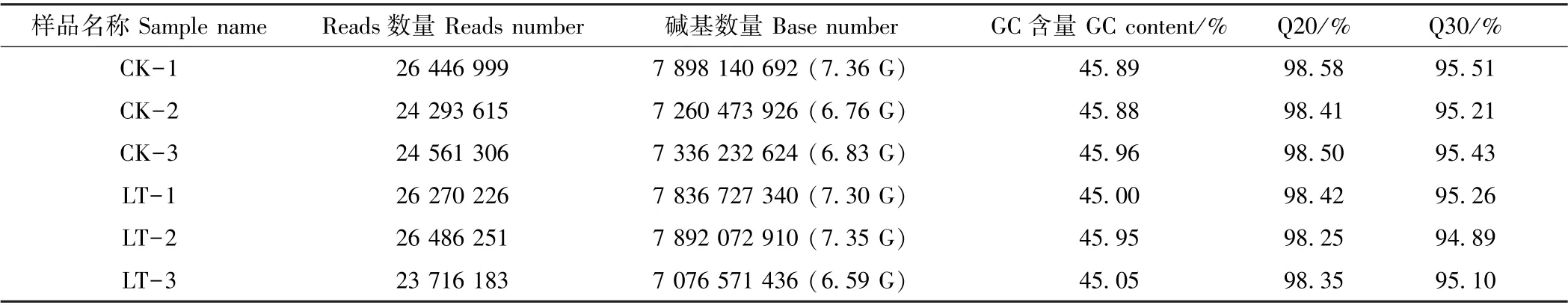
表2 样品测序数据评估统计表Table 2 Data evaluation statistics of transcriptome
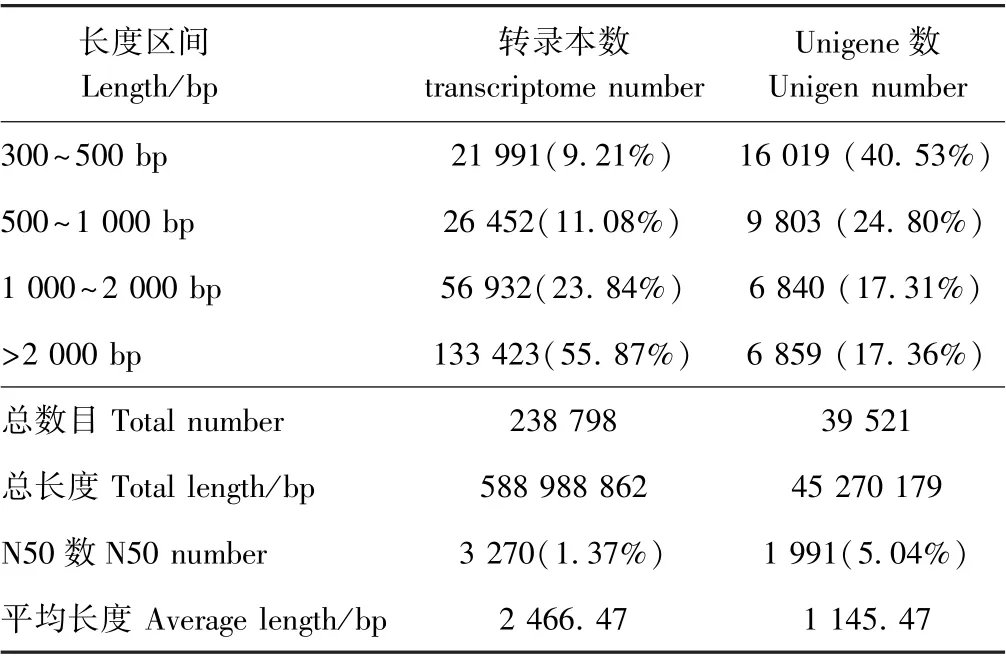
表3 组装结果统计表Table 3 Statistics of transcriptome assembly results
2.2 Unigene 注释
低温胁迫下,百香果转录组测序获得的Unigene注释结果如图2所示。最终获得28 889 个有注释信息的Unigene,占所有Unigene 的73.10%。其中长度大于等于300 bp 且小于1 000 bp 的Unigene 数量为15 756(54.54%),大于等于1 000 bp 的数量为13 133(45.46%)。在这些数据库中,COG 数据库注释Unigene 数量最少,为9 585,占比仅为33.18%;GO 数据库注释Unigene 数量为17 530,占比60.68%;KEGG数据库注释Unigene 数量为11 811,占比40.88%;KOG 数据库注释Unigene 数量为16 528,占比57.21%;Pfam 数据库注释Unigene 数量为19 865,占比68.76%;Swiss-Prot 数据库注释Unigene 数量为20 728,占比71.75%;eggNOG 4.5 数据库Unigene 数量为27 410,占比94.89%;注释NR 数据库注释Unigene数量最多,为28 755,占比高达99.54%。
2.3 差异表达基因鉴定
基于DEGs 分析结果,不同处理和生物重复间百香果转录组相关性分析结果如图3-A 所示,CK 的3 个生物重复样品与LT 的3 个生物重复样品均分别聚为一类,不同处理间转录组的相似系数介于0.573~0.761,说明转录组差异基因筛选结果较为可靠。进一步筛选,低温胁迫处理后获得百香果5 311 个DEGs(图3-B),其中LT 相对于CK 上调表达基因数量为2 533(47.69%),下调表达基因数量为2 778(52.31%)。
2.4 差异表达基因GO 分类
被GO 注释的17 530 个Unigene 中DEGs 为2 601个(14.84%)。转录组差异表达基因GO 分类结果如图4所示,被注释的Unigene 分为细胞组件、分子功能及生物过程三大类。其中,细胞组分大类可进一步分为16 个小类;分子功能大类分为15 个小类;生物过程大类分为21 个小类。
根据GO 分类结果,DEGs 数量最多的亚类为生物过程大类的代谢过程,数量为1 414,占该类型Unigene总数15.08%,包括甾醇生物合成、类黄酮糖脂化、酪氨酸代谢、L-苯丙氨酸生物合成、软木脂生物合成、芥子油苷代谢及长链脂肪-酰基辅酶A 代谢等。DEGs占该类型Unigene 总数比例最大的小类为分子功能大类中的金属伴侣蛋白活性亚类,仅包含2 个Unigene,其中一个为差异基因即细胞色素C 氧化酶基因,另一个是铜/锌超氧化物歧化酶基因。此外,生物过程大类中信号小类注释的差异基因数量为118,占该类型Unigene 比例为14.82%,包括3 个亲离子谷氨酸受体信号通路的谷氨酸受体基因,即c50649.graph_c0(GLR3.7)、c53352.graph_c0(GLR3.2)和c54428.graph_c0(GLR2.7)。
2.5 KEGG 富集分析
KEGG 富集结果中,DEGs 数量排名前十和具有显著性差异的KEGG 代谢途径如表4和表5所示。从所获得的DEGs 数量上看,百香果低温胁迫下富集的主要代谢通路包括核糖体、淀粉与蔗糖代谢、植物激素信号转导、碳代谢、氨基酸生物合成、植物与病原体互作、内质网蛋白加工、苯丙素生物合成、嘌呤代谢和内吞作用等10 种。以P值作为参考,KEGG 富集的显著性代谢通路有核糖体、淀粉与蔗糖代谢、氰胺酸代谢、植物与病原体互作、DNA 复制、植物信号转导途径、核糖体在真核生物中的生物发生、卟啉和叶绿素代谢、单萜类生物合成、牛磺酸和次牛磺酸代谢。其中,核糖体途径、淀粉与蔗糖代谢途径、植物激素信号转导途径及植物与病原体互作途径中DEGs 数量较多,且差异存在显著性,可能是参与百香果低温胁迫响应的重要代谢途径。植物激素信号转导在多种植物抗寒或低温胁迫响应过程中均发挥了重要生物学功能。为进一步研究百香果激素信号途径响应低温胁迫的机制,本试验对低温胁迫下该途径的DEGs 进行了分析。
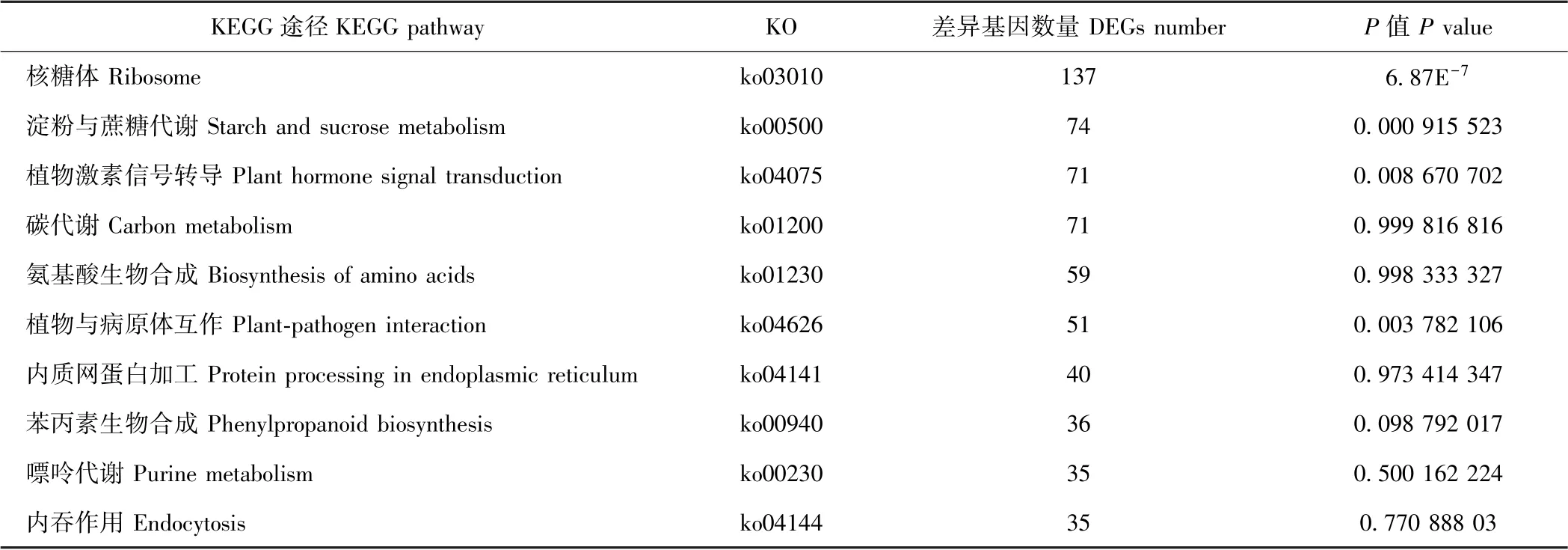
表4 差异基因数量前十的KEGG 代谢途径Table 4 Top 10 KEGG pathways of DEGs number
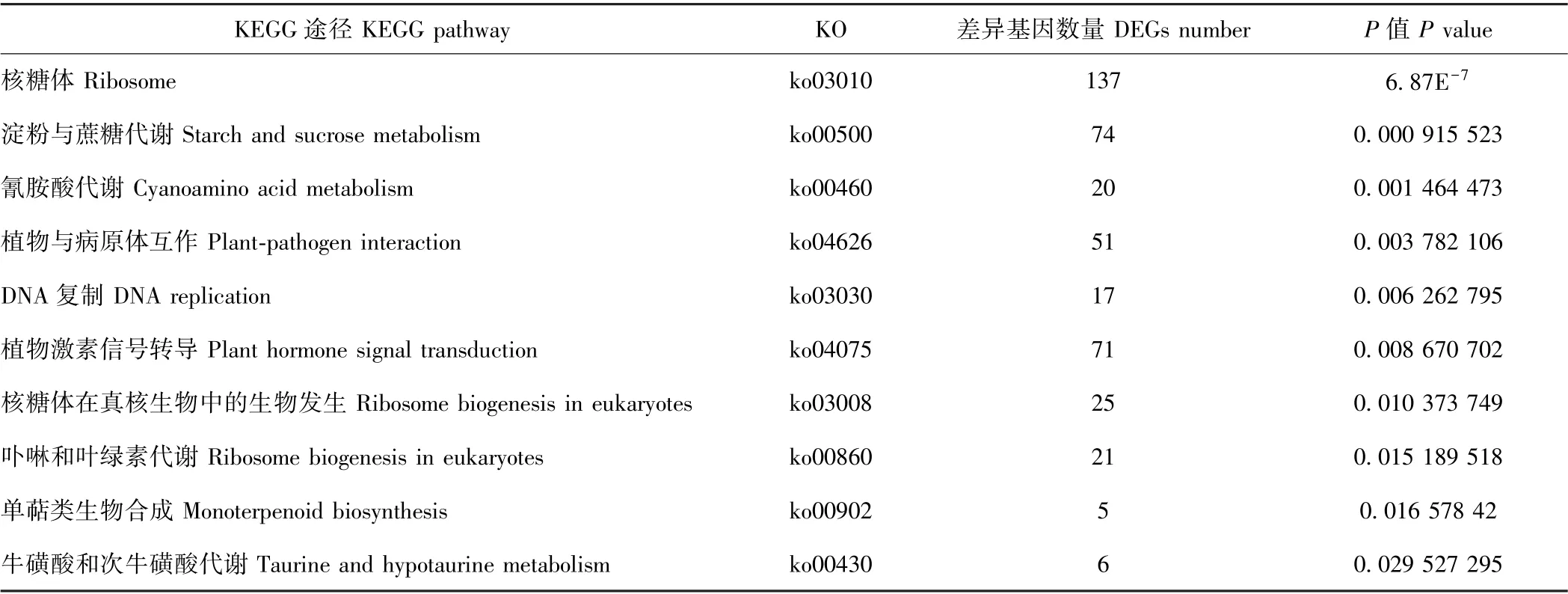
表5 显著性差异的KEGG 代谢途径Table 5 Significant difference KEGG pathways
百香果低温胁迫过程中,激素信号转导途径的DEGs 如表6所示,其中,上调表达基因为42 个,下调表达29 个,总体上看激素信号转导代谢被激活了。这些差异表达基因中,生长素、JA、ABA 等激素信号转导途径的关键基因,例如MYC2、生长素相应因子基因(auxin response factor,ARF)、吲哚乙酸氨基化合成酶基因(indole-3-acetic acid-amido synthetase gene,GH3)、生长素响应蛋白基因(auxin-responsive protein gene,SAUR)、蛋白磷酸酶2C 基因(protein phosphatase 2C gene,PP2C)及丝氨酸/苏氨酸蛋白激酶SRK2 基因(serine/threonine-protein kinase SRK2 gene,SRK2)等同时存在上调和下调表达类型,说明这些基因的不同成员可能在低温胁迫过程中存在功能多样性;油菜素内酯信号转导途径相关的丝氨酸/苏氨酸蛋白激酶BSK基因(serine/threonine-protein kinase BSK gene,BSK)与植物转录因子基因(plant transcription factor BZR,BZR)上调表达,而丝氨酸/苏氨酸蛋白激酶BRI1 基因(serine/threonine-protein kinase BRI1 gene,BRI1)下调表达;乙烯信号转导途径相关乙烯受体蛋白基因(ethylene receptor gene,ETR)、受体互作蛋白持续三重反应基因1(constitutive triple response gene1,CTR1)、乙烯不敏感基因3(ethylene insensitive gene 3,EIN3)、乙烯不敏感基因3 F-box 结合蛋白基因(EIN3-binding F-box protein gene,EBF)与乙烯受体转录因子1 基因(ethylene-responsive transcription factor 1,ERF1)均呈上调表达趋势;生长素信号转导途径相关生长素蛋白基因(auxin protein gene,AUX)、吲哚乙酸蛋白基因(indoleacetic acids protein gene,IAA)与转运抑制响应蛋白基因1(transport inhibitor response protein gene 1,TIR1)均下调表达;细胞分裂素信号转导途径中的关键基因细胞分裂素结合受体组氨酸激酶基因(arabidopsis histidine kinase gene 2/3/4,AHK2/3/4)与磷酸转运蛋白基因(arabidopsis histidinephosphotransfer protein gene,AHP)均下调表达;赤霉素抑制基因DELLA下调表达;水杨酸代谢途径关键基因TGA转录因子(transcription factor TGA)和病程相关蛋白基因1(pathogenesis-related protein gene 1,PR-1)也呈下调表达趋势。可见,生长素、细胞分裂素、ABA、乙烯、油菜素内酯、JA、水杨酸等植物激素均参与了百香果低温胁迫响应过程。值得注意的是,茉莉酸途径相关的JAR1 与JAZ均上调表达而COI1 下调表达,而与ABA 途径的连接桥梁PYL基因上调表达,而MYC2 家族不同成员同时存在上调和下调表达的现象,说明该代谢途径在百香果低温胁迫响应过程中存在重要的调控功能。
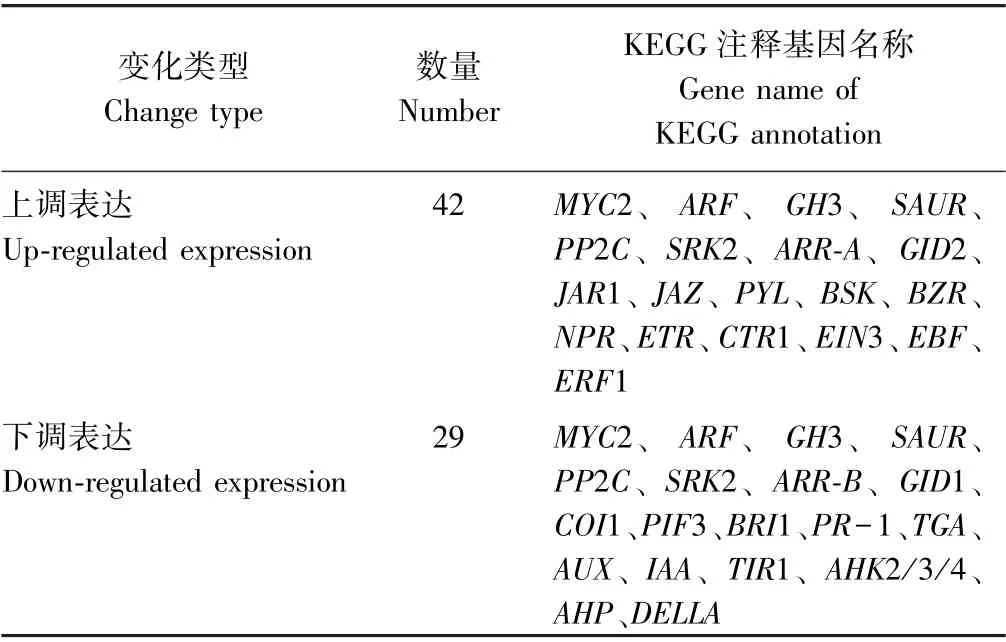
表6 植物激素信号转导途径中差异基因统计表Table 6 Statistics of DEGs in plant hormone signal transduction pathway
2.6 JA 代谢相关基因挖掘
低温胁迫下,百香果茉莉酸信号转导途径及相关基因的变化如图5,其中JAR1 和JAZ为上调表达基因,COI1 为下调表达基因,MYC2 基因同时存在上调和下调表达。此外,AOC、AOS与PYL也是植物茉莉酸代谢过程中的关键节点基因。这些基因在不同处理组中的FPKM(fragments per kilobase million)值的变化趋势及qRT-PCR 验证结果如表7所示,FPKM 值与qRTPCR 验证结果的变化趋势基本一致但变化的幅度略有差异。与CK 相比,LT 中c27852.graph_c0(AOC)、c48197.graph_c0(JAR1)、c52002.graph_c0(JAZ)、c52048.graph_c0(JAZ)、c49063.graph_c0(MYC2)、c54914.graph_c0(MYC2)与c36787.graph_c1(PYL)均显著上调表达,而c55075.graph_c0(COI1)显著下调。然而,与CK 相比,LT 中c54609.graph_c0(AOS)、c42174.graph_c0(JAZ)、c36235.graph_c0(MYC2)及c54944.graph_c0(PYL)的FPKM 值无显著差异,但qRT-PCR 相对表达量明显上调,分别达到CK 的3.35、2.49、1.62 及2.68 倍。可见,低温处理能够促进百香果茉莉酸生物合成相关的AOC与AOS转录,且受JA 直接正调控的JAR1、调控抗寒相关功能基因表达的MYC2 以及茉莉酸途径与ABA 途径关联基因PYL的表达水平也显著提高,与JA 在模式植物低温胁迫下的响应机制基本一致。然而,低温处理后,百香果中COI1 表达水平下降进而负调控JAZ表达水平上升,这一结果有待进一步研究。
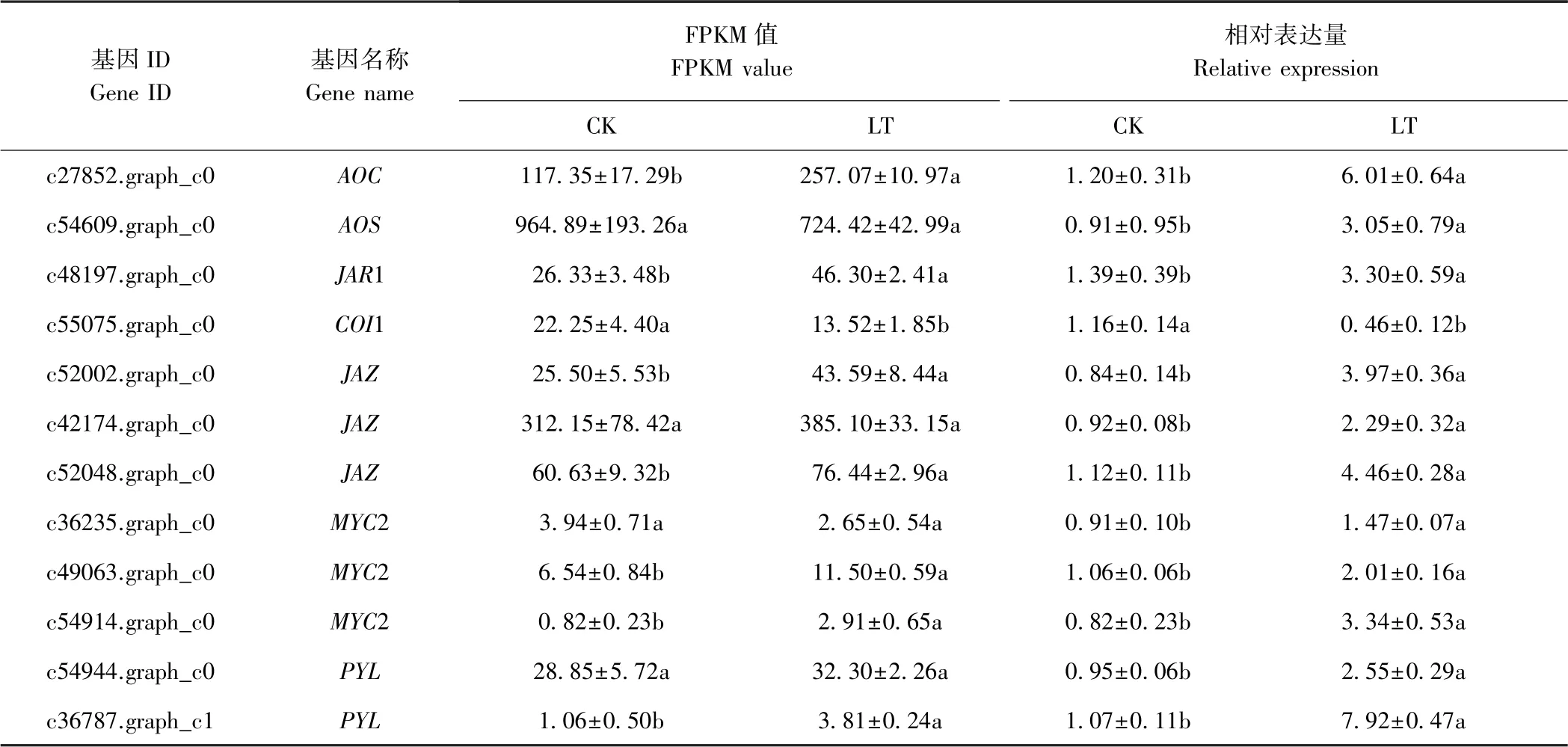
表7 百香果低温胁迫下茉莉酸代谢途径相关基因FPKM 值与qRT-PCR 相对表达Table 7 The FPKM value and relative expression by qRT-PCR of genes related to JA metabolism pathway of P.edulia under low temperature stress
3 讨论
高通量转录组测序是植物差异表达基因挖掘、代谢调控网络构建和生物学机理研究的重要手段。本研究中,百香果转录组各样品的Q20 的碱基百分比均大于98%,且Q30 的碱基百分比均大于94%[39],GC 含量介于45%~46%之间[5,40],Unigene 的N50 值大于长度平均值,此外qRT-PCR 验证的基因表达趋势基本与转录组FPKM 值预测基本一致。因此,所获得的转录组数据结果较好,能够满足后续分析要求。
由百香果低温胁迫转录组GO 分类的结果可知,生物过程大类中的代谢过程是DEGs 数量最多的类型,其注释的DEGs 涉及甾醇生物合成、类黄酮葡萄苷酸化、酪氨酸代谢、L-苯丙氨酸生物合成、软木脂生物合成、芥子油苷代谢及长链脂肪-酰基辅酶A 代谢等生物过程。这些代谢途径或信号转导过程在其他植物中的生物调控功能也已有相关报道。其中,甾醇生物合成过程与长链脂肪-酰基辅酶A 代谢过程与植物细胞的质膜稳定性有关[41-42],类黄酮葡萄苷酸化能够促进植物体内类黄酮葡萄苷酸化进而提高其解毒能力[43],酪氨酸代谢与L-苯丙氨酸生物合成可能促进植物体内酚类物质的合成[44],芥子油苷代谢能够调控芥子油苷合成与分解且与茉莉酸途径相关[45],而软木脂生物合成会促进细胞壁成分之一的软木脂合成[46]。此外,GO 分类的信号亚类注释的DEGs 中包括3 个谷氨酸受体基因,即GLR3.7、GLR3.2 和GLR2.7,与前人的研究报道一致[47],而这3 个GLR基因家族成员编码冷受体的功能上的区别与联系还需进一步研究。
基于KEGG 富集分析结果,低温处理后百香果通过核糖体、淀粉与糖代谢、植物激素信号转导及植物与病原菌互作等多个途径综合作用提高自身对低温的抵抗能力。其中,作为调控植物生长发育和抗逆境胁迫重要的过程,植物激素信号转导途径同样在百香果低温胁迫过程中存在显著变化。低温处理后,百香果中抗性相关的JA、ABA 与赤霉素等激素信号转导途径均被激活[9,11,48-49],而与植物生长相关的生长素与细胞分裂素等代谢途径总体上被抑制导致百香果体内生长素与细胞分裂素含量下降,进而影响JA 与ABA 等代谢途径[50-51]。
低温胁迫后,百香果茉莉酸信号转导途径中,AOC[21]与AOS[20,52]通过提高自身表达量从而促进茉莉酸类物质的生物合成,经过JAR1[25]等基因的信号传递从而提高MYC2[53]的表达,进而提高相关抗寒功能基因的表达。同时,以PYL作为桥梁,茉莉酸信号亦被传递到ABA 途径,共同提高百香果的抗低温能力[34,54]。此外,本试验中,JAR1 对COI1 的调控可能随着低温处理的进程或因COI1 不同成员之间的区别而变化,同样,JAZ不同成员对MYC2 的调控也存在类似现象,产生这种现象的原因则有待进一步验证和研究[32-33]。
4 结论
本试验所获得的百香果测序结果较为可靠准确,其中核糖体途径、淀粉与蔗糖代谢途径、植物激素信号转导途径及植物与病原体互作途径是百香果响应低温胁迫的重要代谢途径。此外,茉莉酸代谢途径的关键基因AOC、AOS、JAR1 与PYL对低温胁迫的响应机制与模式植物基本一致,但COI1 和MYC2 等基因的调控方式较为特殊。本研究结果为揭示百香果抗寒机制提供了科学参考。
