胆汁反流性胃炎与肠化生的关系及其分子机制
2021-04-15苏保伟王景杰
苏保伟,林 强,王景杰
(空军军医大学第二附属医院消化内科,西安 710038;*通讯作者,E-mail:jingjie@fmmu.edu.cn)
胆汁反流性胃炎是由于过量的含胆汁的十二指肠液反流入胃损伤胃黏膜,引起胃黏膜炎症性改变的一种临床疾病。胆汁反流现象是Beaumout[1]于1833年首次发现,随着胃肠道手术的日益增加及消化内镜诊疗技术的日益成熟,BRG发病率及检出率随之升高。有研究表明胆汁反流性胃炎在接受胃镜检查的患者中检出率高达11.3%[2]。胃黏膜肠上皮化生(intestinal metaplasia,IM)是指由于胃黏膜在长期慢性炎症影响下导致正常胃黏膜上皮细胞被肠上皮细胞所替代,进而出现杯状细胞、潘氏细胞及吸收上皮细胞的一种病理改变[3]。近年来的研究已证实长期的胆汁酸暴露可增加正常胃黏膜向肠上皮化生转变的风险,尾型同源盒转录因子2(caudal type homeobox,CDX2)、性别决定区Y框蛋白2(SRY-related HMG box-2,SOX2)、G蛋白偶联胆汁酸受体5(G protein-coupled bile acid receptor 5,TGR5)在胆汁酸诱导的肠化生中起重要作用[4-6]。本研究拟探讨胆汁反流严重程度对肠化生发生率及肠化生病理类型的影响,同时通过检测胆汁反流性胃炎伴肠化生患者CDX2、SOX2和TGR5表达的变化,旨在探讨胆汁反流性胃炎参与肠化生的潜在分子机制。
1 材料与方法
1.1 研究对象
收集2019年10月至2020年10月在空军军医大学第二附属医院消化科内镜中心诊断为胆汁反流性胃炎的350例患者作为病例组,包括轻度胆汁反流(胆汁反流Ⅰ度+Ⅱ度)患者215例和重度胆汁反流(胆汁反流Ⅲ度)患者135例,其中轻度患者中确诊肠化生34例(胆汁反流Ⅰ度患者中确诊肠化生11例,胆汁反流Ⅱ度确诊肠化生23例),重度组患者中确诊肠化生37例。随机选取同期接受胃镜检查诊断为慢性非萎缩性胃炎的30例患者作为对照组。本研究通过医院伦理委员会审批,批件号:第202007-01号。
1.2 纳入排除标准
纳入标准:①年龄18-70岁;②经胃镜下诊断为胆汁反流性胃炎患者;③签署知情同意书并同意接受胃黏膜活检。排除标准:①胃镜检查合并有胃食管反流病、胃癌、胃溃疡、胃出血等器质性疾病者;②合并胆道梗阻等占位性疾病;③合并严重心脑血管、肝肾疾病不适宜接受胃镜检查者。
1.3 诊断标准
1.3.1 胆汁反流性胃炎诊断 将胃镜插至胃内静止不动1 min以上,可见胆汁由十二指肠经幽门口反流入胃;在被检查者无明显恶心的情况下见黏液湖有黄染或胃黏膜有胆汁斑附着,胃黏膜红白相间,充血肿胀或糜烂[7]。
1.3.2 胆汁反流性胃炎严重程度分级 Ⅰ度胆汁反流,胃黏膜有少量胆汁附着,或潴留液呈淡黄色;Ⅱ度胆汁反流,胃黏膜有较深胆汁附着,或潴留液呈深黄色;Ⅲ度胆汁反流,大量深黄、深绿色的潴留液,或大量黄色泡沫从有门口溢出[8]。
1.3.3 肠化生诊断 对胃镜下经窄带成像内镜(NBI)及放大内镜(ME)疑诊肠上皮化生的患者于疑诊部位取胃黏膜活组织送病理检查确诊有无肠化生[9]。
1.4 试验方法
1.4.1 试剂 鼠抗人CDX2单克隆抗体、兔抗人SOX2单克隆抗体均购自武汉赛维尔公司,兔抗人TGR5单克隆抗体购自Abcam公司。超敏SP免疫组织化学试剂盒及DAB显色剂购自DAKO公司。
1.4.2 病理学检测及结果判读 首先通过HE染色进一步明确活检标本有无肠化生。对确诊肠化生的标本进一步行AB-PAS染色,根据1998年Podova会议共识将肠化生分为完全型肠化生及不完全型肠化生两种病理类型。同时对确诊肠化生的标本进一步采用超敏SP法,测定CDX2、SOX2、TGR5的表达情况。结果采用半定量计分方法:随机选取5个高倍镜视野计数,根据细胞染色强度和染色细胞所占比例两者乘积进行结果判定。染色强度按下列标准评定计分:0分为不着色;1分为浅黄色;2分为棕黄色;3分为棕褐色。染色的阳性细胞数所占比例按下列标准评定计分:阳性细胞<5%为0分;阳性细胞占5%-25%为1分;阳性细胞占26%-50%为2分;阳性细胞>50%为3分。细胞染色强度和染色比例两者乘积,结果分为:0-5分为低表达;>5分为高表达[10]。
1.5 统计学方法
采用SPSS19.0统计软件,各组间肠化生发生率及CDX2、SOX2、TGR5的表达率的比较均采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 胆汁反流严重程度与肠化生发生率相关性分析
轻度和重度胆汁反流患者间肠化生发生率差异有统计学意义(P<0.05,见表1)。与轻度胆汁反流组(胆汁反流Ⅰ度+Ⅱ度)相比,重度胆汁反流组(胆汁反流Ⅲ度)肠化生发生率显著升高,差异有统计学意义(P<0.05)。胆汁反流及肠化生胃镜下表现见图1。
2.2 胆汁反流严重程度与肠化生病理类型的相关性分析
与轻度胆汁反流组相比,重度胆汁反流组不完全型肠化生的发生率显著升高,差异有统计学意义(P<0.05,见表2)。肠化生的病理表现见图2。
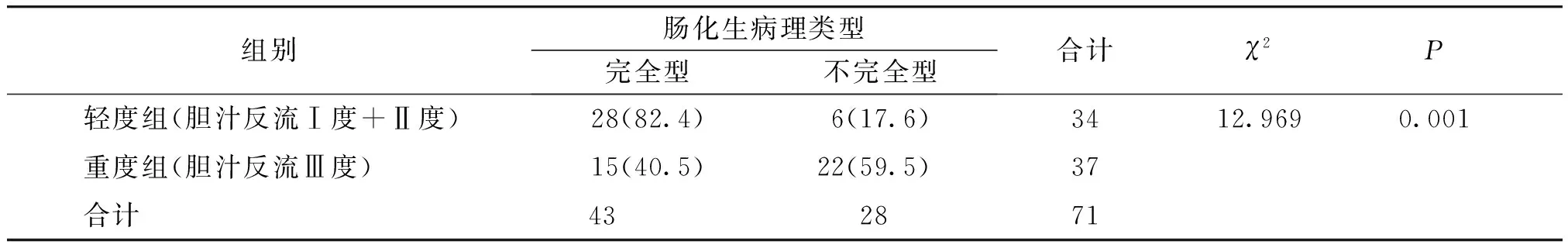
表2 不同胆汁反流程度间肠化生病理类型比较 例(%)

A.慢性非萎缩性胃炎胃黏膜组织(HE,×400);B.肠化生胃黏膜组织(HE,×400);C.完全型肠化生(AB-PAS,×400);D.不完全型肠化生(AB-PAS,×400)图2 慢性非萎缩性胃炎及肠化生胃黏膜的病理表现Figure 2 Pathological features of gastric mucosa in chronic non-atrophic gastritis and intestinal metaplasia
2.3 CDX2、SOX2、TGR5在不同分组间的表达
将71例胆汁反流型胃炎伴肠化生的患者作为病例组,另选取胃镜下胃黏膜表现为慢性非萎缩性胃炎的患者30例为对照组,比较两组间和不同胆汁反流程度组间CDX2、SOX2和TGR5的表达情况。结果显示,CDX2和TGR5在胆汁反流性胃炎伴肠化生组中的高表达率显著高于慢性非萎缩性胃炎组,而SOX2在胆汁反流性胃炎伴肠化生组中的高表达率显著低于慢性非萎缩性胃炎组,两组间比较差异均有统计学意义(P<0.05,见表3)。同时,CDX2和TGR5在重度胆汁反流组中的高表达率显著高于轻度胆汁反流组,而重度胆汁反流组SOX2的高表达率显著低于轻度胆汁反流组(P<0.05,见表4)。CDX2、SOX2和TGR5在慢性非萎缩性胃炎及肠化生患者中的病理表现见图3。
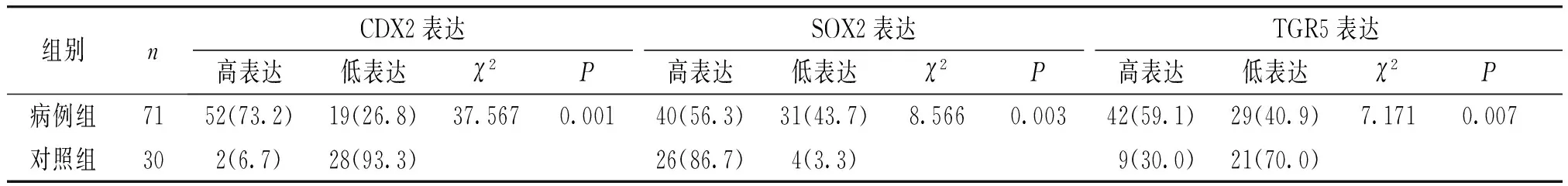
表3 CDX2、SOX2、TGR5在病例组及对照组的表达比较 例(%)
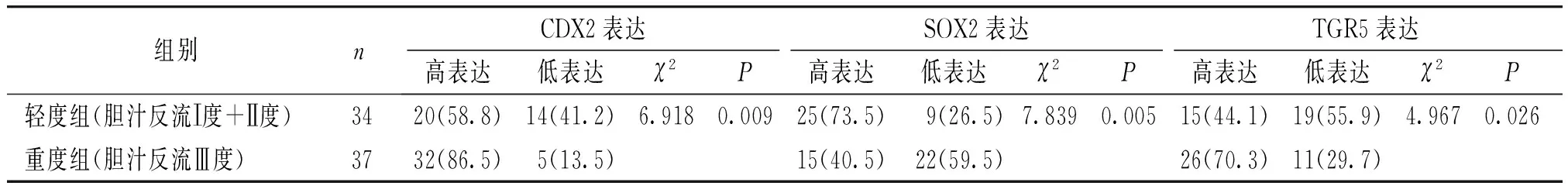
表4 CDX2、SOX2和TGR5在不同胆汁反流程度组间的表达比较 例(%)
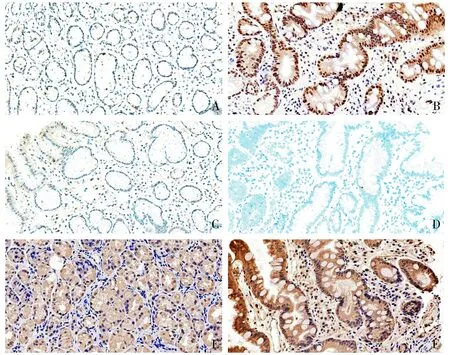
A.CDX2在慢性非萎缩性胃炎;B.CDX2在胆汁反流伴肠化生;C.SOX2在慢性非萎缩性胃炎;D.SOX2在胆汁反流伴肠化生;E.TGR5在慢性非萎缩性胃炎;F.TGR5在胆汁反流伴肠化生图3 CDX2、SOX2、TGR5在慢性非萎缩性胃炎及肠化生中的病理表现 (SP法,×400)Figure 3 Pathological features of CDX2,SOX2 and TGR5 in chronic non-atrophic gastritis and intestinal metaplasia
3 讨论
1988年Correa等[11]提出了肠型胃癌发生发展的模型,认为肠型胃癌的发生发展是一个多因素、多步骤的过程,一般经历正常胃黏膜-慢性非萎缩性胃炎-慢性萎缩性胃炎-肠化生-低级别上皮内瘤变-高级别上皮内瘤变-胃癌的发展路径。因此肠化生被认为是一种癌前病变,有研究表明肠化生患者患癌风险约为正常健康人群的6-10倍[12]。肠化生可分为完全型肠化生和不完全型肠化生两种病理类型,完全型肠化生又称小肠型肠化生,这类肠化生具有完整的刷状缘及杯状细胞,组织形态上类似小肠细胞,可分泌唾液黏蛋白。不完全型肠化生又称为大肠型肠化生,与小肠型相比缺乏刷状缘,组织形态上类似大肠细胞,可分泌唾液黏蛋白及硫黏蛋白。两种病理类型发生癌变的风险不同,目前认为大肠型肠化生较小肠型更易进展为胃癌,有研究[13]对两种病理类型的肠化生随访13年后发现,不完全型肠化生中有18.2%发展为胃癌,而完全型肠化生中仅有0.96%发生癌变。
本研究对胆汁反流性胃炎不同严重程度患者间肠化生的发生率进行了分析,结果显示随着胆汁反流程度的加重,肠化生的发生率呈升高趋势。这与日本的一项研究一致,2013年日本的一项临床研究将2 283例接受胃镜检查的患者根据胃液中是否能检测到胆汁酸将其分为试验组和对照组,同时根据测定的胆汁酸浓度由低到高将试验组分为4组进行比较,结果显示高浓度胆汁酸组肠化生的发生率显著高于低浓度组[14],提示高浓度胆汁酸会增加肠化生的发生率。另一项研究也得出了类似的结果[15]。本研究还比较了不同胆汁反流严重程度组间发生肠化生病理类型的差别,结果显示胆汁反流程度较重的患者不完全型肠化生的发生率显著高于胆汁反流轻度患者,提示胆汁反流严重程度可能会影响肠化生的病理类型。查阅既往的文献未见相关的报道,我们猜测可能是高浓度的胆汁酸通过某种分子机制引起肠化生病理类型的不同,具体的机制解释还需要更多的基础及临床研究佐证。
CDX2属于尾型同源盒基因(CDX)家族,是胃黏膜肠化生的重要调节因子,CDX2的异位表达在肠化生的发生发展中起着至关重要的作用。正常情况下CDX2蛋白仅在肠内表达,在正常胃黏膜上皮内不表达,主要起调节肠上皮细胞增殖分化的作用。SOX2属于性别决定区Y框蛋白(SOX)基因家族,主要在正常食管及胃内表达,在肠道中不表达[10]。有大量研究表明CDX2/SOX2在胆汁酸诱导的肠化生中起重要作用。既往有研究将SOX2在不完全型肠化生和完全型肠化生中的表达阳性率进行了比较,结果显示,SOX2在不完全型肠化生中的表达阳性率显著高于在完全型肠化生中的表达[5]。最近的一项研究[16]显示,胆汁酸可通过FXR/NF-κB信号通路上调CDX2和MUC2(黏蛋白2)的表达,从而促进肠上皮化生的发生。另一项研究[17]显示SOX2可通过上调CDX2的转录活性,促进肠化生标志物KLF4、HNF4α、钙黏蛋白17的表达,从而在肠化生的进展中发挥重要作用。我们的研究发现胆汁反流性胃炎伴肠化生患者CDX2的表达显著高于慢性非萎缩性胃炎患者,且在胆汁反流度Ⅲ患者中的高表达率显著高于胆汁反流Ⅰ度和Ⅱ度患者,提示胆汁反流严重程度与CDX2的表达正相关,胆汁反流可能会促进CDX2的表达。而SOX2显示出相反的表达结果,提示胆汁反流严重程度与SOX2的表达负相关,胆汁反流可能会抑制SOX2的表达。
TGR5受体是G蛋白偶联受体家族成员。TGR5受体在人类和动物体内广泛表达,在与胆汁酸相互作用时可激活多种细胞内信号通路,在抗炎、免疫调节、葡萄糖代谢、能量代谢等方面都具有十分重要的作用[18,19]。我们的研究显示TGR5在胆汁反流性胃炎伴肠化生患者中的表达显著高于慢性非萎缩性胃炎患者。已经有研究表明TGR5在大多数胃肠型腺癌中过表达,中度至强烈的TGR5染色与所有胃腺癌患者生存率降低密切相关[20]。而我们知道肠化生是胃腺癌形成的重要癌前病变形式。结合本次实验结果,我们推测胆汁反流诱发TGR5高表达,可能是导致胆汁反流相关性肠化生进一步发生癌变的重要分子基础,这也为胆汁反流相关胃癌的防治提供新的诊疗思路。此外,我们还将TGR5在不同胆汁反流严重程度患者中的表达进行比较,结果显示TGR5在胆汁反流Ⅲ度患者中的高表达率显著高于胆汁反流Ⅰ度和Ⅱ度患者,提示胆汁反流严重程度可能会对TGR5的表达产生影响。既往的研究中胆汁酸被认为是结肠癌发生发展的肿瘤促进因子[21]。同时研究[22]发现胆汁酸可以通过作用于巨噬细胞膜上TGR5受体,参与调控肠道炎症,而胆汁酸失衡与肠道TGR5信号通路介导的炎症失调密切相关,并参与结肠癌的形成。结合以上研究基础,胆汁反流导致胃黏膜TGR5表达上调,而TGR5表达上调可能参与黏膜炎症反应失衡过程,长期的慢性炎症促进了胃黏膜肠化的形成,因此TGR5可能是介导胆汁酸-炎症-肠化生这一过程的重要分子基础。
综上所述,胆汁反流严重程度可影响肠化生的发生率,随着胆汁反流程度的加重,肠化生的发生率呈升高趋势。同时,胆汁反流严重程度与肠化生病理类型相关,胆汁反流程度越重的患者发生肠化生的病理类型更倾向于不完全型。此外,胆汁反流可能通过影响CDX2、SOX2及TGR5的表达参与肠化生的发生发展。但由于本次试验纳入的病例数相对较少,进一步的证实还需要更多样本的纳入。
