Siglec-15是食管鳞状细胞癌的新型独立预后因子
2021-04-15王玉琛刘笑笑龚拓拓白明华
黄 珊,王玉琛,刘笑笑,龚拓拓,李 芳,白明华*
(1西安交通大学第二附属医院肿瘤放疗科,西安 710004;2西安交通大学第一附属医院肿瘤放疗科;*通讯作者,E-mail:baimh2004@126.com)
食管癌是全球常见恶性肿瘤。我国是食管癌高发国家,以鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主要类型[1,2]。食管癌目前采用手术、放疗及化疗的综合治疗手段,但预后仍较差,5年生存率仅为30%-40%[3],迫切需要新的诊治靶点。癌症免疫疗法在肿瘤治疗中的作用逐渐凸显,以PDL1/PD1通路抑制为代表的免疫检测点阻断在食管癌中也已经得到了广泛的研究[4,5]。然而,食管癌中免疫治疗的有效率不足40%,亟需寻找其他可联合的免疫检查点抑制剂[6-8]。
唾液酸结合Ig样凝集素15(sialic acid binding Ig like lectin 15,Siglec-15)是先天免疫相关途径的重要配体之一,是一种全新免疫抑制途径[9]。Siglec-15位于18号染色体,编码蛋白在M2型巨噬细胞、树突状细胞、B细胞与破骨细胞中表达,可持续抑制T细胞的活性[10]。近来发现Siglec-15在肺癌、甲状腺癌及膀胱癌等多种实体肿瘤细胞上表达上调,在正常组织上表达未上调。同时,Siglec-15表达与PDL1互斥,Siglec-15的免疫抑制功能独立于PDL1/PD1[11]。Siglec-15的这些独特的生物学特性,决定了其成为免疫检查点抑制剂的潜在候选靶标。目前Siglec-15阻断的1/2期临床试验NCT03665285正在进行中,该研究自2018年开始招募143例头颈部鳞癌、非小细胞肺癌、卵巢癌及三阴性乳腺癌4种实体瘤患者,但不包括食管癌。
Li等[12]采用生物信息学分析多个实体瘤中Siglec-15 mRNA表达情况,发现食管癌中Siglec-15 mRNA在癌组织较正常组织表达上调,但未在临床组织标本或细胞中验证,且未检测蛋白水平。基于目前的文献数据,无法明确Siglec-15在ESCC中表达情况,这阻碍了Siglec-15免疫检测点在ESCC人群中的临床转化。基于这些现状,本研究对临床收集的129例ESCC患者癌组织中Siglec-15进行检测,明确Siglec-15蛋白表达水平及亚细胞定位,分析Siglec-15与ESCC患者临床病理特征及生存的关系,评估Siglec-15这一全新免疫抑制靶点在食管癌中运用的可能性。
1 材料与方法
1.1 患者队列和标本
收集2010-2011年间西安交通大学第一附属医院的病理确诊为食管鳞状细胞癌患者。合并其他肿瘤,吻合口漏或全身感染的患者被排除在外。手术后,由独立病理学家根据AJCC 8th进行疾病分期。每位患者的临床资料均由两位研究人员独立从病历中仔细检索并整理。手术切除术中在原发肿瘤部位取样肿瘤标本,收集肉眼或影像学明确的病灶外2 cm以内的癌旁正常上皮组织。组织样本行福尔马林固定并石蜡包埋。本研究排除远处转移及新辅助治疗后的患者。本研究遵守《赫尔辛基宣言》中涉及人类受试者的医学研究的伦理原则,已获得患者的知情同意,此项研究经西安交通大学医学部伦理委员会批准。
1.2 Siglec-15免疫组织化学分析
将石蜡包埋标本切成4.5 μm厚,置于二甲苯中脱蜡,随后将样品通过梯度乙醇水化,后置于柠檬酸盐缓冲液中行抗原修复。修复完毕后将切片置于5%正常山羊血清中,室温封闭1 h。封闭结束后加入一抗孵育(Siglec-15,1 ∶1 000),4 ℃过夜。第2日,漂洗一抗后加入二抗,在37 ℃下孵育1 h。滴加辣根过氧化物酶行DAB染色。50%苏木精浸泡6 min,样品经梯度乙醇脱水及二甲苯透明,最后封片。使用Remmele和Stegner的免疫反应评分(immunoreactivity score, IRS)对标准的结果进行评分[13,14]。
1.3 统计分析
使用Prism GraphPad 7和SPSS 20进行统计分析及绘图。采用Mann WhitneyU检验及卡方检验对比Siglec-15蛋白在食管癌及癌旁组织中表达差异。采用Logistic回归分析Siglec-15蛋白表达与患者临床病理特征的相关性。采用单因素及多因素Cox回归模型分析食管癌患者预后相关因素。采用Kaplan-Meier分析癌组织Siglec-15蛋白表达水平与患者总生存期(overall survival,OS)及肿瘤无进展生存期(progression-free survival,PFS)的关系。P<0.05为差异有统计学意义。
2 结果
2.1 患者特征和Siglec-15表达
本研究共收集129例食管癌患者的组织样本,随访5年,中位生存时间为27个月(9-60个月)。患者临床病理特征见表1。在129例患者中,男性患者(85.3%)多于女性(14.7%)。74例(57.4%)患者为pT3-4期,68例(52.7%)患者有区域淋巴结转移(pN+)。对129例患者的癌组织及癌旁正常上皮组织进行Siglec-15的免疫组织化学染色及评分。结果显示,Siglec-15在癌旁正常上皮组织中无表达,但在癌组织中表达上调(中位免疫反应评分IRS=4.67,见图1)。进一步亚细胞定位分析显示,Siglec-15表达主要在食管癌细胞表面及细胞浆内。
2.2 Siglec-15表达与临床病理特征的关系
为了分析Siglec-15与患者临床病理特征的关系,根据IRS值将Siglec-15转化为二进制分类变量(高表达与低表达使用癌组织Siglec-15的中位IRS=5.0作为临界值)。Siglec-15与患者的年龄、性别无相关性(P>0.05),与肿瘤组织学分级、pT分期及区域淋巴结转移状态有相关性(P<0.001,见表1)。同时,Siglec-15的IRS值连续变量分析结果也显示,Siglec-15高表达在较晚的pT分期及区域淋巴结转移患者中表达明显增高(P<0.001,见图2)。
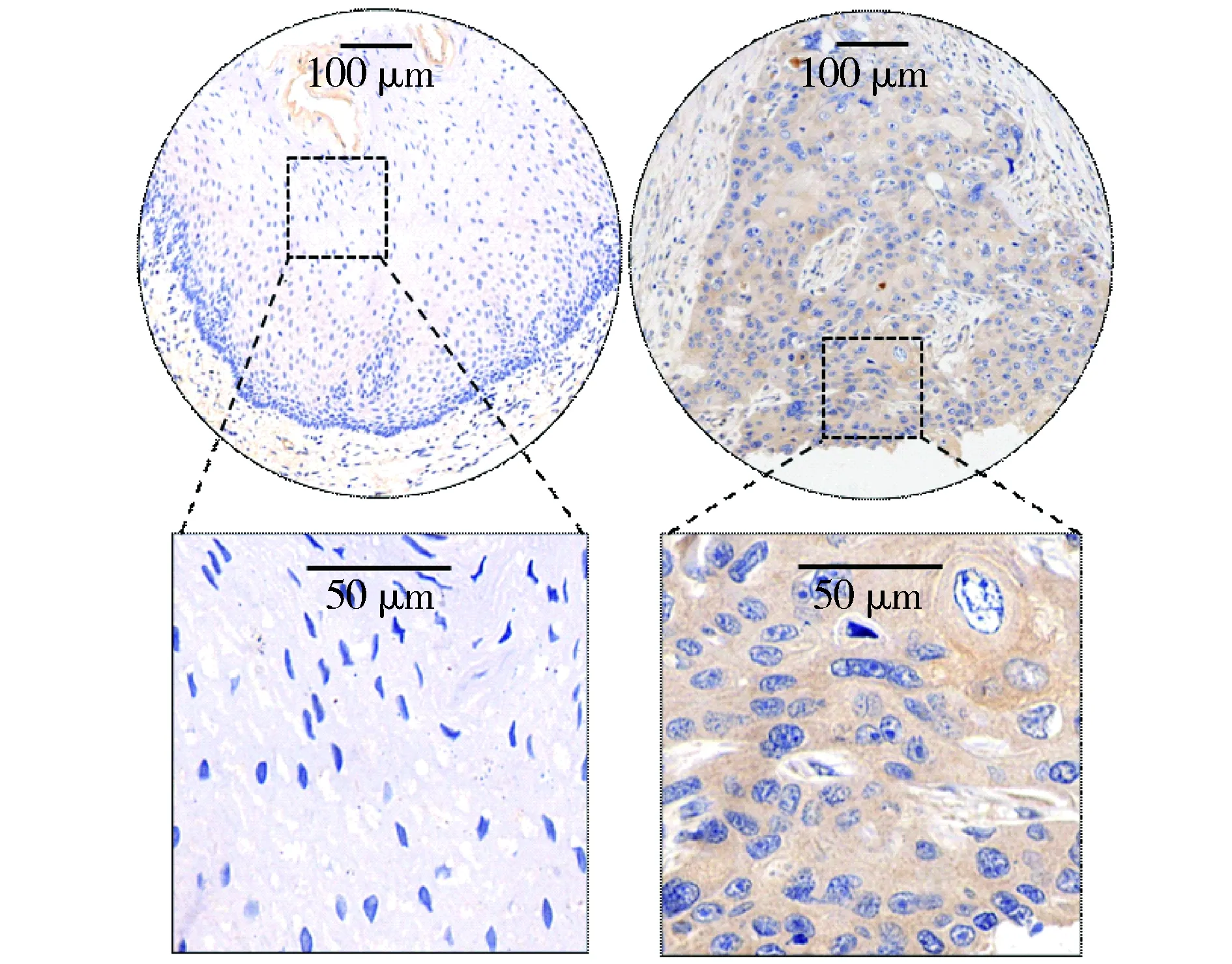
A.癌旁组织 B.癌组织图1 食管鳞状细胞癌组织的免疫组织化学染色Figure 1 Immunohistochemistry of Siglec-15 in esophageal squamous cell carcinoma
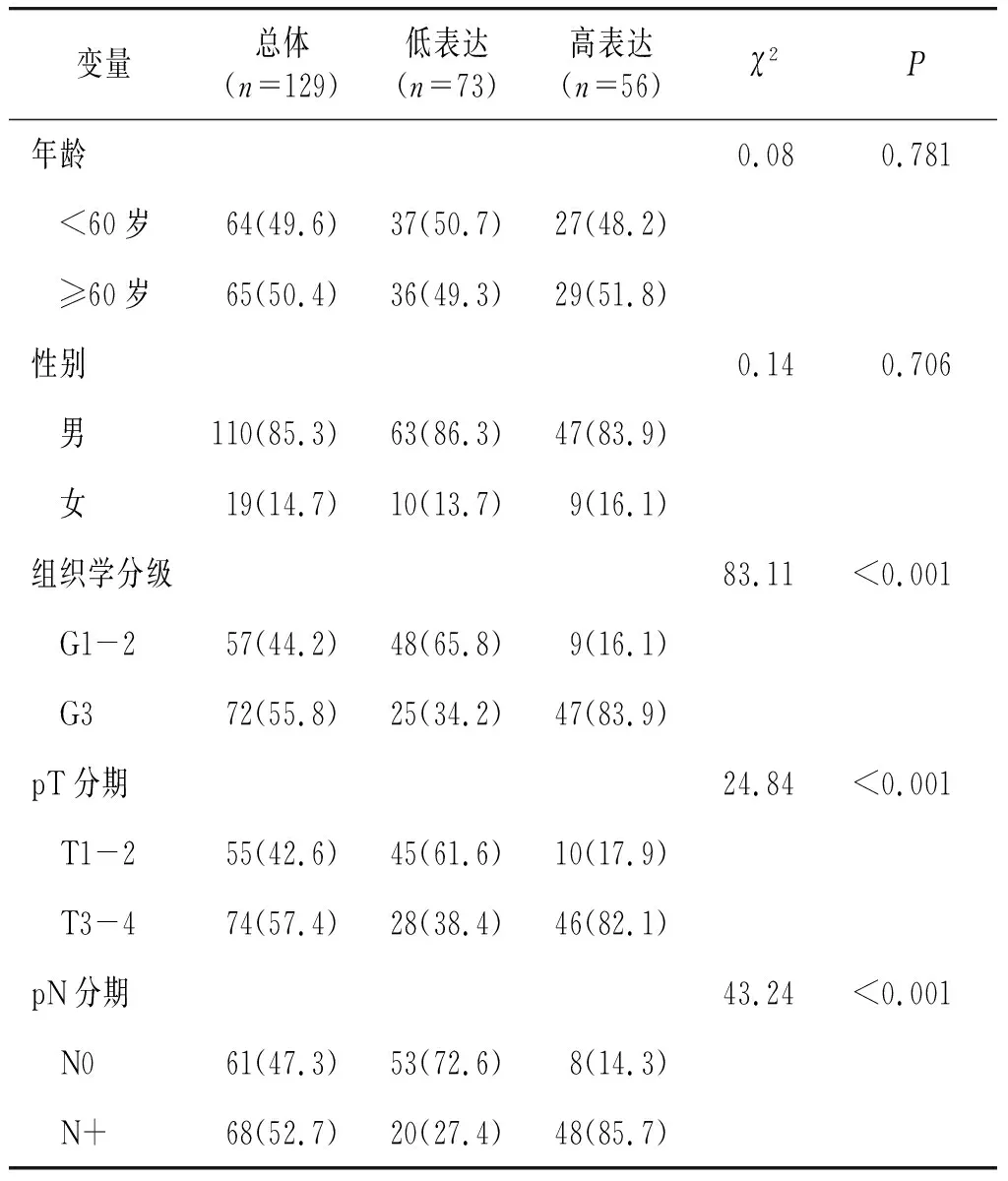
表1 Siglec-15表达与食管癌患者临床病理特征相关性分析 例(%)
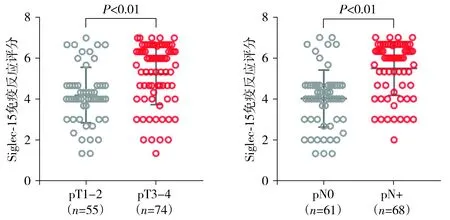
图2 Siglec-15在食管鳞状细胞癌组织中的表达Figure 2 Siglec-15 protein in esophageal squamous cell carcinoma tissues
2.3 Siglec-15表达是食管鳞癌患者独立的预后因素
进一步,本研究评估了Siglec-15表达是否是食管癌患者PFS及OS的独立预后因素。我们对129例食管癌病例进行了Cox比例风险建模,在多变量Cox比例风险回归模型中,包括Siglec-15表达、年龄、性别、肿瘤组织学分级、pT分期及淋巴结状态。在调整患者年龄、性别、肿瘤组织学分级、pT分期及淋巴结状态后,Siglec-15是患者无进展生存期及总生存期的独立预后因素(见表2,3)。高表达Siglec-15的患者肿瘤进展风险增大(HR=2.53,95%CI 1.34-4.80,P=0.004),同时患者死亡风险亦增大(HR=2.05,95%CI 1.17-3.58,P=0.012,见表2,3)。
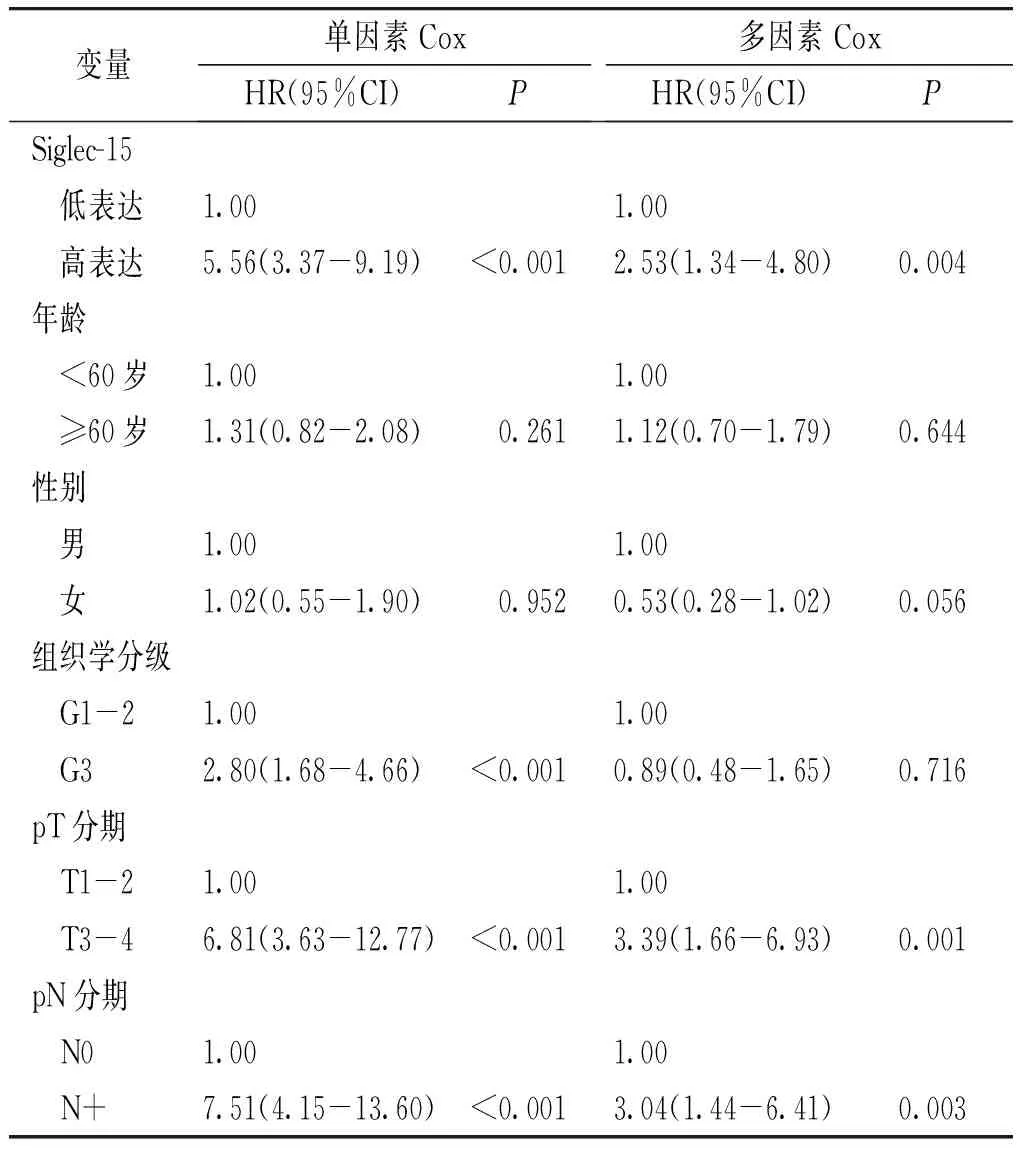
表2 单因素及多因素Cox回归模型分析ESCC患者PFS预后因素
2.4 Siglec-15表达与患者生存的关系
使用中位表达水平作为临界值,将患者分为Siglec-15高表达组及低表达组,采用Kaplan-Meier分析癌组织中Siglec-15表达与ESCC患者临床预后的关系。与低表达Siglec-15的患者相比,高表达Siglec-15的患者肿瘤无进展生存时间和总生存时间明显缩短(P<0.05,见图3)。高表达Siglec-15患者的3年无进展生存率较低表达者明显降低(12.8%vs49.2%,P<0.05),高表达Siglec-15患者的3年总生存率较低表达者也明显降低(14.4%vs65.5%,P<0.05)。
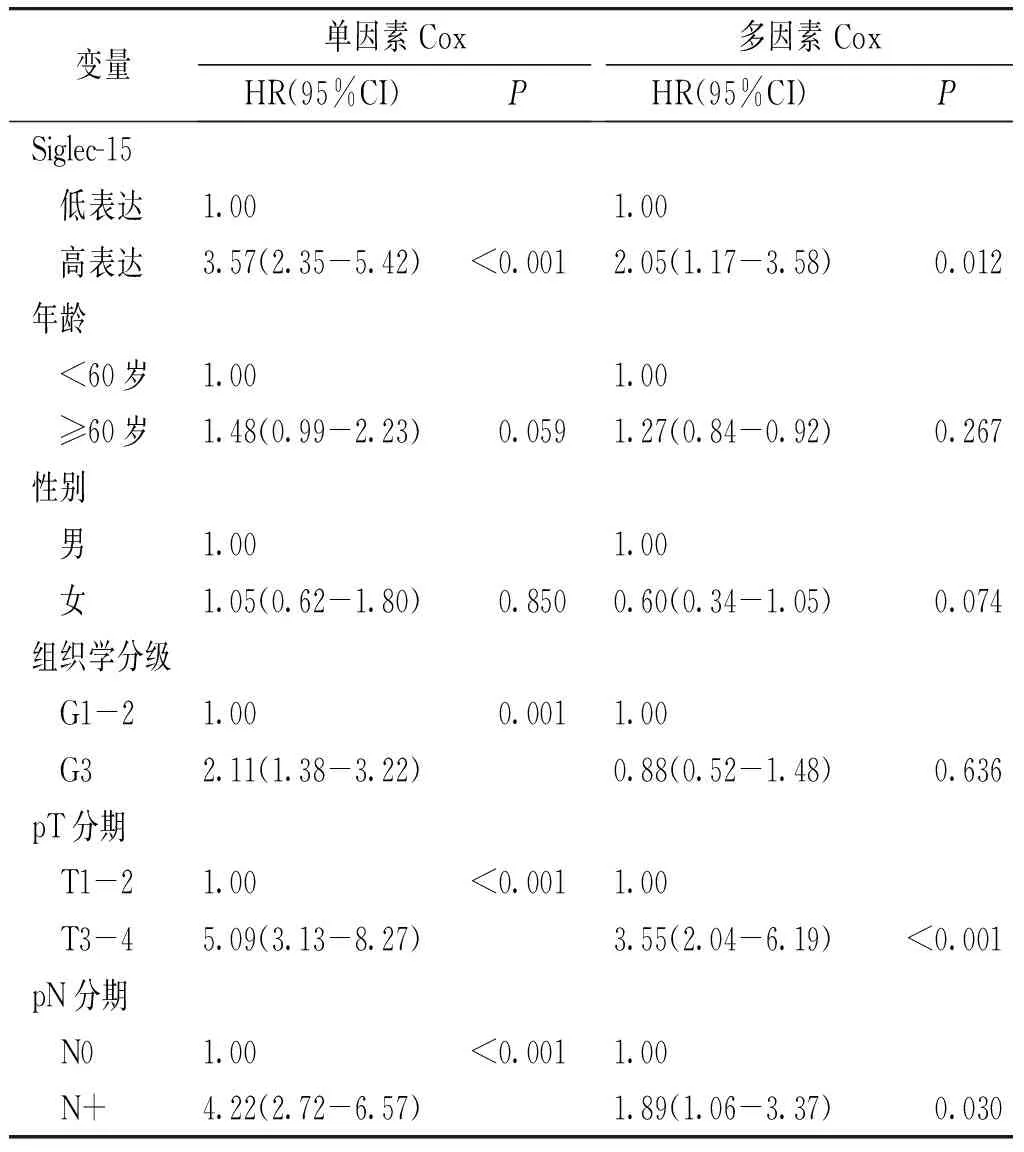
表3 单因素及多因素Cox回归模型分析ESCC患者OS预后因素
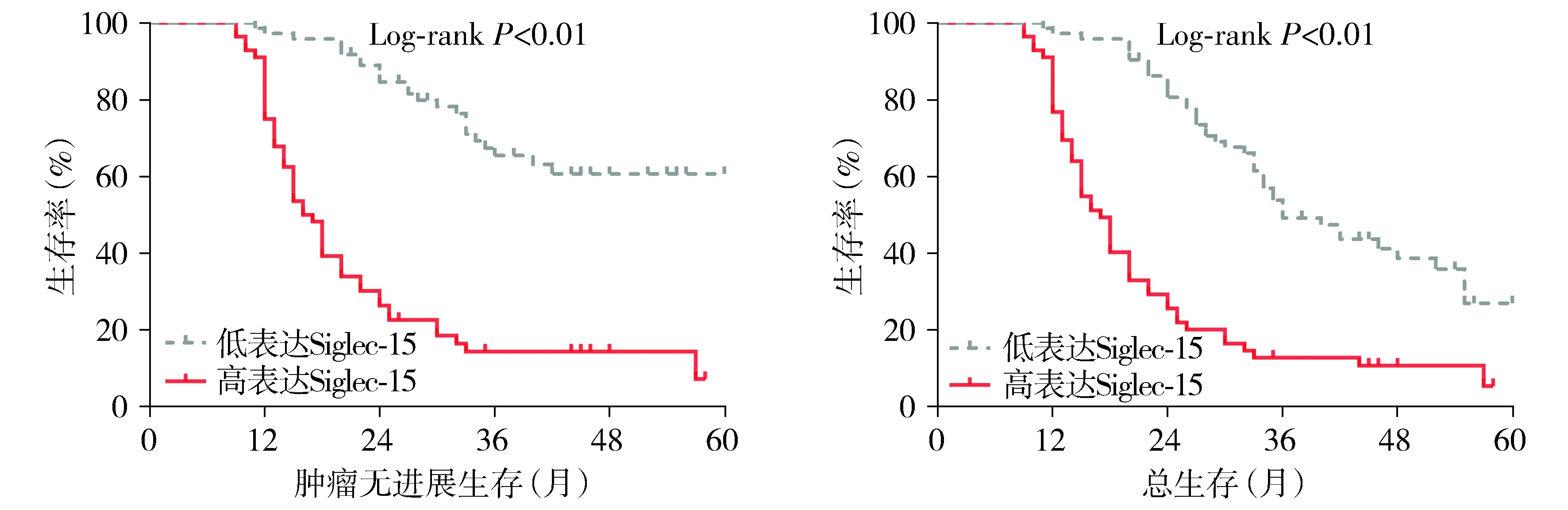
图3 不同Siglec-15表达ESCC患者的Kaplan-Meier生存曲线Figure 3 Kaplan-Meier survival curves of esophageal squamous cell carcinoma patients with different expression of Siglec-15
3 讨论
临床研究已经显示免疫检测点抑制剂PDL1/PD1在ESCC患者中的治疗潜力。然而,仅小部分患者从目前已知的免疫检测点中受益。识别和开发新的免疫检测点具有重要意义。阻断Siglec-15免疫检测点是一种新近发现的有希望的肿瘤治疗策略[9,10]。本研究旨在评估ESCC患者肿瘤组织中Siglec-15表达情况。在这项研究中,我们对比了Siglec-15在食管癌肿瘤和临近正常上皮组织中的表达,并进行了Siglec-5与肿瘤侵犯深度、淋巴结转移等临床病理特征及患者生存的扩展分析。
在食管癌中,本研究首先观察到Siglec-15在癌组织中高表达,而在癌旁的正常上皮组织中无明显表达。这与之前的两项报道结果一致。在Nature杂志上发表的一项研究证明,Siglec-15在许多人类癌症中的表达都增加[11]。Li等[12]分析TCGA数据库,发现Siglec-15 mRNA在食管癌癌症中的表达明显高于正常组织。Siglec-15在正常人体组织(包括大多数免疫细胞类型)中的表达非常低,这提示以Siglec-15为靶点的阻断治疗在食管癌肿瘤中具有较高的选择性靶向,对正常组织影响较小,Siglec-15阻断疗法在食管癌治疗中相对安全。其次,本研究对Siglec-15的亚细胞定位显示其主要表达于食管癌细胞表面及细胞核内,这一发现支持Siglec-15作为细胞表面靶标。适应性耐药是目前免疫治疗面临的重要挑战,Wang等[11]报道Siglec-15的免疫抑制功能独立于PDL1/PD1轴。因此,对于不适合PDL1免疫疗法或对治疗产生耐受的患者,靶向Siglec-15是一种有希望的选择。目前NC318(Siglec-15抗体)的1期临床试验(NCT03665285)正在进行,但并未纳入食管癌。本研究首次报道了Siglec-5蛋白在食管癌组织中表达情况,我们的结果为Siglec-15作为新型的肿瘤免疫治疗靶点提供支持。
本研究还发现Siglec-15与肿瘤浸润深度和淋巴结转移具有明显相关性,食管癌从早期发展到中晚期时Siglec-5增加。Siglec-15通过DAP12相互作用激活ERK和PI3K-AKT途径[15],AKT的活化可促进肿瘤细胞的增殖[10,16]。另有研究发现,Siglec-15,SMAD7和ATP5A1在肿瘤中表现出相同的表达趋势,它们可能共享一些促进肿瘤侵袭性的途径[12]。在肾透明细胞癌中,研究发现LINC00973通过miRNA-7109作为竞争性内源RNA调控Siglec-15的转录表达[17]。这些提示Siglec-15在促进肿瘤免疫逃逸外,还可能直接参与肿瘤细胞内部机制促进恶性进展。本研究发现癌组织中Siglec-15表达是不良预后因素,高表达Siglec-15的患者PFS及OS均较差。Li等[12]利用TCGA数据库分析显示,Siglec-15 mRNA在包括食管癌在内的多个实体瘤中高表达。该研究发现Siglec-15 mRNA高表达与患者OS关系在不同瘤种间存在差异,较高水平Siglec-15 mRNA在胰腺导管腺癌、肉瘤肾透明细胞癌的总生存期较差,但在乳腺癌、头颈部鳞状细胞癌、甲状腺癌和子宫内膜癌则相反[12]。Hao等[18]使用324个肿瘤微阵列上的NSCLC外科手术样本行免疫组织荧光分析,结果显示Siglec-15在肺腺癌中的表达明显高于鳞状细胞癌,Siglec-15表达与早期NSCLC的预后无关。本研究首次在ESCC中证实,高表达Siglec-15蛋白与患者临床病理及预后相关,这些发现支持Siglec-15作为食管癌患者的预后预测因子。未来研究应确定驱动和维持食管癌组织中Siglec-15表达的机制,以指导开发治疗干预靶点。
综上所述,该研究是目前首例分析Siglec-15蛋白与食管癌临床预后关系的研究。本研究发现Siglec-15在食管癌组织中高表达,高表达Siglec-15与肿瘤恶性进展及患者不良生存相关,Siglec-15是食管癌患者生存的新型独立因子。本研究为高表达Siglec-15食管癌患者使用免疫检查点抑制剂奠定了一定基础,阻断Siglce-15可能重新激活这些患者的抗肿瘤免疫反应。
