从原子到分子和细胞的电感耦合等离子体质谱绝对定量分析
2021-04-15严晓文杨利民王秋泉
严晓文,张 博,杨利民,陈 石,王秋泉
(厦门大学化学化工学院,谱学分析与仪器教育部重点实验室,福建 厦门 361005)
化学元素周期表中的稳定同位素普遍存在于生命体中[1],或为生命必需元素,或为生命运行过程的辅助因子,或为产生异常行为或疾病的罪魁祸首.为了适应赖以生存的环境变迁,生命体吸收利用有益元素或钝化有害元素[2-8]以延续生命进程.以有害元素汞(Hg)为例,为抵御Hg的侵害,动植物都进化了各自的抵御机制.在发展元素分析方法的基础上[9-12],我们发现与其他有害元素相比,Hg的毒性主要体现在与含巯基(—SH)分子的相互作用[13-15],形成—Hg—S—准共价键(键长0.251 nm,键能217 kJ/mol,稳定常数在1035~1044数量级),干扰正常生理活动甚至致命.从研究角度看,设计合成尺寸不同的Hg标签,可对生物大分子所含的自由—SH和二硫键—S—S—进行精准测定[16],并探测自由—SH所在生物分子的活性域位点[17],深化对Hg的毒性机制和生物本身固有的抵御Hg侵害途径的认识,为相关治疗药物的设计和研发提供新思路.此外,Hg的这一特性启示我们可以利用Hg来标记生物分子,经原子光谱或电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)对Hg的测定实现对生物分子的定量分析[18-20].在原子光谱分析技术的发展过程中,人们逐渐意识到ICP不仅可作为原子发射光谱的光源,还可为已处于激发态的原子提供更多能量,使其进一步离子化,用MS读出同位素离子信号,从而诞生了具有更高灵敏度、更宽线性范围和同位素检测能力的ICP-MS (图1)[21].遗憾的是,Hg在ICP中的离子化效率只有不到40%,限制了其检测灵敏度的提高;而且Hg的毒性严重制约了其广泛使用的可能性.要使原本以元素分析为主要目标的ICP-MS发展成为生物分子的分析工具,充分发挥ICP-MS的灵敏准确且可提供同位素信息的优势,将难检测的、含量极低的关键生物分子的绝对定量转变为元素的ICP-MS分析,必须要有新的思路和策略(图2)[22-25].
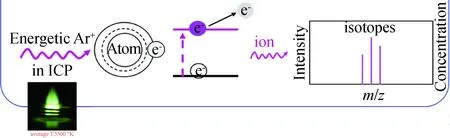
图1 ICP-MS的原理示意图Fig.1 Schematic diagram of ICP-MS
利用抗原和抗体间的免疫识别能力,通过测定标记在抗体上的金属元素可以实现抗原分子的分析[26-28].在关注生物分子的组成、结构和构象时,我们发现生物大分子中很多特定的官能团,特别是蛋白质分子的氨基酸残基和翻译后的修饰基团,可以直接进行化学修饰,用以明确化学计量比的共价标记[23,29];而且生物在不断的进化过程中所发展的自身代谢机制和伴随的蛋白质机器网络,为在生物大分子中组装带有可后修饰基团的关键分子模块提供了可能性[30];此外,对于集成了众多生物分子的细胞,可以针对其自身所集成的生物分子进行化学选择性或生物特异性元素标记,实现细胞分析[31];利用核酸的碱基互配原理和聚合酶链反应信号放大策略实现单病毒水平的计数[32];元素编码标记的病毒纳米衣壳蛋白颗粒又可作为生物分子或细胞分析的信号倍增器[33],实现单细胞表面生物分子的定量检测.
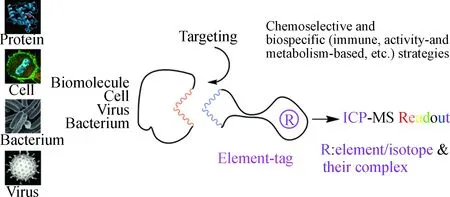
图2 从原子到分子、细胞的ICP-MS分析方法学Fig.2 Analytical methodology using ICP-MS from atoms to molecules and cells
1 蛋白质生物标志物分子分析方法学
1.1 化学选择性标记策略
基因组学的研究表明,人类基因编码的蛋白质分子中约96%都含有至少1个半胱氨酸,其巯基可被如前所述的Hg标签所标记[18-20],也可与马来酰亚胺(maleimide, MAL)以1∶1的化学计量比选择性反应.我们选择含有MAL基团的大环分子MAL-DOTA(1,4,7,10-tetraazacyclododecane-1,4,7-trisacetic acid-10-maleimidoethylacetamide),其中MAL作为反应基团,DOTA可配位装载生物背景极低、在ICP-MS中离子化效率极高的非放射性镧系元素(lanthanides,Ln: La,Ce,Pr,Nd,Sm,Eu,Gd,Tb,Dy,Ho,Er,Tm,Yb,Lu),获得MAL-DOTA-Ln元素标签(图3).以Eu标签为例,与高效液相色谱(high performance liquid chromatography,HPLC)联用,通过形态非特异性同位素稀释(species-unspecific isotope dilution,SUID) ICP-MS对Eu的测定来实现完整蛋白质生物标志物分子的绝对定量分析(图4)[34].

图3 MAL-DOTA-Eu标记的巯基结构Fig.3 Structure of MAL-DOTA-Eu labeled —SH
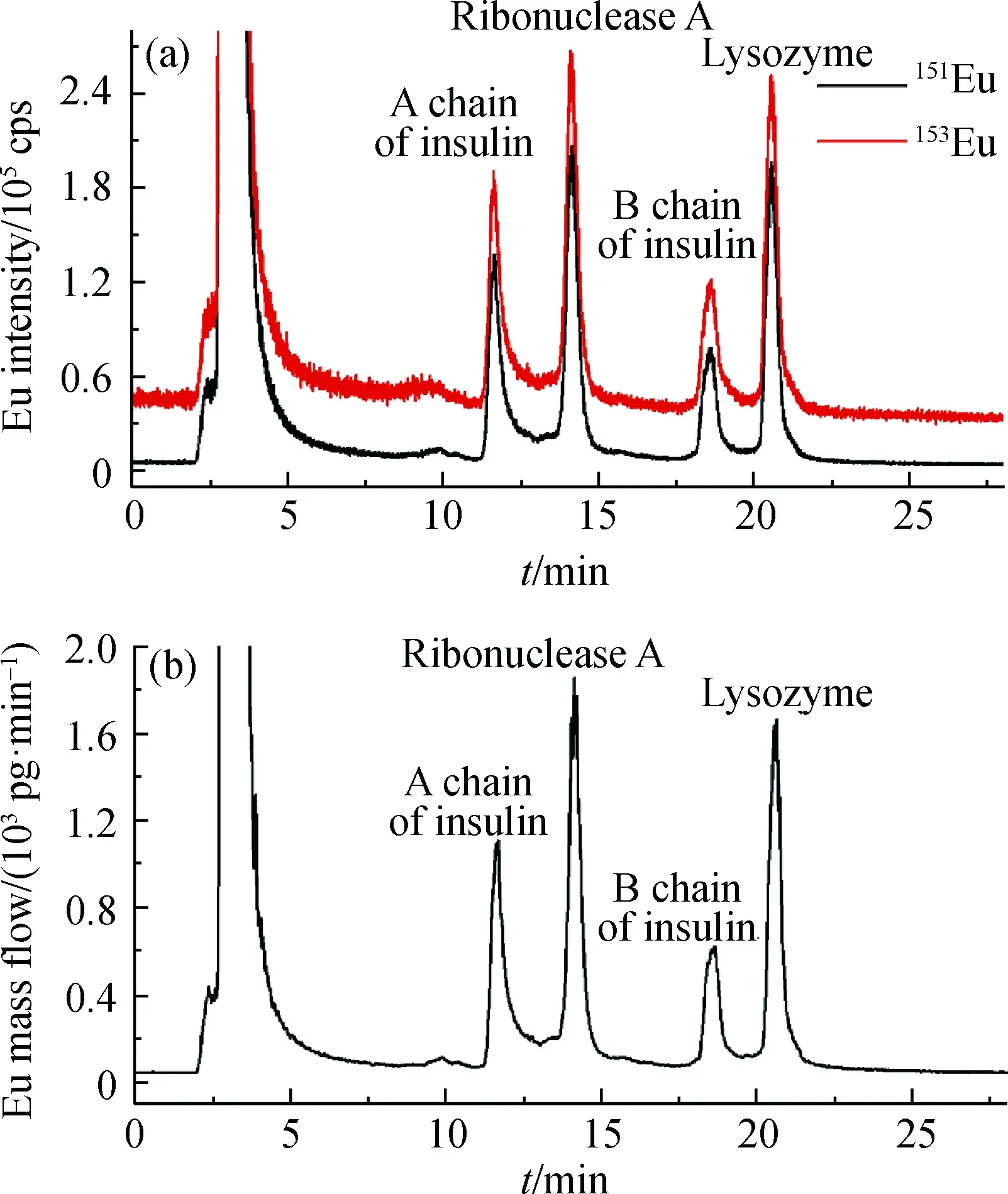
图4 胰岛素A链、胰岛素B链、核糖核酸酶A和 溶菌酶的151Eu和153Eu 色谱图(a) 及由其转变而来的Eu质量流图(b)[34]Fig.4 151Eu and 153Eu isotope chromatograms of the A chain of insulin,B chain of insulin,ribonuclease A, and lysozyme (a) and Eu mass flow chromatogram translated from them (b)[34]
1.2 生物特异性标记和选择性释放策略
化学选择性元素标记是针对生物分子中某一可化学修饰的基团(如—SH)展开的,而ICP-MS元素分析检测的是所标记的原子.如果针对所有目标生物分子的相同基团标记同一种元素,生物分子则应以“时间分辨”的方式依次进入ICP-MS中进行检测,这时基线分离就非常必要了.虽然各种各样的分离技术和新型色谱固定相材料已有长足的发展[35-43],但是要想分离复杂样品(如蛋白质组样品)中的所有组分并间隔排列地送到ICP-MS中,目前尚有难度.因此,为降低分离难度,针对目标生物分子靶向进行元素标记是一个可行的途径.我们基于蛋白酶活性抑制原理,发展了针对丝氨酸蛋白酶家族(serine proteases,SPs)成员的绝对定量分析方法.首先对广泛采用的4-(2-氨基乙基)苯磺酰氟抑制剂分子中的磺酰氟基团(—SF)进行炔基(alkyne,ALK)化修饰获得SF-ALK,并通过点击化学(click chemistry,CC)反应将N3-DOTA-Eu与SF-ALK链接,获得靶向SPs的活性抑制Eu标签分子(SF-DOTA-Eu)(图5),实现了细胞和组织中胰凝乳蛋白酶和弹性蛋白酶的定量检测(图6)[44].运用类似的策略,设计制备一个针对人类P450酶家族中CYP3A4具有选择性活性抑制的双功能己基化17α-炔雌二醇-DOTA-Eu探针,实现了CYP3A4的选择性定量和活性评价(图7)[45];针对组织蛋白酶活性位点上的半胱氨酸设计环氧开环抑制剂分子-Eu探针“标尺”,不仅可以对细胞溶酶体中组织蛋白酶的活性进行评价,而且实现了溶酶体的pH检测(图8)[46].将化学选择性捕获标记和生物酶选择性释放策略相结合可极大地提高分析方法的选择性.针对蛋白质酪氨酸磷酸化(pY)的选择性分析,我们将双镓配合物(Ga-complex)经一个光刻裂解基团链接组装到Fe3O4@SiO2—COOH磁性纳米颗粒表面,Ga捕获所有含磷酸基团的生物分子,再利用酪氨酸磷酸酶PTP-1B选择性释放Ga-pY,最后由HPLC/71Ga-SUID-ICP-MS实现pY的定量分析(图9)[47].
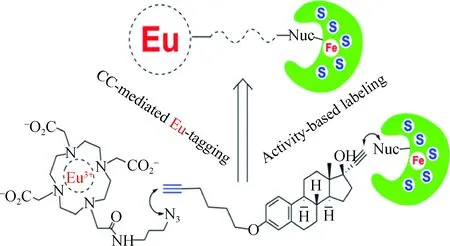
图7 P450酶家族中CYP3A4的选择性定量和活性评价[45]Fig.7 Selective quantification and activity evaluation of CYP3A4 in P450 enzyme family[45]
1.3 生物特异性免标记策略
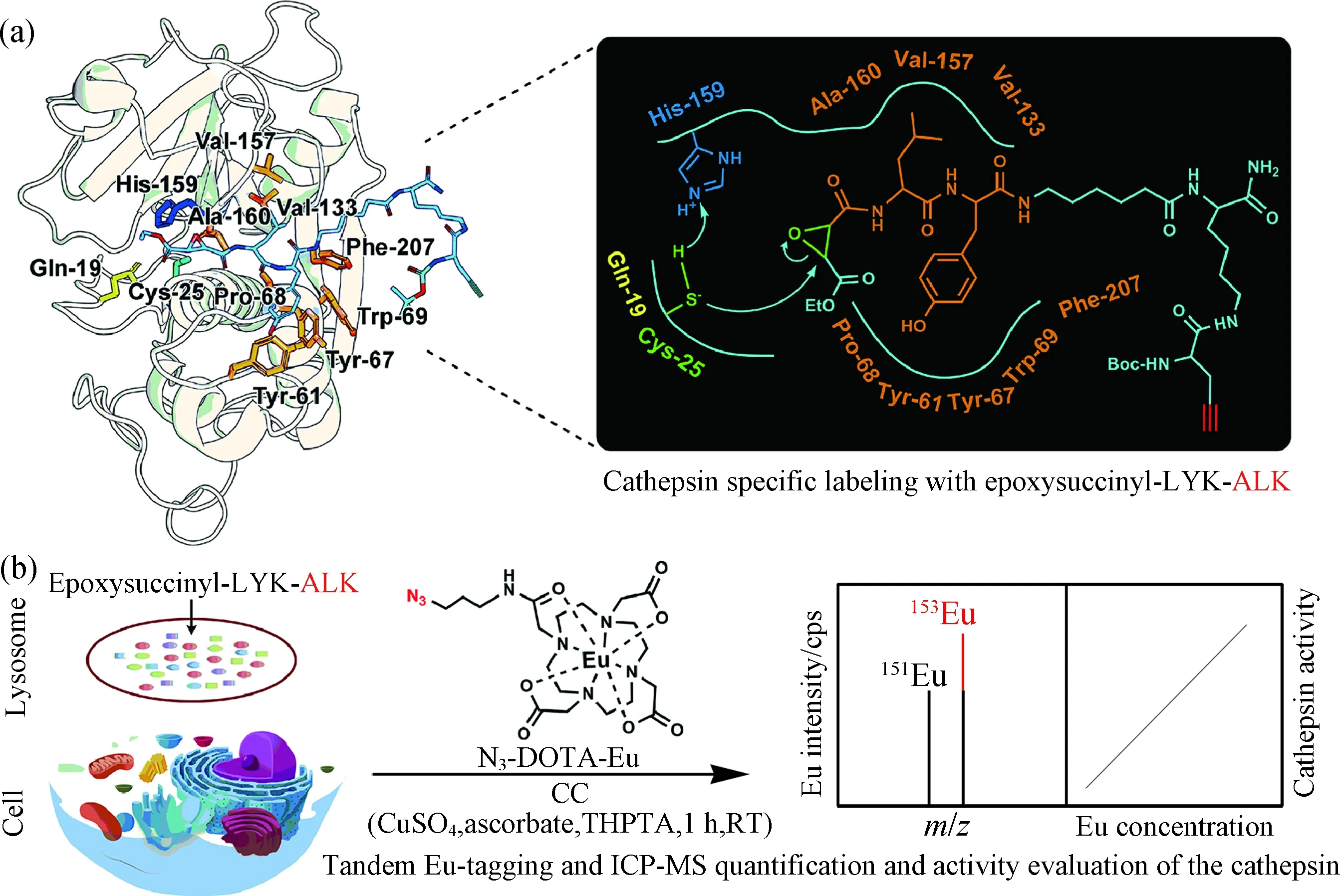
(a)环氧琥珀酰-LYK-ALK对组织蛋白酶活性域中Cys25的不可逆共价标记,以及L和Y与活性域中氨基酸的 相互作用放大图;(b)153Eu-SUID-ICP-MS检测pH依赖的组织蛋白酶活性.图8 环氧琥珀酰基-LYK-ALK活性抑制和N3-DOTA-Eu的点击标记[46]Fig.8 Epoxysuccinyl-LYK-alkyne inhibitory and clickable N3-DOTA-Eu tagging[46]
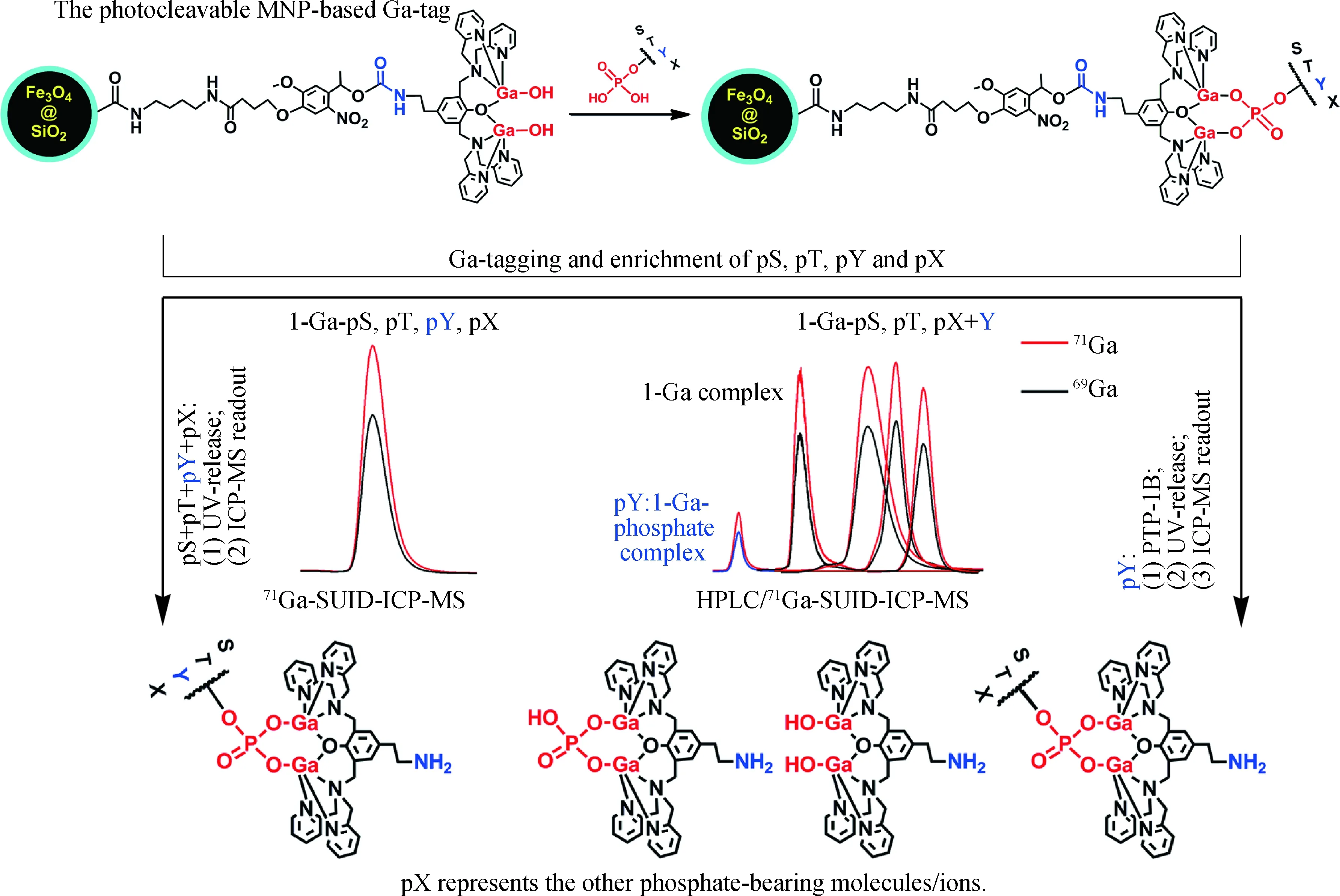
图9 集标记、富集和紫外光-释放磷酸化或含磷酸基团分子/离子功能于一体的光可裂解磁性Ga-标签, 以及酪氨酸磷酸酶PTP-1B辅助下pY的HPLC/71Ga-SUID-ICP-MS选择性定量[47]Fig.9 Photocleavable magnetic nanoparticles-based Ga-tag for tagging,enrichment,and UV-release of phosphorylated and phosphate-bearing molecules/ions and pY selective quantification using HPLC/71Ga-SUID-ICP-MS under the assistance of a protein tyrosine-specific phosphatase PTP-1B[47]
蛋白酶分子具有特异性切断其底物多肽序列的特性.我们针对目标蛋白酶设计了两端分别编码DOTA-Ln MS报告基团和分离“抓手”彩色纳米颗粒的多肽底物;当样品中存在目标蛋白酶分子时,就会专一性切断底物多肽同时释放DOTA-Ln,继而通过ICP-MS定量分析Ln,实现蛋白酶分子的定量和活性评价(图10)[48].这种生物专一性的蛋白酶分子分析平台的构建实现了蛋白酶分子的免标记定量分析,充分发挥了ICP-MS同时多元素分析的特性,克服了光分析方法存在的光学信号稳定性不足和光谱重叠干扰的缺点.在这一ICP-MS分析平台上可以开展很多针对蛋白酶的研究工作,如酶抑制剂药物的高通量筛选等.
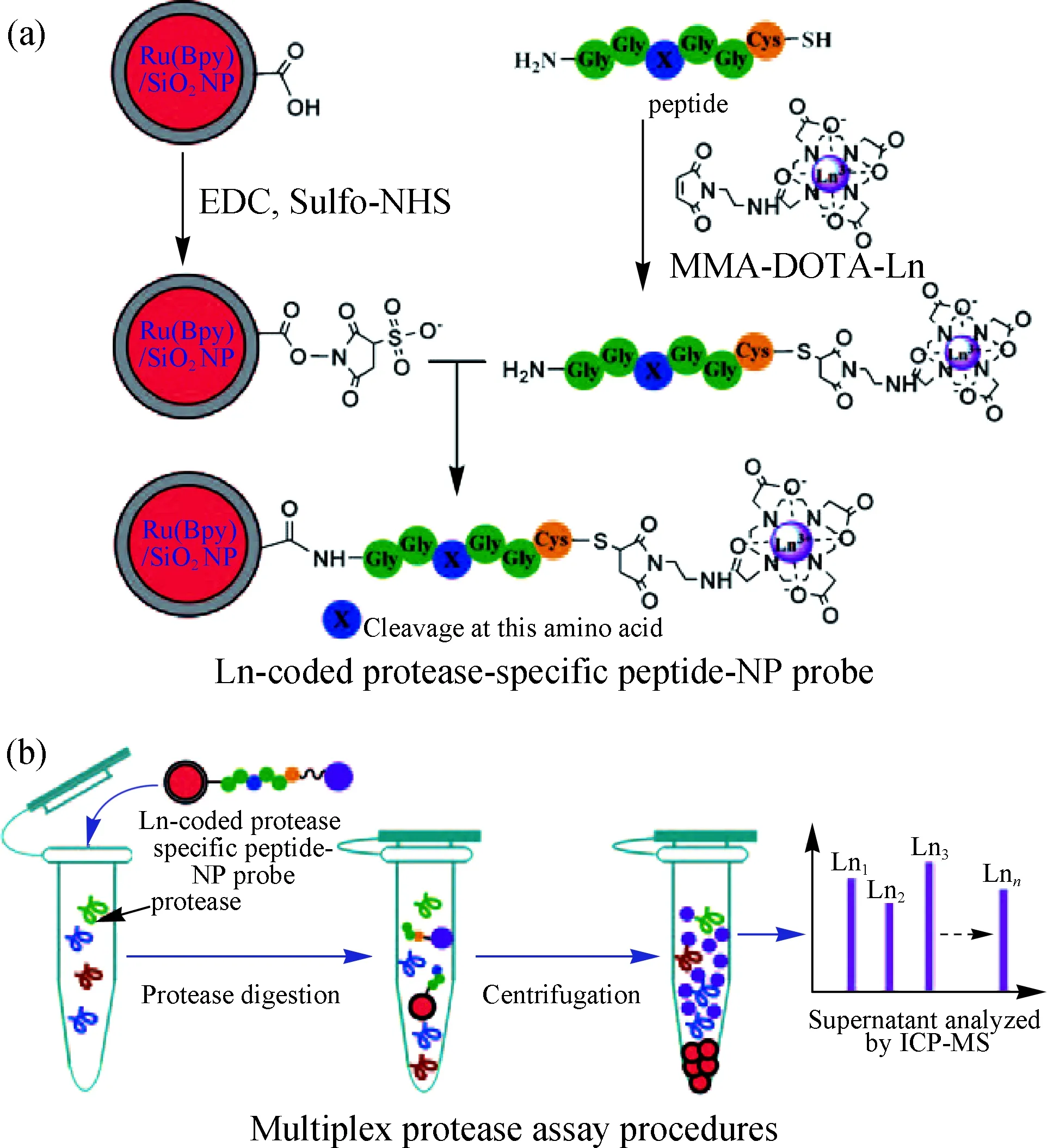
(a)Ln编码的蛋白酶特异性纳米探针的设计合成,其中 Bpy.2,2′-联吡啶,EDC.乙基-N′-[3-(二甲氨基)丙基] 碳二亚胺盐酸盐,NHS.N-羟基丁二酰亚胺;
以上针对蛋白质生物标志物分子所发展的化学选择性和生物特异性元素标记策略使得ICP-MS不仅充分发挥其元素分析的特长,而且使其应用拓展至生物分子分析领域.相比于电喷雾离子化/基质辅助激光解离电离质谱(electrospray ionization/matrix-assisted laser desorption ionization mass spectrometry,ESI/MALDI-MS)等软电离源MS,ICP-MS具有更高的灵敏度和更宽的线性范围,使用简单的单一富集同位素标准即可实现多种生物分子的绝对定量分析.需要指出的是,所发展的分析方法学不仅限于我们研究中所涉及的生物分子,也适用于其他重要的蛋白质标志分子的分析.
2 病毒、细菌和细胞分析
区别于上文的生物分子分析,细胞集成了多种生物分子.病毒、细菌和细胞直接分析获取的结果是不同生物分子协同作用的综合反映,为生物医学研究和临床诊断提供了实验证据.
2.1 核酸介导的病毒分析
病毒的结构相比于哺乳动物细胞相对简单,其中核酸(DNA/RNA)常用于病毒分析.利用核酸的碱基互配选择性,我们针对人类免疫缺陷病毒、甲肝和乙肝病毒的核酸保守序列设计单链捕获DNA(ss-Cap-DNA)并修饰在磁性纳米颗粒上;编码有Ln的报告DNA[ss-Rep-DNA-DOTA-Ln(Eu,Tb,Ho)],经DNA滚环扩增(rolling circle replication,RCA)信号放大,通过Eu、Tb和Ho的ICP-MS定量实现了百余个病毒拷贝的检测,为病毒的高灵敏准确计数提供了一个新方法(图11)[32].
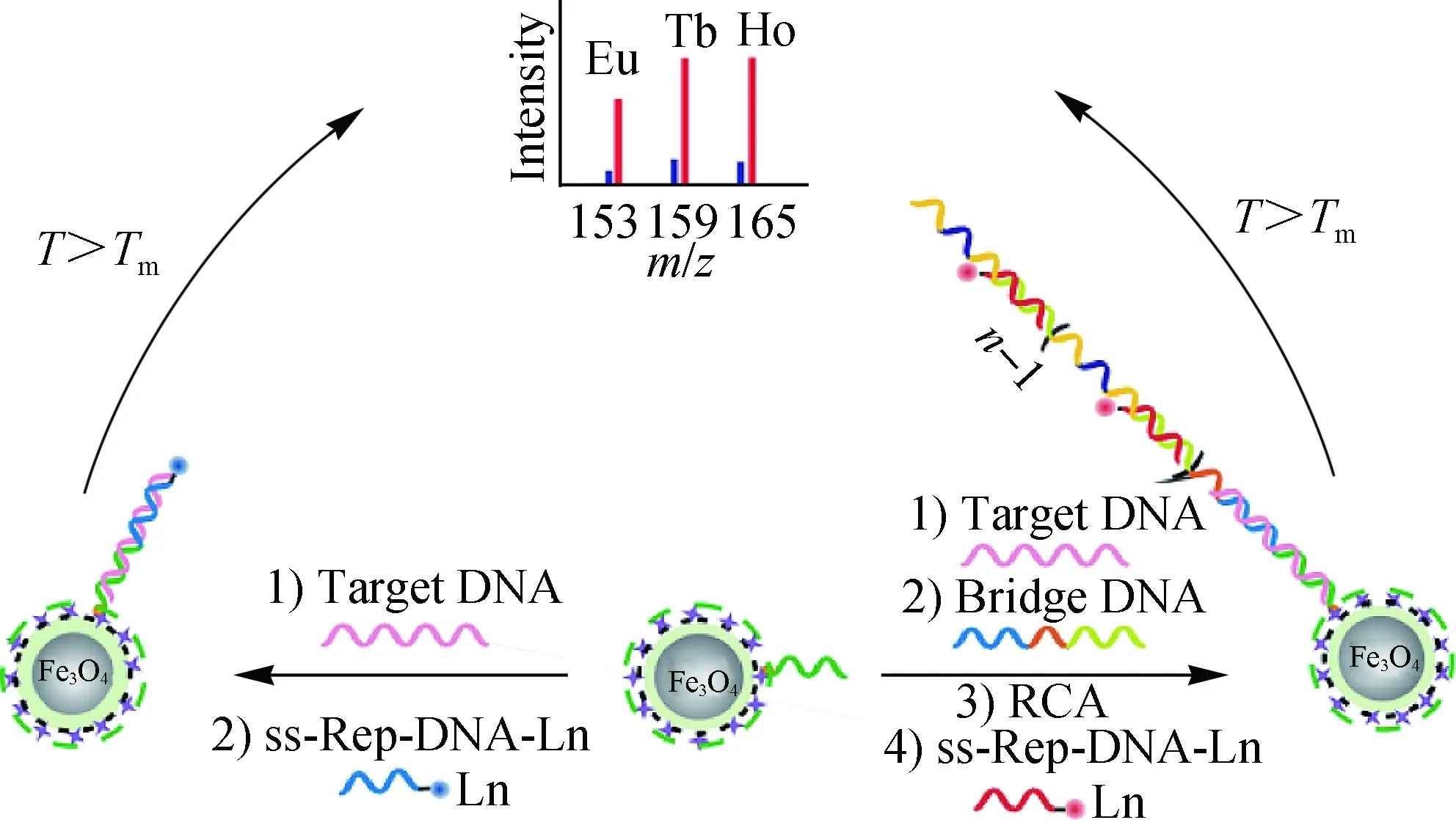
图11 DNA介导的病毒ICP-MS分析[32]Fig.11 DNA-mediated analysis of viruses using ICP-MS[32]
2.2 非天然氨基酸代谢和CC介导的单细菌分析
细菌区别于其他生命体的一个特点是其含有支撑细胞壁的肽聚糖(peptidoglycan,PG)结构.PG可以看作是一个完整的高分子,由D-Ala交联L-Ala-γ-D-Glu-L-Lys/m-DAP-D-Ala-D-Ala(Ala.丙氨酸;Glu.谷氨酸;L-Lys.革兰氏阳性菌;m-DAP.革兰氏阴性菌)形成.生物学研究表明,细菌可利用自身的蛋白质机器将非天然的D-Ala代谢组装到PG中.我们利用细菌的这一特性,采用炔基化的二肽ALK-D-Ala-D-Ala为底物,代谢组装ALK-D-Ala到细菌细胞壁中,通过生物正交的CC反应将N3-DOTA-Eu标记在细菌细胞壁上,实现了细菌的元素标记.由于有至少105的ALK-D-Ala代谢到细菌细胞壁中以及定量的CC反应效率,相对于单个细菌,通过对Eu的ICP-MS检测可以实现5个数量级的信号放大;利用标记有不同Ln的细菌多克隆抗体,又可以对所定量的细菌种类进行识别鉴定.这一方法学的发展为细菌分析开辟了一条新途径,可以实现多种细菌的同时定性和定量分析(图12)[49].
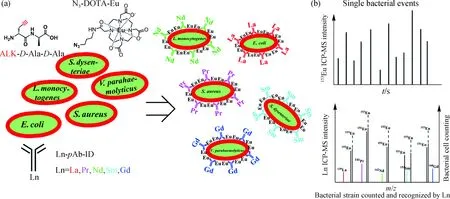
(a)ALK-D-Ala-D-Ala二肽代谢组装N3-DOTA-Eu标记和La、Pr、Nd、Sm及Gd编码的细菌多克隆抗体识别, 以大肠杆菌(Escherichia coli),金黄色葡萄球菌(Staphylococcus aureus),李斯特菌(Listeria monocytogenes), 痢疾志贺菌(Shigella dysenteriae)和副溶血弧菌(Vibrio parahaemolyticus)为例;(b)151/153Eu、139La、141Pr、142Nd、152Sm和160Gd单细菌ICP-MS分析.图12 非天然氨基酸代谢和CC介导的单细菌ICP-MS分析[49]Fig.12 Unnatural amino acid metabolism and CC mediated single bacterial ICP-MS analysis[49]
2.3 单细胞分析平台和信号倍增策略
细胞群体分析在一定程度上体现了细胞的平均行为,并不能反映细胞间的差异.作为生命基本单元的细胞集成了多种生物分子,这些生物分子的协同作用决定了细胞的正常生理特性和病变征兆.单细胞分析不仅可以探明细胞间的行为差异,而且可为理解细胞间差异的生物学来源和精准的疾病诊断提供确切依据.除了发展针对细胞表面生物分子靶向标记策略外,对于真正意义上的单细胞分析还需要解决两个必须面对的问题:1) 单细胞的分选和有序排列,2) 提高检测灵敏度以满足单细胞分析的要求.为此,我们设计制作了无油(NH4HCO3)微流控芯片操控细胞有序排列(可调控通量为400~25 000 min-1),设计制作了直接注入式细胞进样接口提高细胞的传输(100%)和检测效率(大于70%),仅仅采用可热分解的NH4HCO3溶液来调控细胞间的间隔时间,一方面降低油-水液滴包裹细胞方法对后续MS检测的干扰,另一方面与MS的检测速度相匹配(图13)[50].提高检测灵敏度对单细胞分析尤为重要.利用噬菌体MS2衣壳蛋白可修饰氨基酸残基的特点,我们发展了可控修饰元素报告标签和靶向基团的策略,获得了具有明确Ln原子个数的MS2纳米颗粒,作为ICP-MS检测的信号倍增器,灵敏度提高的数倍与Ln的个数相当.在具体针对KB细胞分析时,MS2衣壳蛋白上可以修饰1 000个Eu,相比于单纯使用DOTA-Ln配合物分子,灵敏度提高了3个数量级(图14)[33].单细胞操控分析平台的搭建和病毒样纳米颗粒信号倍增策略的发展,为基于ICP-MS的单细胞分析研究的进一步展开提供了硬件和方法学保证.
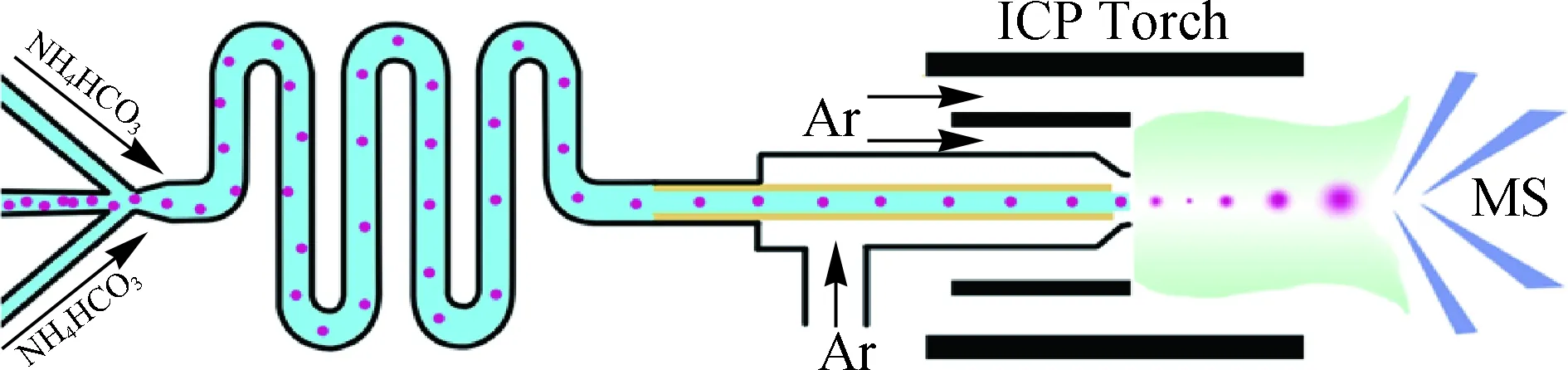
图13 无油微流控分选-直接注入式单细胞ICP-MS分析平台[50]Fig.13 Direct infusion ICP-MS of lined-up single-cell using an oil-free passive microfluidic system[50]
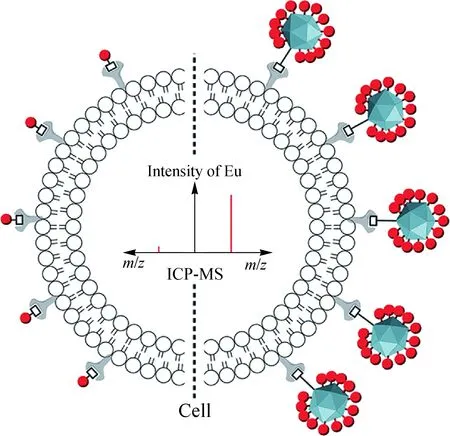
图14 元素标记的病毒样纳米颗粒与细胞 分析信号倍增策略[33]Fig.14 Element-tagged viruslike nanoparticle and signal multiplication strategy for cell analysis[33]
3 总结与展望
从原子到分子和细胞分析方法学经过近20年的不断发展,使原本以元素分析为目的的原子光谱和ICP-MS拓展至分子乃至细胞、细菌和病毒的检测.更为重要的是,ICP-MS和所构建的元素标签工具箱可帮助我们探知尚未了解的生命现象和背后的机制,理解生命过程.一方面,目前所知的金属和类金属元素在细胞中的分布和含量信息几乎都是基于细胞群体分析方法获得的,单细胞ICP-MS分析可以使我们在单细胞层面上进一步理解关键内源金属和类金属的生理/病理作用,推动金属组学研究的发展;另一方面,所发展的化学选择性和生物特异性元素标记策略可以使我们涉猎以往难以想象的单细胞中超痕量生物分子的检测,充分发挥ICP-MS直接分析完整细胞的优势.可以预见,随着基于ICP-MS生物分析方法的不断发展,生命元素和分子的功能和细胞的行为将被进一步了解以促进新药物的设计和研发,疾病的诊断与治疗将更加精准,健康的维护将得到进一步提升.
致谢:感谢黄本立先生的教诲!感谢曾经在实验室工作和学习过的同仁和学生们的辛勤工作!
