国人胰背动脉、胰十二指肠下动脉的CT解剖观察
2021-04-14杨英刘戬王旭徐同江刘建新尹晓明
杨英,刘戬,王旭,徐同江,刘建新,尹晓明
(应急总医院 影像科,北京 100028)
胰腺切除为高侵袭性手术,并发症率高达30%~40%,且具有一定的病死率(1%~3%)[1-3]。术中精细操作,小心分离胰周血管,能显著减少术中出血,加速术后康复。胰腺血供丰富,胰体尾部主要由脾动脉的分支供血,包括胰背动脉(dorsal pancreatic artery,DPA)、胰大动脉、胰横动脉等;而胰头钩突部接受肝动脉及肠系膜上动脉分支的双重供血,包括胰十二指肠上、下动脉(inferior pancreaticoduodenal artery,IPDA)等[4]。与此同时,胰腺供血来源、走行存在较多变异,增加了手术的难度及术中出血的风险。胰腺外科中,无论是胰头部切除还是胰体尾部切除,均可能涉及DPA及IPDA的解剖,故本研究选取上述两支血管为研究对象。
多层螺旋CT具有很高的空间分辨率,是目前胰腺疾病诊断中最常用的影像学检查手段。目前国内外指南对胰腺CT 参数的推荐略有差异。国内,中华医学会外科学分会胰腺学组《胰腺癌诊治指南》推荐<3 mm的多平面检查,以准确描述肿瘤大小、部位、有无淋巴结转移,特别是与周围血管的结构关系[5];而NCCN指南推荐胰腺CT检查进行亚毫米(0.5~1 mm)级扫描[6]。CT图像后处理技术,如最大密度投影(maximum intensity projection,MIP)、容积再现(volume rendering,VR)可直观的反应血管形态、走行、异常改变,血管钙化程度及范围,为准确的评估血管状态提供便捷手段[7-9]。本研究收集2016年 12月—2017年6月在我院行腹部增强CT检查患者的影像学资料并进行薄层多平面、MIP及VR等处理,观察DPA及IPDA支数、发出部位、与上级血管根部的距离,并比较不同的CT后处理技术对相应血管的检出率,以期为外科行胰腺切除手术提供丰富的解剖学信息。
1 资料与方法
1.1 研究对象
收集2016年12月—2017年6月在应急总医院放射科行腹部增强CT检查患者的影像资料,并与其他临床资料对照,诊断明确、资料完整的患者进入研究。排除标准包括:(1) 患者诊断为胰腺(胰周)疾病、胆道系统或十二指肠疾病;(2) 患者既往接受过肝胆胰系统及十二指肠手术史;(3) 其他可能影像胰周血管走行的疾病,如巨大腹膜后肿瘤、肾肿瘤等;(4) 图像不清晰,无法识别血管。
1.2 CT 扫描
所有患者扫描前20 min口服水或牛奶500 mL充盈胃肠道。采用64层LightSpeed VCT或宝石CT(通用公司,美国),腹部容积扫描程序,扫描条件:120 kV,250~380 mAs,转速0.8秒/周,准直40 mm,层厚3.75 mm,层间距3.75 mm,矩阵512×512。扫描范围膈顶至髂前上棘水平。增强扫描对比剂使用非离子型对比剂碘普罗胺(先灵药业,广州)或碘氟醇(恒瑞医药,江苏),采用双筒高压注射器经前臂正中静脉穿刺团注,剂量为2 mL/kg,注射速率3.0~4.0 mL/s,总剂量100 mL。对比剂注射完成后,使用50 mL生理盐水以相同流率冲管。所有患者均行平扫、动脉期、门静脉期及延迟期扫描。采用团注跟踪技术,当腹主动脉CT值达120 Hu后,延迟6 s自动触发扫描。
1.3 图像后处理
将所有动脉期图像在工作站上重建成层厚、层间距均为0.625 mm的薄层图像后传至后处理工作站(ADW4.6后处理工作站,通用医疗公司,美国),并进行图像后处理。主要包括:(1) 多平面重建(multiplanar reconstruction,MPR),对薄层图像进行层厚及层间距均分别为1 mm,3 mm 及5 mm 时横断位重建,横断位视野范围(field of view,FOV)为35 cm,冠状位FOV为40 c m;(2) VR 与MIP,两者均在容积再现模式下进行后处理,针对目标区域,为避免遗漏少见或罕见的变异,重建范围上缘至膈顶,下缘至髂前上棘水平,确定目标血管后将FOV缩小至为15~20 cm,左右方向旋转,每间隔10°保存一幅图像,共保存36 幅图像;(3) 多层面容积重建(multiplanar volume reconstruction,MPVR),将薄层的横断位图像进行冠状位及矢状位重建,在窗位60~80 Hu、窗宽为200~400 Hu时(由于每个患者的循环情况不一,即使采用跟踪技术和经验值触发扫描,仍有血管显示不佳情况,为显示细小血管,阅片及后处理时可根据血管充盈情况增大窗宽),层厚为18 mm,层间距为3 mm,FOV为15~20 cm,得到动脉期胰腺直接供血动脉的高分辨图像;(4) 曲面重建(curved projection reformation,CPR),延血管走行重建,由两名有经验并熟悉胰腺血管解剖的放射科医师共同观察DPA及IPDA[10-12],对有争议的案例商议后共同决定,若血管管径纤细(直径<2 mm),可将图像传至诊断工作站,在屏幕分辨率为5 M的浏览器阅片后对目标血管进行CPR重建,并在此模式中“Curve”模式测量相应数据。
1.4 观察指标
DPA:发出部位;发出部位与上级血管根部距离。若DPA发自脾动脉(splenic artery,SpA)或肝总动脉(common hepatic artery,CHA),记录发出部位与SpA、CHA分叉部的距离;若DPA来自SMA,则记录与SMA根部的距离。DPA发自SMA的患者,记录DPA的发出位点(0~12点)。IPDA:支数;发出点位(0~12点);发出部位与上级血管根部距离。由于血管走行非直线,使用GE工作站的“Curve”功能进行距离测量。为探索最佳CT后处理方式,比较1 mm、3 mm、5 mm MPR及VR重建对目标血管的显示率。
1.5 统计学处理
所有数据采用SPSS 18.0软件分析,χ2检验比较1 mm、3 mm、5 mm MPR、VR重建对目标的血管的显示差异,P<0.05为差异有统计学意义。
2 结 果
2.1 患者资料
2016年12月~2017年6月,共有762例患者行腹部增强CT 检查,结合入组与排除标准,共有211 例患者纳入研究,其中男性98 例,女性 113例;年龄16~92岁,中位年龄57岁;体质量指数(body mass index,BMI)17.5~35.2 kg/m2,中位BMI 26.6 kg/m2。CT检查存在严重器质性病变者占69.1%(146/211)。
2.2 DPA
本组患者DPA显示率为95.3%(201/211)。DPA有2个来源,腹腔干(celiac axis,CA)系统(58.7%,118/201)及肠系膜上动脉(superior mesenteric artery,SMA)系统(41.3%,83/201)。
DPA来自CA者,发自SpA者占49.1%(58/118),发出部位距离SpA根部距离为(2~10)mm,平 均(4.6±2.5)mm;发自CHA者占39.8%(47/118),发出部位距离CHA根部平均距离为(2~10)mm,平均(6.4±2.8)mm;发自SpA、CHA 分叉部者占6.8%(8/118);发自C A 本身者占4.2%(5/118)。所有来自C A 系统的DPA均在距离分叉部10 mm之内(图1)。DPA来自SMA者,发出部位通常在SMA的9~12点位(94.0%, 78/83),距离SMA根部距离为(18~45)mm,平均(26±7)mm,分别有4.8%(4/83)、 4.8%(4/83)、2.4%(2/83)的DPA与替代肝右动脉(replaced right hepatic artery,rRHA)、IPDA及第一空肠动脉(first jejunal artery,FJA)共干。
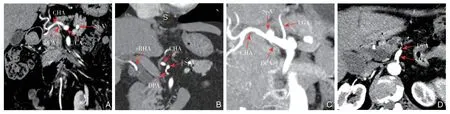
图1 DPA 成像 A:DPA 来源于CHA(冠状位MPR 图);B:DPA 来源于SpA(冠状位MPR 图);C:DPA 来源于CA(冠状位MPVR 图;LGA:胃左动脉);D:DPA 来源于SMA(横断位3 mm MPR 图) Figure 1 DPA imaging A: DPA arising from the CHA (coronal MPR image); B: DPA arising from the SpA (coronal MPR image); C: DPA arising from the CA (coronal MPVR image; LGA: left gastric artery); D: DPA arising from the SMA (transverse 3-mm MPR image)
2.3 IPDA
本组患者IPDA显示率为96.2%(203/211)。分别有171 例(84.2%)、29 例(14.3%)及3例(1.5%)分别存在1支、2支或3 支IPDA (图2)。根据IPDA 与FJA 的关系,可将分其为共干发出、分别发出2种类型。IPDA与FJA共干发出者约占60.1%(122/203),发出部位通常位于SMA的4~7点位(75.4%,92/122),距离SMA根部的距离为(18~54)mm,平均(42±6)mm。 在共干发出者中,约71.3%(87/122)的IPDA 直接分出胰十二指肠上前动脉(anterior inferior pancreaticoduodenal artery,AIPDA)及胰十二指肠上后动脉(posteriorinferior pancreaticoduodenal artery,PIPDA);另有28.7%(35/122)的IPDA延续为AIPDA,而在其头侧发现有PIPDA的比例为71.4(25/35)。
IPDA与FJA分别发出者约占39.9%(81/203),发出部位通常位于SMA 的6 ~9 点位(88.8%,72/81),其中AIPDA、PIPDA于SMA分别发出者占39.5%(32/81)。AIPDA或IPDA主干距离SMA根部距离为(18~52)mm,平均(40±7)mm。
本组患者中,共有10.4%(22/211)可见IPDA与DPA共干,共干血管通常自SMA右侧缘发出,于胰腺系膜内向头侧走形,期间发出IPDA,最终DPA终止于胰颈部背侧。
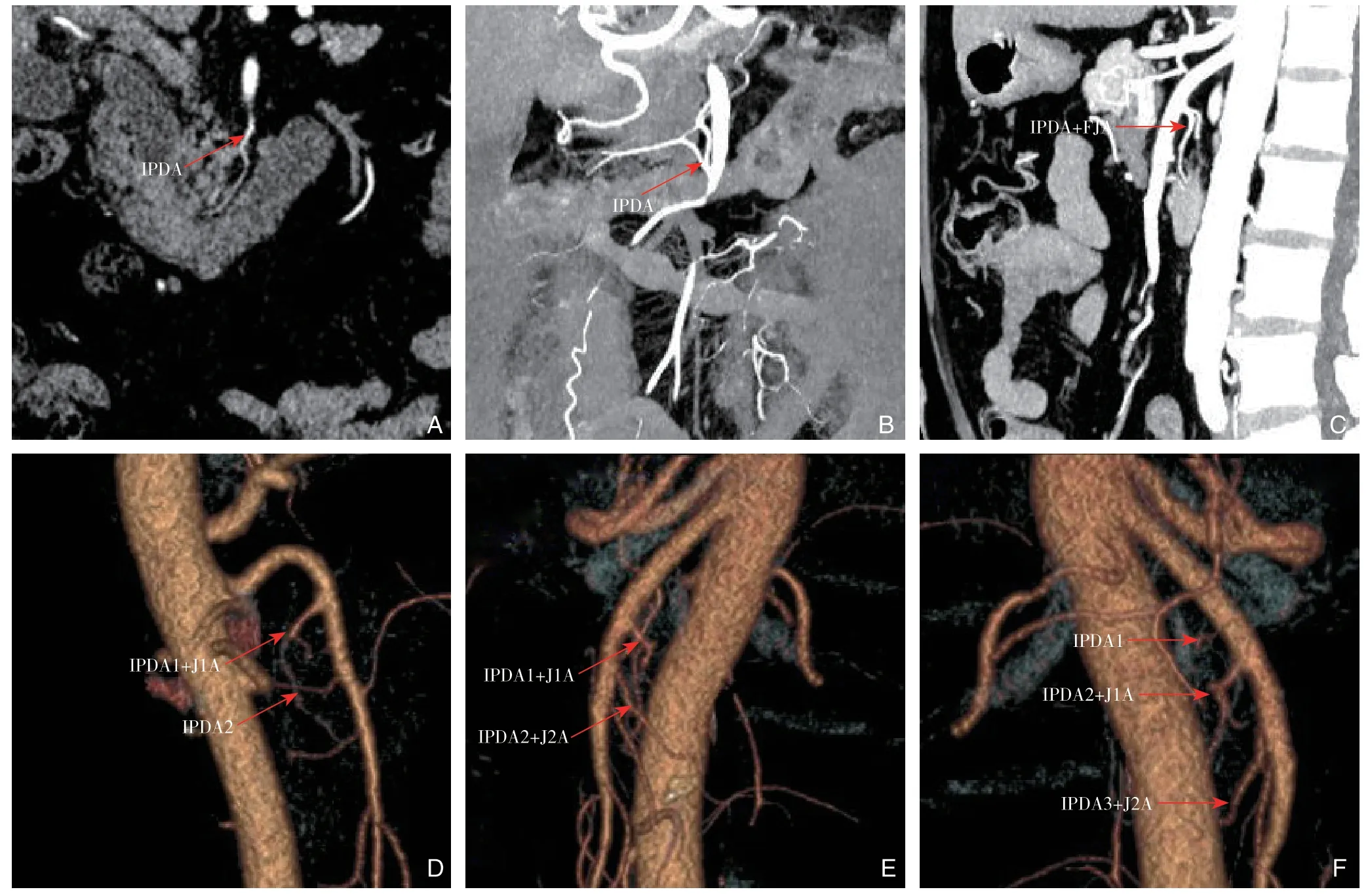
图2 IPDA 成像 A:IPDA 单独自SMA 发出(一支型);B:IPDA 与DPA 共干自SMA 发出(一支型);C:IPDA 与FJA共干自SMA 发出(一支型);D:IPDA 第一支(IPDA1)与FJA 第一支(J1A)共干发出,IPDA 第二支(IPDA2)单独发出(双支型);E:IPDA1、IPDA2 分别与J1A、FJA 第二支(J2A)共干发出(双支型);F:IPDA1 单独发出,IPDA2、IPDA 第三支(IPDA 3)与J1A、J2A 共干发出(三支型)Figure 2 IPDA imaging A: IPDA independently arising from the SMA (single-channel type); B: IPDA and DPA arising from the SMA with a common trunk (single-channel type); C: IPDA and FJA arising from the SMA with a common trunk (single-channel type); D: The first IPDA (IPDA1) originating with the first FJA (J1A) as a common trunk, and the second IPDA (IPDA2) arising independently (double-channel type); E: IPDA1 and IPDA2 originating with J1A and the second FJA respectively (double-channel type); F: IPDA1 independently arising independently, IPDA2 and the third IPDA (IPDA3) originating with J1A and J2A respectively (three-channel type)
2.4 不同技术对DPA、IPDA 的显示率
1 mm MPR、MIP及VR技术对DPA的显示率分别为93.8%(198/211)、95.3%(201/211)、94.3%(199/211),明显优于3 mm(81.5%,172/211)或5 mm(68.7%,145/211)重建 ( 均P <0 .01 ) ; 对IPDA的显示率分别为 94.8%(200/211)、96.2%(203/211)、 94.8%(200/211),明显优于3 mm(78.2%,165/211)或5 mm(67.3%,142/211)重建(均P<0.01)。
3 讨 论
胰腺的供血动脉复杂,胰头部主要由来自CA系统的SPDA及SMA系统的IPDA;胰体尾部主要由来自SpA的DPA、胰大动脉、胰横动脉及胰小动脉供血。考虑到近年来胰腺外科的手术进展,本研究主要涉及IPDA及DPA[13-14]。动脉优先入路联合胰腺全系膜切除是胰十二指肠切除术的主要进展[15-17]。该手术要求首先进行SMA右侧缘的解剖,切断IPDA 以减少手术出血。本研究发现,IPDA多位于SMA的背侧(4~7点位),这提示我们在解剖SMA 右缘时,应尽量将SMA 顺时针旋转,以更好的将IPDA 根部暴露于SMA 右缘,或采用外科学者提出的小肠或胰头旋转技术[18-19]。另外,IPDA通常与FJA共干发出(60.1%),对进展期胰腺癌可考虑行近端空肠系膜切除术。理由为:(1) IPDA与FJA共干,于共干根部切断后,可能影响近端空肠系膜的血供;(2) 癌肿有沿着IPDA与FJA的共干向近端空肠系膜播散的可能[20]。 我们的研究还发现,多数IPDA(71.3%)在胰腺系膜内分支形成AIPDA及PIPDA,但仍有部分患者PIPDA直接来源于SMA,这提示我们在沿SMA右侧缘由远端向近端分离时,即使已经发现一支IPDA,也因警惕其头侧P IPDA 的存在,以免误伤出血。SMA根部距离IPDA约为40 mm,在手术可:(1) 通过充分的Kocher切口,于左肾静脉根部上缘显露SMA 根部,并由此估计IPDA 根部的位置;(2) 定位切断IPDA后,向SMA头侧分离,可根据IPDA的位置,估计Trize胰后筋膜的位置,切透胰后筋膜即可显露SMA根部。
行胰十二指肠切除术时,要求No.8a、12a淋巴结的清扫;而胰体尾癌行根治性胰体尾切除术,要求切除11p淋巴结且要在根部切断脾动脉,均涉及到CA根部的解剖[21-22]。本研究发现,有58.7%的DPA来自CA系统,且均在距离CA分叉部10 mm之内,因此,在解剖CA根部因特别注意DPA的存在。行胰十二指肠切除术时,切断胰腺后,需游离一段胰腺以供胰肠吻合,在此过程中,经常遭遇胰腺上缘的出血,推测即为DPA的出血。发自CA系统的DPA中,有49.1%发自SpA,在清扫N o.11 淋巴结时需注意;另有39.8%发自CHA,在清扫No.8a、8p淋巴结时需注意。DPA另一重要来源为SMA(41.3%),发出部位通常在SMA的9~12点位,这提示我们,SMA腹侧并非无血管区域,这点与SMV不同。rRHA存在是肝动脉系统的主要变异,在胰十二指肠切除术时应保留或进行切除重建[23-24]。本研究发现,部分DPA来自rRHA,手术应小心解剖、结扎DPA以避免rRHA的损伤。
通过本研究,并结合文献报道,笔者认为:(1) 在SMA腹侧,首先出现的血管可能为rRHA、DPA或结肠中动脉;(2) 在SMA背侧,首先出现的血管通常是IPDA或FJA。需根据血管最终的走行确定其身份。
与传统的3 mm、5 mm MPR相比,1 mm MPR对IPDA及DPA有更高的显示率。VR、MPVR技术能更加直观的反应血管的走行及变异,其中MPVR能直接显示血管与周围器官的比邻关系,以更好的确认血管身份[25-27]。除重建技术外,笔者认为,CT对细小血管的显示率,还应考虑:(1) 对比剂的影响。临床工作中可以发现,不同品牌或不同浓度对比剂对细小动脉的显示率有差异。某些品牌不能很好充盈小动脉,从而影响观察。(2) 数据采集时期的影响。动脉期的数据采集如过早,可能动脉尚未充盈;而过晚,可能对比剂已经流空,动脉显影不佳。本研究纳入的多是普通动脉增强的病例,而非CT血管成像(CT angiography,CTA)[28-30],已有文献[28]报道动脉期CT可以显示大血管的病变及形态,在本研究中,由于扫描为容积扫描且薄层重建,纳入病例细小血管均显示良好。尽管普通增强CT的FOV大于CTA扫描,造成辐射剂量较大,但所有病例均因疾病行腹部CT增强,不仅提供了血管信息,同时,也不影响腹部疾病的诊断。(3) 医师的经验。胰周血管多属于3、4级小动脉,解剖复杂,只有经验丰富的医师才能很好的辨识。本研究开始时,寻求了外科医师的帮助。(4) 患者体质量。临床工作中,一般使用100 mL造影剂,可能无法使肥胖患者的细小动脉很好充盈。
本研究为解剖学观察性研究,其实际意义有待于外科医师在手术中进一步证实。从我们的研究看,DPA与IPDA来源复杂,术前1 mm CT重建可提前明确其解剖学特征,有助于术中对相关血管的解剖,减少意外损伤风险。
