DEP结构域蛋白质1B在胰腺癌中的表达及其临床意义
2021-04-14李铭旭仲成成张功铭胡伟王仲
李铭旭,仲成成,张功铭,胡伟,3,王仲,3
(徐州医科大学附属连云港医院 1.肝胆外科 2.病理科,江苏 连云港 222001;3.南京医科大学康达学院第一附属医院 肝胆外科,江苏 连云港 222001)
胰腺癌是最恶性的消化道肿瘤之一,是所有癌症中第四大致死原因[1-2]。胰腺癌早期症状不明显,且易侵犯血管,80%~85%的患者在诊断时已经失去了根治性切除的机会[3-4]。手术切除是唯一可能治愈胰腺癌的方法。然而,其高复发率严重阻碍了胰腺癌患者术后预后的改善[5]。早期诊断困难、肿瘤易转移和多药耐药性是导致预后不良的重要原因[6-7]。因此揭示胰腺癌快速增殖和高度侵袭的分子机制,寻找重要的相关致病因子,明确细胞内各分子间的调控机制,对胰腺癌患者的预后有重要意义。
DEP结构域蛋白质1B(DEPDC1B)位于5号染色体12.1,最早是在人类乳腺癌细胞MDA-MB231中通过mRNA表达谱发现的[8],并进一步发现在胎盘和睾丸中表达,而在心脏和小肠中很少表达。研究发现DEPDC1B调节多种细胞活动功能,包括细胞增殖、迁移、侵袭、细胞周期进展及细胞骨架结构调节[9-10]。在口腔癌[11]、非小细胞肺癌[12]、前列腺癌[13]、肝癌[14]中DEPDC1B过度表达。目前DEPDC1B在胰腺癌组织中的表达及其临床意义尚未清楚。本研究通过检索癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库和高通量基因表达(Gene Expression Omnibus,GEO)数据库,研究DEPDC1B与胰腺癌患者预后的相关性,并通过免疫组织化学方法检测和验证DEPDC1B在胰腺癌组织中的表达情况,分析其与胰腺癌临床病理特征及预后的关系,以期判断其作为胰腺癌临床预后指标的可能性。
1 资料与方法
1.1 数据集下载及整理
下载并分析了GEO 数据库中的胰腺癌队列GSE28735、GSE16515、GSE21501、GSE15471,并分析具有临床预后资料的数据集GSE28735和GSE21501。从TCGA下载胰腺癌的RNA-seq数据及临床信息。缺乏临床信息的患者被排除在外。
1.2 病例资料
选取2010—2019年连云港市第一人民医院接受手术切除的胰腺癌患者,97例患者具有完整的临床病理。其中,男性59例,女性38例;年龄37~92岁,中位年龄63岁。所有标本术后病理均证实为胰腺导管癌,高中分化66例,低分化31例。按照国际抗癌联盟(UICC)TNM分期标准:I~IIA期51例,IIB~IV期46例。所有入组患者术前均未接受任何针对肿瘤的治疗。
1.3 组织学检查及免疫组织化学检查
手术切除的胰腺癌与癌旁组织标本经4%多聚甲醛固定包埋在石蜡后切成4 μm厚的切片。之后切片脱水、固定并用盖玻片覆盖。根据公布的方案进行IHC试验[15]。样品与抗DEPDC1B的兔多克隆抗体一起孵育(5 g/mL稀释,PA5-72875,Invitrogen,CA,美国)。
1.4 免疫组化评分
免疫组化评分[16-17]由阳性细胞比率和染色强度组成,根据阳性细胞比率:<25%为1 分,25%~50%为2分,51%~75%为3分,>75%为4分;染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;将DEPDC1B表达的阳性细胞比率和染色强度相乘,阳性细胞率与染色强度之积分为0~4分为DEPDC1B阴性表达,5~12分为阳性表达;由2名病理医师采用双盲法独立评估免疫组化评分。
1.5 统计学处理
使用了R包中的“survival”、“survminer”来确定生存曲线的最佳截断值来绘制Kaplan-Meier 生存率曲线[18-19],临床相关数据分析采用SPSS 23.0统计软件,计数资料以例数(百分率)[n(%)]表示,采用χ2检验或Fisher确切概率法,使用单因素和多因素Cox回归分析来比较DEPDC1B对预后的影响,P<0.05为差异有统计学意义。
2 结 果
2.1 数据库分析结果
2.1.1 DEPDC1B 在胰腺癌组织中高表达通过TCGA、GEO 数据库分析DEPDC1B 在肿瘤组织和非肿瘤正常组织中的表达水平,结果显示,在TCGA、GSE16515、GSE15471、GSE28735 数 据集中,胰腺癌组织中的DEPDC1B 表达量明显高于非肿瘤正常组织,差异有统计学意义(TCGA:P=0.002;GSE16515、GSE15471、GSE28735:均P<0.001)(图1)。
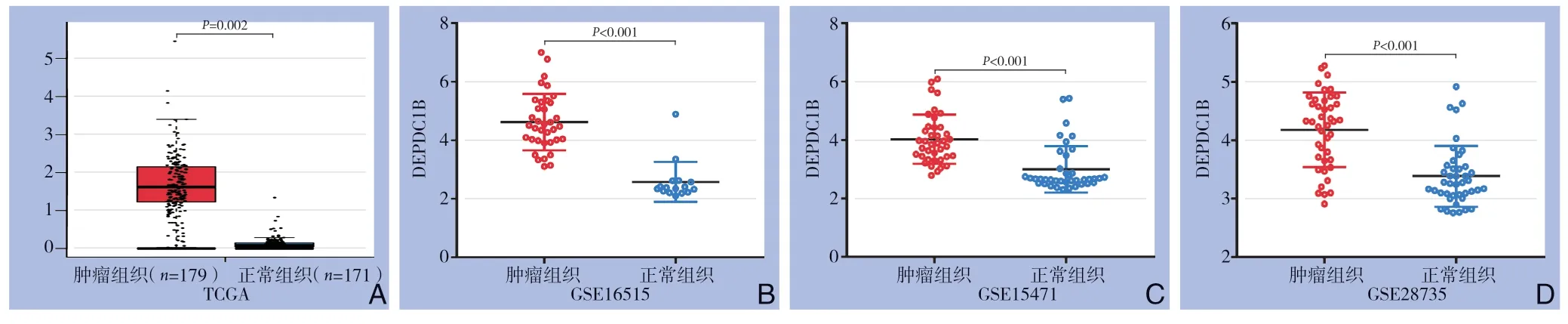
图1 在匹配的非肿瘤组织与肿瘤组织DEPDC1B 基因表达的比较 A:TCGA;B:GSE16515;C:GSE15471;D:GSE28735Figure 1 Comparison of DEPDC1B gene expressionSBetween cancer tissues and paired non-tumoral tissues A: TCGA; B: GSE16515; C: GSE15471; D: GSE28735
2.1.2 DEPDC1B 表达与胰腺癌预后的关系为进一步明确DEPDC1B 的表达与胰腺癌患者预后之间的关系,在GSE28735 数据集和TCGA 数据集中提取了有关DEPDC1B 的临床相关参数,选取最佳截断值后运用Kaplan-Meier 生存曲线进行分析。GSE28735 与TCGA 中,DEPDC1B 的低表达与良好的预后明显有关(GSE28735:P=0.032;TCGA:P<0.001)(图2A-B),在GSE21501 中DEPDC1B 表达与胰腺癌患者预后无明显相关性(P=0.14)(图2C)。
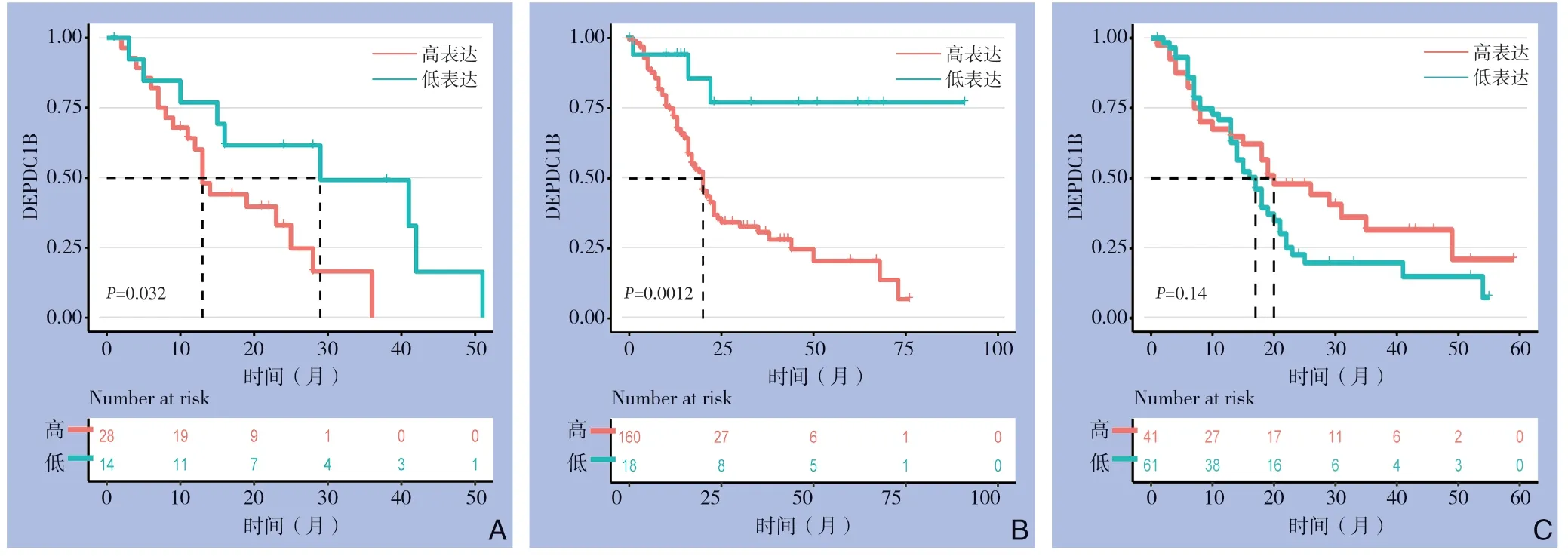
图2 DEPDC1B 表达与胰腺癌预后的关系 A:GSE28735;B:TCGA;C:GSE21501Figure 2 Relationship between DEPDC1B expression and prognosis of pancreatic cancer A: GSE28735; B: TCGA; C:GSE21501
2.1.3 胰腺癌患者预后影响因素Cox 单因素分析发现,在TCGA 数据集中,DEPDC1B 的表达水平、年龄与胰腺癌患者预后明显有关(均P<0.05),肿瘤分期、性别与胰腺癌患者总体生存率无明显关 系( 均P>0.05); 在GSE21501 数 据 集 中, N 分期与胰腺癌患者预后明显有关(均P<0.05),DEPDC1B 表达水平、肿瘤分期、性别与胰腺癌患者总体生存率无明显关系(均P>0.05)。多因素分析发现,在TCGA 数据集中,DEPDC1B 的表达水平、年龄与胰腺癌患者预后的独立影响因素(均P<0.05),肿瘤分期、性别与胰腺癌患者总体生存率无明显关系(均P>0.05)(表1)。

表1 3 个队列总生存率影响因素的单变量和多变量分析Table 1 Univariate and multivariate analysis of the influencing factors for overall survival rates in the 3 cohorts
2.2 临床标本分析结果
2.2.1 DEPDC1B 在胰腺癌及癌旁组织中的表达通过上述数据集的结果,收集我院97 例胰腺癌患者的临床样本及数据,通过免疫组化方法进一步验证上述结果,发现DEPDC1B 主要表达于胰腺癌细胞的胞浆,DEPDC1B 蛋白的阳性表达率为69.07%(67/97);而在癌旁组织中DEPDC1B 阳性表达率仅为11.34%(11/97),低于胰腺癌组织(χ2=62.058,P<0.001)(图3)。
2.2.2 DEPDC1B 表达与胰腺癌临床病理特征的关系在97 例胰腺癌患者中,DEPDC1B 表达与胰腺癌分化程度、临床分期、淋巴结转移相关(P=0.031、P<0.001、P<0.001),而与胰腺癌患者的年龄、性别、肿瘤大小、部位、神经浸润、血管侵犯及远处转移均无明显相关性(均P>0.05) (表2)。
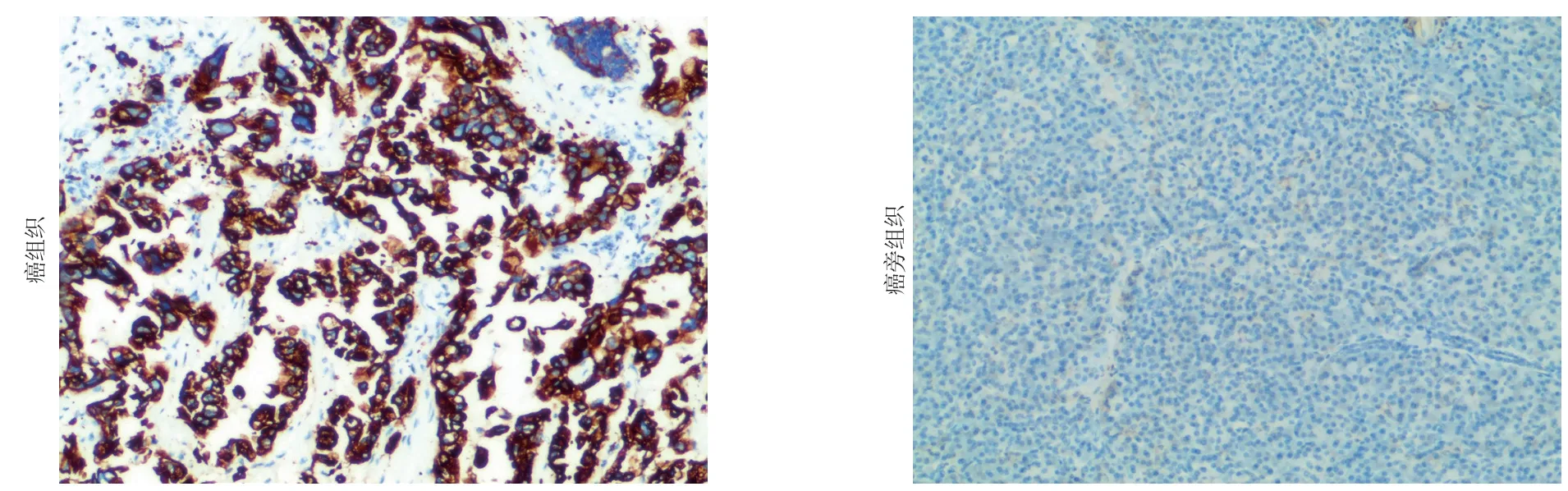
图3 免疫组化检测DEPDC1B 的表达(×100)Figure 3 Immunohistochemical staining for DEPDC1B expression (×100)

表2 DEPDC1B表达与胰腺癌患者临床特征的关系[n(%)]Table 2 Relations if DEPDC1B expression with the clinicopathologic features of pancreatic cancer patients [n (%)]
2.2.3 DEPDC1B 表达与胰腺癌患者预后的关系在97 例胰腺癌患者中,采用Kaplan-Meier 生存曲线发现DEPDC1B 表达与预后明显有关(P<0.001)(图4);Cox 单因素分析结果显示,胰腺癌组织中DEPDC1B 表达、临床分期、淋巴结转移均与胰腺癌预后有关(P=0.001、P=0.019、P=0.007),而患者年龄、性别、肿瘤大小、部位、分化程度及神经浸润与预后无关(均P>0.05)。Cox 多因素回归分析结果显示DEPDC1B 表达、淋巴结转移是影响胰腺癌患者预后的独立危险因素(HR=1.126,95%CI=1.012~1.253,P=0.029;HR=4.198,95%CI=1.105~15.954,P=0.035)(表3)。
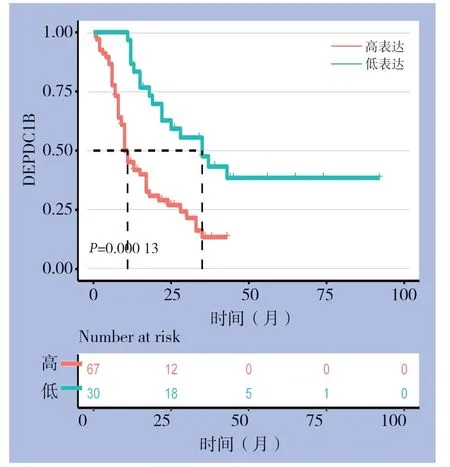
图4 97 例胰腺癌患者中不同DEPDC1B 表达水平患者的生存曲线Figure 4 Survival curves of cases with different DEPDC1B expression levels in the 97 pancreatic cancer patients

表3 97 例胰腺癌患者预后因素的Cox 回归模型分析Table 3 Cox regression model analysis of factors in the 97 pancreatic cancer patients
3 讨 论
DEPDC1B基因包含两个重要的结构域:DEP结构域和Rho-GAP结构域[20-21],DEP结构域在介导膜定位和调节广泛的细胞功能中起一定作用,例如确定细胞极性和测定视网膜感光细胞的高度特异度信号[22];DEP结构域还使蛋白质能够与G蛋白偶联受体和带负电荷的膜磷脂相互作用,并介导GPCR信号通路[23];而Rho-GAP结构域负责Rho-GAP酶信号转导[9]。DEPDC1B可以与多种信号分子相互作用,从剪接调节剂到跨膜蛋白,DEPDC1B的表达受到P53的正向调控,这是由于DEPDC1B在转录起始处与P63存在结合位点[24-25];此外,DEPDC1B是协调有丝分裂中死亡事件和细胞周期过程所必需的[26]。在口腔癌细胞系中,DEPDC1B通过Rac1-ERK1/2信号轴促进细胞的生长、侵袭,该过程主要由Rho-GAP结构域介导[11]。 在非小细胞肺癌细胞系中,DEPDC1B通过激活Wnt/β-catenin通路来促进肿瘤细胞的迁移和侵袭[12]。在膀胱癌细胞系中,DEPDC1B通过调控SHC1在膀胱癌中的发生发展从而起到肿瘤促进剂的作用[27]。在胶质母细胞瘤细胞系中,小干扰RNA(siRNA)抑制内源性DEPDC1表达抑制细胞活力并且诱导细胞凋亡[28]。DEPDC1B在非小细胞肺癌[12]、前列腺癌[29]中组织中高表达,且与病理分化程度相关。本研究显示,在TCGA、GSE16515、GSE15471、GSE28735数据集中,胰腺癌组织中的DEPDC1B表达量显著高于非肿瘤正常组织;而在97例胰腺癌患者组织中DEPDC1B的表达明显高于癌旁组织,与上述结果一致,并且在低分化组中表达要明显高于高分化组,表明了DEPDC1B与胰腺癌分化程度呈正相关,提示DEPDC1B的高表达可能与胰腺癌细胞的迁移和侵袭相关。
在恶性黑色素瘤中敲除DEPDC1B抑制了恶性黑色素瘤的细胞迁移和侵袭,而在恶性黑色素瘤组织中DEPDC1B的异位表达促进了肿瘤细胞的迁移和侵袭[30]。此外,在口腔癌中,DEPDC1B在培养的胚胎成纤维细胞系中诱导细胞迁移,并在口腔癌细胞系中诱导细胞侵袭[11]。胶质母细胞瘤细胞中DEPDC1B高表达可以促进上皮间质转化及增殖、侵袭[31]。笔者先前的细胞学实验发现干扰DEPDC1B表达后能抑制胰腺癌细胞株PANC-1和CFPAC-1的迁移和侵袭,过表达DEPDC1B反而起到促进作用[32]。DEPDC1B与胰腺癌临床样本的关系仍不明确,本研究发现DEPDC1B高表达与胰腺癌患者临床分期较晚(IIB~IV)、淋巴结转移相关。无论在TCGA、GSE28735数据集,还是我们97例胰腺癌样本中,DEPDC1B低表达组与高表达组相比,具有生存优势,总生存期相对延长。提示DEPDC1B可能参与胰腺癌进展,可以作为预测胰腺癌侵袭与转移的潜在指标,可能为寻找胰腺癌药物治疗靶点提供有用的信息。
本研究进一步分析来自TC G A 及GSE数据库的RNA-seq数据及临床信息,并使用Cox单因素及多因素分析,发现在TCGA数据库中,DEPDC1B表达与胰腺癌患者预后密切相关,是影响胰腺癌患者预后的独立危险因素;随后对97例胰腺癌患者进行Kaplan-Meier生存分析及单因素Cox分析发现,DEPDC1B阳性表达较阴性表达患者的生存时间缩短,预后相对较差。通过Cox多因素分析发现,DEPDC1B阳性表达可以作为判断胰腺癌患者预后的独立危险因素。与上述TCGA数据库中结果一致。
综上所述,胰腺癌组织中高表达的DEPDC1B可能参与胰腺癌的发生、发展及转移过程,与胰腺癌的恶性程度、淋巴结转移及预后不良有关,并可作为判断胰腺癌预后的重要指标。
