解纤维素热酸菌来源的耐热磷酸酶的酶学性质与应用
2021-04-14李运杰孟冬冬魏欣蕾路福平
白 雪,李运杰,孟冬冬,魏欣蕾,路福平,游 淳
(1. 天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457;2. 中国科学院 天津工业生物技术研究所,天津 300308)
含有磷酰基转移酶的卤代酸脱卤酶(HAD)家族是酶类中已知的最大超家族之一,包括Mg2+依赖的磷酸酯酶、P型ATP水解酶、磷酸酶、磷酸化葡萄糖异构酶等[1-3]。HAD磷酸酶的三维结构由α/β-水解酶核心结构域和覆盖于其上的帽子结构域构成,核心结构域在家族中都保持着严格的序列保守性和结构保守性,帽子结构域的N端部分具有高度可变性,在参与形成活性位点的空腔时,会影响底物特异性[4-7]。因此,磷酸酶具有广泛的底物谱。
HAD磷酸酶广泛存在于微生物中,参与维持细胞的初级代谢和次级代谢等生理调控功能。目前,有大量磷酸酶的催化活性已得到功能注释,例如:来自大肠杆菌(E.coli)中的3-脱氧-D-甘露糖醛酸8-磷酸磷酸酶(YrbI)[8]、海藻糖6-磷酸磷酸酶(OtsB)[9];来自詹氏甲烷球菌(Methanococcusjannaschii)的磷酸丝氨酸磷酸酶(SerB)[10];来自嗜酸热原体(Thermoplasmaacidophilum)的磷酸甘油酸磷酸酶[11];来自多形拟杆菌(Bacteroidesthetaiotaomicron)的无机焦磷酸酶[12]等。由于HAD磷酸酶所催化的脱磷反应是不可逆的,这些磷酸酶常常被作为催化反应的最后一步整合在体外多酶体系中,推动整个体系向着生成产物的方向进行,从而得到较高的产品得率。因此,在理论上,基于磷酸酶的体外多酶体系能够实现产物的高得率。例如:从大肠杆菌中获得的果糖-1-磷酸磷酸酶(YqaB)用于生产D-山梨糖和D-阿洛酮糖[13]或L-果糖和L-塔格糖[14]等稀有糖;来自海栖热袍菌(Thermotogamaritima)的嗜热肌醇单磷酸酶(IMP)被引入体外合成体系,实现了20 t规模的肌醇生产[15]。嗜热酶具有更高的鲁棒性,整个反应体系更稳定,不易染菌,因此应该选择热稳定性高的酶构建体外多酶体系。除此之外,高的反应温度能够降低反应液黏度、提高体系传质速度,从而提高整个反应体系的反应速度。鉴于多数磷酸酶具有底物多样性,寻找底物特异性高的磷酸酶,挖掘嗜热菌来源的耐热磷酸酶,将其用于生物制造平台,具有重要的研究意义。
本研究中,笔者从最适生长温度为55 ℃的解纤维素热酸菌(Acidothermuscellulolyticus)基因组中,通过基因组数据挖掘的方法检索到一个HAD超家族的磷酸酶基因,并将其命名为AcPase,将该磷酸酶基因在E.coliRosetta (DE3)中进行异源表达,并对其底物特异性等酶学性质进行表征;随后,将其整合入体外多酶体系中并对该体系降解纤维素生产葡萄糖的功能进行研究,以期为纤维素降解提供一条不依赖于纤维素酶的分解路线。
1 材料与方法
1.1 材料菌株与试剂
1.1.1 菌株与质粒
菌株EscherichiacoliRosetta (DE3)保藏于中国科学院天津工业生物技术研究所体外合成生物学中心。所用的磷酸酶基因AcPase由安徽通用生物系统有限公司合成并克隆至载体pET20b(+)。
1.1.2 试剂与培养基
氨苄霉素和氯霉素,生工生物工程(上海)有限公司;Sepharose His TrapHP,美国Bio-Rad公司;MOPS和Bradford蛋白浓度测定试剂盒,Sigma公司;葡萄糖氧化酶法测定试剂盒,北京普利莱基因技术有限公司。其他试剂均为市售国产分析纯。
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L;pH 7.0。
1.2 方法
1.2.1 重组菌E.coliRosetta (DE3)/pET20b(+)-AcPase的构建
根据蛋白的功能预测,从NCBI上查获GenBank序列号为ABK51875.1的磷酸酶基因序列。基因由安徽通用生物系统有限公司按照E.coli密码子的偏好性进行基因序列优化并合成,亚克隆于pET20b(+)载体中,选择酶切位点为NdeⅠ/XhoⅠ,C端带有6×His Tag标签,获得质粒pET20b(+)-AcPase。将重组质粒转化到E.coliRosetta(DE3)感受态中,选取氨苄青霉素和氯霉素双抗性平板上的阳性菌落。
1.2.2 重组蛋白的诱导表达
挑取重组菌单菌落,接种于含100 mg/L氨苄青霉素和33 mg/L氯霉素的LB培养基中,在37 ℃、250 r/min条件下振荡培养过夜。以体积分数1%的接种量转接于装有200 mL含100 mg/L氨苄青霉素和33 mg/L氯霉素的LB培养基中(1 L三角瓶),于37 ℃、250 r/min摇床中培养至OD600达到0.6~0.8时,降低培养温度至16 ℃,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),16 ℃、250 r/min诱导16~20 h表达蛋白。发酵结束后离心收集菌体,用0.9% NaCl溶液洗涤菌体2次,再用含有50 mmol/L NaCl的50 mmol/L 3-(N-吗啉基)丙磺酸(MOPS)缓冲液(pH 7.0)重悬菌体。在冰上超声破碎,菌体破碎液于4 ℃离心机中12 000 r/min离心10 min,得到重组酶的粗酶液。
1.2.3 重组蛋白的纯化
采用镍柱亲和层析法纯化附有组氨酸标签的重组蛋白,步骤如下:His Trap HP树脂柱用结合缓冲液A(50 mmol/L MOPS、50 mmol/L NaCl、20 mmol/L咪唑,pH 7.0)平衡;粗酶液流经树脂柱后,利用缓冲液A洗去杂蛋白;用洗脱缓冲液B(50 mmol/L MOPS、50 mmol/L NaCl、500 mmol/L 咪唑,pH 7.0)梯度洗脱目的蛋白。收集含有目的蛋白的流出液,经超滤离心管(104)浓缩并去除咪唑。通过SDS-PAGE检测目的蛋白的分子量和纯度。采用Bradford法测定蛋白浓度。
1.2.4 磷酸酶活力测定及酶的底物谱测定
在0.3 mL反应体系中,将60 μg的AcPase与含5 mmol/L MgCl2的0.1 mol/L MOPS缓冲液(pH 6.0)混合,50 ℃预热2 min,分别加入同样预热的终浓度10 mmol/L的D-葡萄糖-1-磷酸(G1P)、D-葡萄糖-6-磷酸(G6P)、果糖-6-磷酸(F6P)、果糖-1,6-二磷酸(FDP)、D-葡糖胺-6-磷酸(GlcN6P)、D-塔格糖-6-磷酸(T6P)、D-阿洛酮糖-6-磷酸(P6P)、D-甘露糖-6-磷酸(M6P)和1 mmol/L的对硝基苯磷酸二钠(pNPP)进行反应,冰浴终止反应。
采用无机磷酸测定法[16]检测生成的磷酸含量。酶活定义:在一定的条件下,每分钟转化产生1 μmol磷酸所需的酶量为一个酶活单位U。
以pNPP为底物时,添加终浓度0.75 mol/L的硼酸钠终止反应,产生的产物对硝基苯酚(pNP)通过405 nm下的吸光度进行测定。酶活定义:在一定的条件下,每分钟转化产生1 μmol pNP所需的酶量为一个酶活单位U。
1.3 重组酶的酶学性质分析
1.3.1 重组酶的最适反应温度及其稳定性
将重组酶与含10 mmol/L G6P、5 mmol/L MgCl2的0.1 mol/L MOPS缓冲液(pH 6.0)混合,分别置于不同温度(30、40、45、50、55、60、65、70、75、80和90 ℃)下反应10 min,测定酶活,确定最适反应温度。将3 g/L纯化后的酶分别放置在45、55和65 ℃条件下,热处理不同时间,取出热处理后的酶液,在50 ℃下测定各时间点的剩余酶活力,与初始酶活进行比较,考察酶在不同温度下的稳定性。
1.3.2 重组酶的最适pH
将重组酶分别与浓度均为0.1 mol/L的甘氨酸-盐酸缓冲液(pH 4.0、4.5和5.0)、乙酸-乙酸钠缓冲液(pH 5.0、5.5和6.0)、MOPS缓冲液(pH 6.0、6.5和7.0)和HEPES缓冲液(pH 7.0、7.5和8.0)混合,再加入终浓度10 mmol/L G6P和5 mmol/L MgCl2进行反应,在50 ℃下测定酶的最适pH。
1.3.3 不同金属离子对重组酶活性的影响
在酶与含10 mmol/L G6P、0.1 mol/L MOPS缓冲液(pH 6.0)的混合体系中,分别加入终浓度为5 mmol/L的MgCl2、CoCl2、MnCl2、NiCl2、ZnCl2、CuCl2、CaCl2和FeCl3溶液,未加任何离子反应体系的酶活定义为100%,测定金属离子对重组酶活性的影响。
1.3.4 重组酶动力学参数的测定
在50 ℃下,含5 mmol/L MgCl2的0.1 mol/L MOPS缓冲液(pH 6.0)中,分别添加不同浓度的底物G1P(0.5~50 mmol/L)、G6P(0.5~20 mmol/L)和F6P(0.5~20 mmol/L),以产物磷酸的变化量计算初始速率,采用GraphPad Prism 5.01软件的Michaelis-Menten方程,经非线性回归计算该重组酶的酶动力学参数(Km、Vmax和kcat)。
1.4 重组酶的应用
质粒pET21c-CtCDP、pET20b-CtCBP和pET20b-CtPGM分别用于表达重组蛋白纤维多糖磷酸化酶(CDP)、纤维二糖磷酸化酶(CBP)和磷酸葡萄糖变位酶(PGM),其编码蛋白基因cdp、cbp和pgm均来源于嗜热纤维梭菌(Clostridiumthermocellum)。酶活测定方法参照文献[17]。
利用体外多酶系统催化纤维素完全转化生成葡萄糖。1 mL反应体系包含经酸水解方法[17]预处理的5 g/L纤维多糖(25 mmol/L葡萄糖),5 mmol/L MgCl2、10 mmol/L K2HPO4-KH2PO4、1 U CDP、1 U CBP、1 U PGM、1 U AcPase(相对葡萄糖6-磷酸的比酶活)、0.1 mol/L MOPS缓冲液(pH 6.0),50 ℃、600 r/min反应5 h。本研究中所用纤维多糖的平均聚合度(degree of polymerization,DP)为2.9,DP值为纤维多糖中葡萄糖单元的摩尔数与还原端摩尔数的比值。采用葡萄糖氧化酶法测定试剂盒来测定产物葡萄糖的含量。
2 结果与讨论
2.1 重组酶的诱导表达与纯化
重组菌E.coliRosetta (DE3)/pET20b(+)-AcPase经IPTG诱导表达后,超声破碎后的全菌液和离心后的上清液经SDS-PAGE电泳验证,如图1所示。由图1可知,在分子量大约3.0×104处出现明显的特异性条带,而来源于A.cellulolyticus的重组酶是由287个氨基酸组成,与预期重组酶的理论分子量(3.01×104)大小一致,说明重组菌成功表达可溶性蛋白。上清液经镍柱纯化后获得了电泳纯目的蛋白,可用于进一步研究。
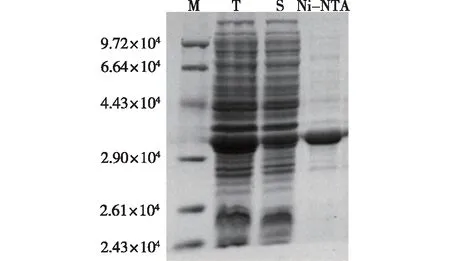
M—标准蛋白; T—total cell lysate; S—supernatant ofthe cell lysate; Ni-NTA—purified AcPase图1 SDS-PAGE分析重组菌E. coli Rosetta (DE3)表达和纯化的蛋白AcPaseFig.1 SDS-PAGE analysis of recombinant AcPase expressed and purified from E. coli Rosetta (DE3)
AcPase纯化结果如表1所示。由表1可知:300 mL重组菌经纯化后获得11 mg蛋白,在镍柱纯化过程中,蛋白存在一定损失,导致酶活性回收率为32.2%。

表1 来源于A. cellulolyticus的AcPase的纯化
2.2 重组酶的底物谱
磷酸酶或磷酸单酯酶(EC 3.1.3-)具有广泛的底物谱,可水解多种天然底物中的磷酸单酯键,包括小分子的核苷酸、糖和糖醇或蛋白质。本研究中AcPase对多种磷酸盐物质的底物特异性如表2所示。由表2可知,重组磷酸酶对G1P、G6P、F6P、FDP、GlcN6P、T6P、P6P、M6P和pNPP均显示磷酸酶活性。其中,在50 ℃下,AcPase对G6P的比酶活为0.685 U/mg,对G1P的比酶活为0.323 U/mg,对P6P、F6P的比酶活约为0.2 U/mg。由此可见,来源于A.cellulolyticus的AcPase属于糖酸化酶并且拥有广泛的底物谱。
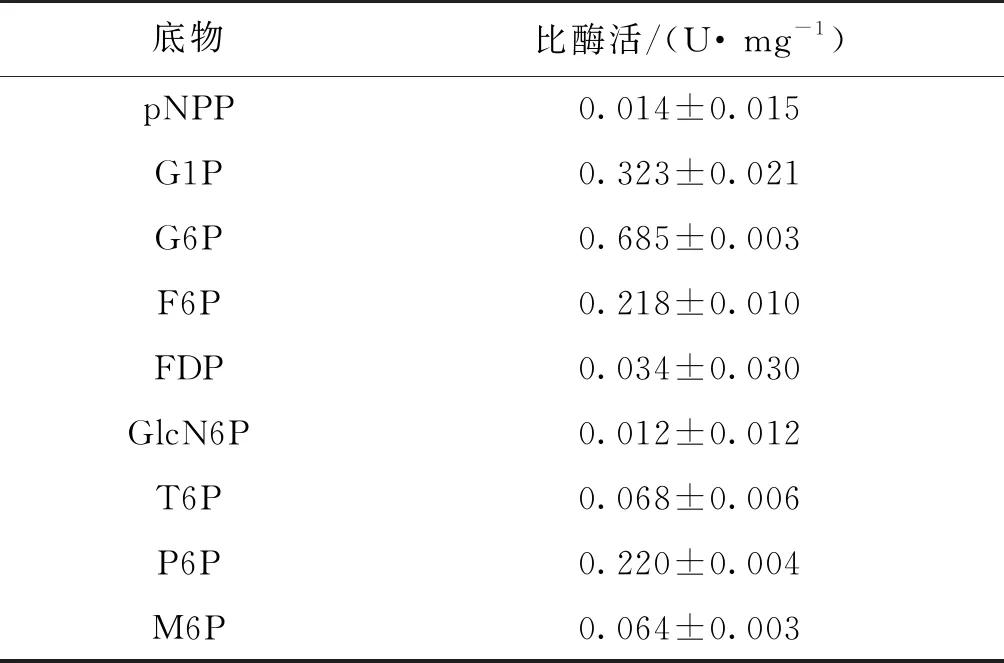
表2 AcPase的磷酸酶底物特异性
2.3 重组酶的酶学性质分析
2.3.1 重组酶的最适温度及其稳定性
解纤维素热酸菌(A.cellulolyticus)的最适生长温度为55 ℃,但是酶的最适催化温度与菌的生长温度不一定一致。因此,考察重组酶的最适温度及稳定性,结果见图2。由图2可知,AcPase最适催化温度为 65 ℃。温度从30 ℃升高到65 ℃时,该重组酶活性随温度逐渐升高;当达到80 ℃时,酶活性损失达63%。重组酶(3 g/L)在45、55和65 ℃的半衰期分别为17.4、6.3和2.7 h,而且随着温度升高和处理时间的延长,该酶活衰减较快。由此可知,虽然重组酶的最适催化温度为65 ℃,但在此温度下,酶的热稳定性较差。
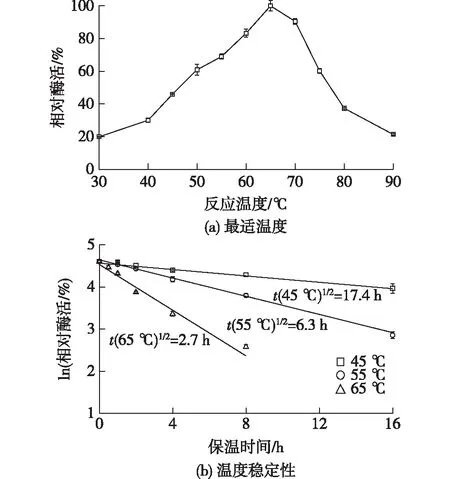
图2 AcPase的最适温度和温度稳定性Fig.2 Optimal temperature and thermostability of AcPase
2.3.2 重组酶的最适pH
在pH为4.0~8.0时测定AcPase的最适pH,结果如图3所示。由图3可知:该重组酶在酸性环境下具有较大的催化活性,其最适pH为6.0;当pH大于7.0时,酶活力迅速降低。同时该酶对不同缓冲液具有选择性:在pH 6.0下,MOPS缓冲液中的酶活力是乙酸-乙酸钠缓冲液中的1.8倍;在pH 7.0下,MOPS缓冲液中的酶活力是HEPES缓冲液的1.1倍。由此可见,该重组磷酸酶在pH 6.0的MOPS缓冲液中酶活最高。
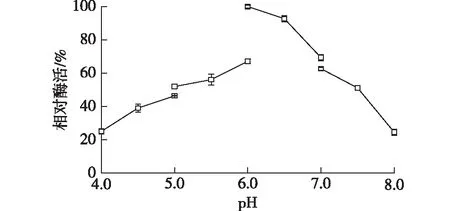
图3 pH对AcPase酶活力的影响Fig.3 Effects of pH on the specific activity of AcPase
2.3.3 不同金属离子对重组酶活性的影响
金属离子会对HAD家族水解酶蛋白结构域环4(loop 4)上的羧酸残基及环4位置在调节酶活性方面产生影响[18],且多数磷酸酶需要金属离子的激活作用,其中,Mg2+、Mn2+对酶活性的影响最为显著。因此,考察重组磷酸酶对各种金属离子的依赖性,结果如图4所示。
由图4可知:在5 mmol/L Mg2+的环境中,AcPase展现出最高酶活性,是未加任何离子反应体系的21倍;Co2+、Mn2+、Ni2+可分别提高酶活性11、5.3和4.7倍;Zn2+对该酶活性无明显的影响。然而,Cu2+、Fe3+和Ca2+具有抑制酶活性的作用,残余酶活力分别保持在62%、40%和30%,其中Fe3+和Ca2+严重影响酶活性且会造成酶发生沉淀。

图4 金属离子对AcPase酶活力的影响Fig.4 Effects of metal ions on the specific activity of AcPase
2.3.4 重组酶的动力学分析
针对酶活性较高的3种磷酸糖进行动力学参数的测定,结果如表3所示。由表3可知,该重组酶以G6P、G1P和F6P为底物时的米氏常数(Km)分别为8.9、17.57和7.47 mmol/L。因此,相对于G1P,AcPase对G6P和F6P展现出较高的底物亲和力。该重组酶对底物的转换数(kcat)分析显示,AcPase对G6P的Kcat值为1.65 s-1,分别是G1P和F6P的1.96倍和2.95倍。尽管AcPase对G6P的底物亲和力稍低于F6P,但是该酶对G6P的高转换常数导致AcPase对G6P具有最高的催化效率(kcat/Km)。AcPase对G6P的底物催化能力分别是对F6P和G1P的2.5和4倍,这与该酶的比酶活测定结果相一致。因此,AcPase是一个广泛底物特异性的磷酸酶,同时表现出良好的葡萄糖-6-磷酸酶活性。

表3 AcPase的动力学参数
2.4 重组酶的应用
纤维素是地球上最丰富的可再生资源,被认为是生产生物燃料和生物基化学品的重要原料。目前,纤维素的利用研究通常通过多酶(内切纤维素酶、外切纤维素酶、纤维二糖水解酶)协同水解生成葡萄糖,进而经微生物发酵生产生物基化学品[19]。然而,外切纤维素酶和纤维二糖水解酶通常会受到产物的严重抑制,因此,传统的纤维素水解方法很难将纤维素完全转化为葡萄糖。根据对AcPase的酶学性质分析,该酶可被引入体外多酶系统,通过底物磷酸化、中间产物异构化、脱磷酸反应,从而避开产物抑制。
因此,笔者构建了从经预处理后的纤维素转化葡萄糖的体外多酶催化系统,如图5所示,该途径包括4个酶催化的连续反应步骤:①在磷的存在下,多糖磷酸化酶(CDP)使纤维多糖磷酸化,生成纤维二糖和葡萄糖-1-磷酸;②在磷的存在下,纤维二糖磷酸化酶(CBP)磷解纤维二糖,生成葡萄糖(Glc)和葡萄糖-1-磷酸;③在磷酸葡萄糖变位酶(PGM)催化下,葡萄糖-1-磷酸转化为葡萄糖-6-磷酸;④通过磷酸酶(AcPase)将葡萄糖-6-磷酸去磷酸化为葡萄糖,生成的磷供应反应①②,从而使得整个系统磷平衡。
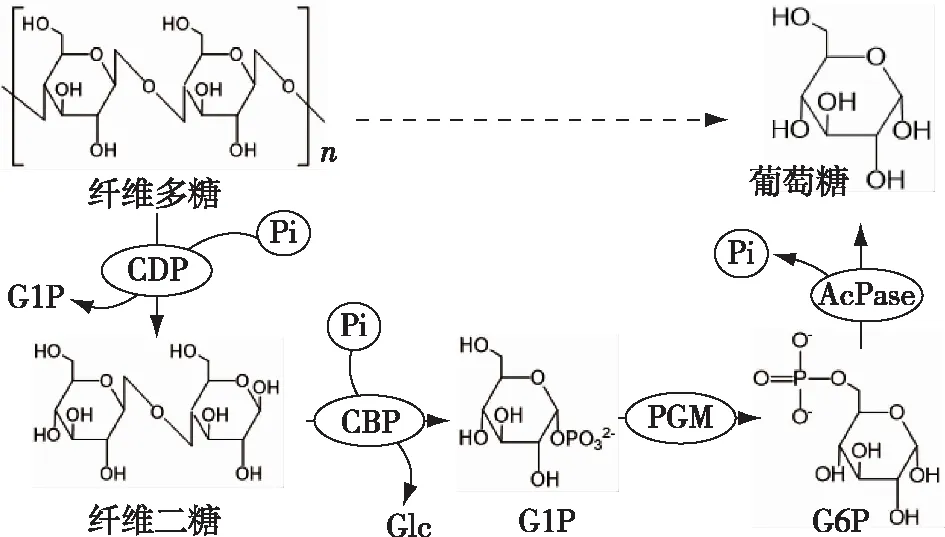
图5 纤维多糖转化葡萄糖的途径Fig.5 Scheme of pathway for the conversion of cellodextrins to glucose
在纤维素生物转化葡萄糖反应中,选用的CDP、CBP、PGM和AcPase,在50 ℃、0.1 mol/L MOPS缓冲液(pH 6.0)条件下,测定的比酶活分别为0.66、30、50和0.68 U/mg。
利用AcPase转化5 g/L纤维多糖进行葡萄糖的生物合成,结果如图6所示。由图6可知:反应的前1 h,产物的生成速率最快,但随着底物的消耗,产率的增长逐渐变缓慢;反应5 h后,预处理的5 g/L纤维多糖(DP=2.9,25 mmol/L葡萄糖)成功转化为24.4 mmol/L葡萄糖,产率达到97.6%。因此,该热稳定性的AcPase实现了纤维素到葡萄糖的完全转化,为将来工业上纤维素的利用提供了坚实的研究基础。
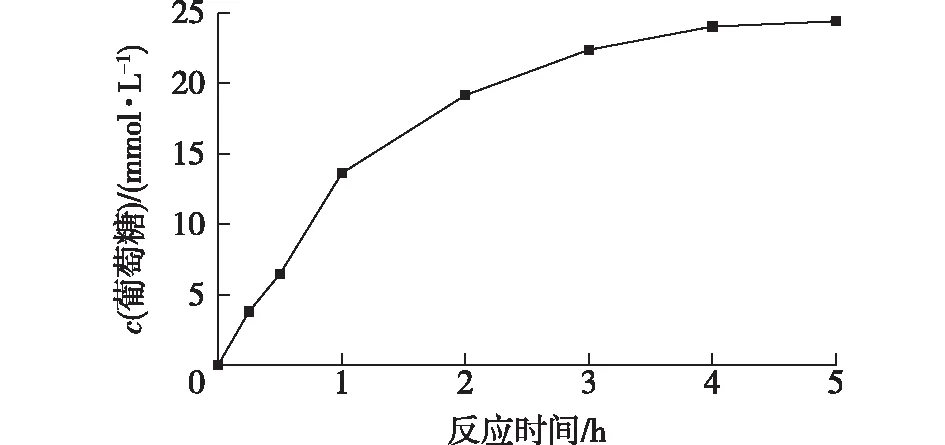
图6 使用5 g/L纤维多糖进行葡萄糖的生物合成Fig.6 Biosynthesis of glucose from 5 g/L cellodextrins
3 结论
以解纤维素热酸菌(Acidothermuscellulolyticus)基因组中HAD超家族的磷酸酶基因为基础,通过E.coli密码子偏爱性优化后得到新的磷酸酶基因AcPase,并成功在E.coliRosetta (DE3)中进行异源表达,经过His Trap HP树脂柱纯化获得纯酶。AcPase属于Mg2+依赖型的HAD磷酸酶并具有广泛的底物谱。经酶学性质分析,以D-葡萄糖-6-磷酸为底物时,在45~65 ℃、pH 6.0~7.0的MOPS缓冲液中表现出相对高的酶活力和热稳定性。在“一锅法”将纤维素生物转化为葡萄糖的研究中,实现葡萄糖产率达到97.6%,与传统纤维素利用纤维素酶进行水解方式相比,该研究为纤维素完全转化提供了新的研究思路。
