鸟苷酸环化酶C在重症急性胰腺炎大鼠相关性肠损伤中的变化
2021-04-14黄启林原小惠孙红玉汤礼军
王 冰,黄启林,李 帅,吴 俊,原小惠,孙红玉,汤礼军
1西南交通大学医学院,四川 成都610063;2西部战区总医院全军普通外科中心//四川省胰腺损伤与修复重点实验室,四川 成都610083
重症急性胰腺炎(SAP)是一种具有较高致死性的炎性疾病,亢进的炎症反应常导致机体全身炎症反应综合征(SIRS)与多器官功能障碍综合征(MODS)[1],包括SAP相关性肠损伤[2]、肺损伤[3]、肾损伤[4]以及心血管系统损伤[5]等。肠道由于靠近胰腺,容易受到炎症影响且与疾病的进展密切相关[6]。在SAP早期即出现肠道损伤,导致肠道内细菌和毒性物质进入血液循环引起肠源性感染,进而加重患者病情且增加病死率[7],使SAP的治疗变得复杂。目前国内外相对公认的是采取分阶段、多学科、升阶梯的策略[8-9],而针对SAP相关性肠损伤的治疗局限于肠内、肠外营养[10],积极预防SAP相关性肠损伤的发生或减轻其程度是SAP治疗中的重要环节。因此,探讨SAP相关性肠损伤的发病机制对于开发改善肠道损伤的治疗新策略具有重要意义。
鸟苷酸环化酶C(GC-C)是位于肠道上皮细胞胞膜上的跨膜受体,受内源性配体激活后引起细胞内环磷酸鸟苷(cGMP)升高进而发挥生物学效应[11]。GC-C因在调节水电解质平衡[12-13]、维持肠屏障完整性[14]、控制炎症反应[15]、缓解腹痛[16]及调节肠道微生态[17]等方面具有重要作用,近来被视为肠道疾病的新型治疗靶点[18]。研究表明[19-20],GC-C可通过调控肠上皮紧密连接蛋白(TJP)的表达来维持肠屏障功能的稳定,还可通过影响NF-ĸB信号通路来缓解机体炎症反应[22],而严重的肠损伤和持续的炎症反应都是加速SAP进展的重要因素。目前,对于GC-C在SAP相关性肠损伤中的变化规律及作用尚不清楚,缺乏相关研究。基于此,我们旨在观察GC-C在SAP相关性肠损伤中的作用,并探究GC-C与SAP相关性肠损伤严重程度之间的关系,希望以此能为开发SAP治疗新靶点提供理论基础。
1 材料和方法
1.1 实验动物和主要实验试剂
8周龄雄性SPF级SD大鼠(200~220 g)54只分批购自成都达硕实验动物有限公司。牛磺胆酸钠(Sigma)。大鼠血清淀粉酶、二胺氧化酶、D-乳酸酶联免疫吸附测定试剂盒(建成生物),肿瘤坏死因子α ELISA试剂盒(华美生物)。全蛋白提取试剂盒(强)(索莱宝)。Trizol试剂(Invitrogen)。BCA蛋白定量试剂盒(博士德)。抗GC-C(ab225864)单克隆抗体、抗紧密连接蛋白Claudin-1抗体(ab15098)(Abcam)。GC-C激动剂利那洛肽(Linaclotide)(MedChem Express)。GC-C与GAPDH引物由成都高新区博瑞生物试剂耗材商贸部合成。吸入性麻醉剂异氟烷(瑞沃德)。
1.2 动物分组及模型制备
1.2.1 SAP建模 将36只SD大鼠于IVC笼具中适应性喂养1周,给予12 h昼夜交替光照,术前禁食12 h,可自由饮水,采用随机数字表法分为假手术组(SO组)和重症急性胰腺炎组(SAP组),每组18只。所有大鼠实验操作均采用异氟烷进行吸入性麻醉。SO组大鼠麻醉后,开腹仅翻动胰腺数次后关腹。SAP组大鼠麻醉后,开腹沿十二指肠寻找胰胆管开口处,经胰胆管逆行注射5%牛磺胆酸钠(0.1 mL/100 g)诱导SAP。所有实验过程均符合单位和国家有关实验动物管理和使用的规定。
1.2.2 GC-C变化规律及干预时间节点选取 将上述实验大鼠再次按照随机数字表法分为12 h组,24 h组和48 h组,每组6只,于建模后12、24、48 h分批处死,收集胰腺与升结肠组织。经免疫蛋白印迹实验、免疫组织化学实验和RT-PCR实验明确GC-C在SAP相关性肠损伤中的变化规律,将GC-C在SAP相关性肠损伤中表达最低的时间点作为肠损伤最严重的大概时间点,即干预的时间节点。
1.2.3 干预实验分组 将18只SD大鼠于IVC笼具中适应性喂养1周,给予12 h昼夜交替光照,术前禁食12 h,可自由饮水,采用随机数字表法分为SO组、SAP组和Linaclotide组,每组6只。SAP组和SO组建模方法同前。Linaclotide组大鼠麻醉后,首先通过胰胆管逆行注射5%牛磺胆酸钠(0.1 mL/100 g)诱导SAP,还原肠管逐层关腹,待大鼠苏醒后立即灌胃GC-C激动剂利那洛肽(Linaclotide)水溶液(10 μg/kg/d)1次进行干预,于GCC在SAP相关性肠损伤中表达最低的时间点进行标本收集。
1.3 标本采集
于建模后12、24、48 h分批采用异氟烷麻醉SD大鼠,开腹后经腹主动脉采血,收集胰腺与升结肠组织。动脉血静置30min后离心(3500 r/min,5 min),收集上清液置于-80 ℃冰箱中冻存用于后续生化检测。取胰腺与升结肠组织两份置于冻存管中储存在-80 ℃冰箱用于组织mRNA和蛋白质提取,一份固定于4%中性甲醛中用于病理学检测,再一份结肠组织置于电镜固定液用于后续电镜检测。
1.4 组织学评估
胰腺与结肠组织固定后依次行脱水、石蜡包埋、切片、脱蜡,最后行苏木素-伊红染色,封片后置于配备有数码照相系统的Leica DM300光学显微镜下观察。由病理医师在不知道实验分组的情况下依据Chiu等[23]报道标准对结肠病理进行评分,依据Schmidt等[24]报道标准对胰腺病理进行评分,每张切片随机选取10个视野,取其平均分作为每张切片的最后评分。透射电镜检测,将肠道组织置于3%戊二醛预固定,经丙酮脱水后进行渗透、包埋、切片、染色,采用H-600IV型透射电镜进行观察。
1.5 酶联免疫吸附测定(ELISA)
采用ELISA法测定血清中AMY、DAO、D-Lac与TNF-α的浓度,具体操作步骤严格按照说明书进行。
1.6 免疫蛋白印迹
采用全蛋白提取试剂盒提取大鼠升结肠组织中蛋白质,并用BCA蛋白定量试剂盒测定蛋白浓度。在小型凝胶电泳仪(Mini-Protein II,Bio-Rad,Hercules,CA,USA)上通过SDS-PAGE体系分离蛋白质,经转膜、封闭后与GC-C(1∶500)单克隆抗体、Claudin-1(1∶1000)反应,于4 ℃环境下孵育过夜。次日用TBST洗涤后与二抗(1∶10000)反应1h,采用BioSpectrum4 发光仪进行曝光,以GAPDH为内参,使用UVP图像采集和分析软件分析蛋白印迹灰度值。
1.7 免疫组织化学
采用免疫组织化学方法检测升结肠组织中GC-C、Claudin-1的表达。根据标准步骤对包埋的结肠组织进行切片、脱蜡、抗原修复与封闭,然后滴加兔抗大鼠GCC(1∶500)、Claudin-1(1∶500)抗体在4 ℃下孵育过夜。次日用PBS液冲洗后滴加生物素标记的山羊抗兔免疫球蛋白G,在37 ℃下孵育30min。复染封片后,在Leica DM300光学显微镜下观察阳性染色的细胞并捕获图像,用Image-Pro Plus软件测定累计光密度值(A)。
1.8 RT-PCR检测
采用Trizol法提取结肠组织总mRNA,使用Nano-Drop ND-1000 仪(Thermo Fisher Scientific,Waltham,MA,USA)测定每个样品的mRNA浓度,以A260/A280值作为mRNA纯度指标,获得mRNA的浓度在1.8~2.0。RNA 逆转录和PCR 扩增使用一步法SYBR Prime-Script TM RT-PCR 试剂盒II(Takara)通过C1000 TM Thermal Cycler(Bio-Rad)仪器进行检测。PCR条件如下:在95 ℃下持续10 min,随后在95 ℃持续10 s、60 ℃持续60 s的条件下进行40个PCR循环。数据采用2-△△CT法进行分析。引物序列见表1。

表1 RT-PCR引物序列Tab.1 Primer sequences for RT-PCR
1.9 统计学方法
采用GraphPad prism7.0(GraphPad,CA,USA)和SPSS 22.0软件包(SPSS,IL,USA)进行统计分析。所有数据均以均数±标准差显示。各组间同一指标比较采用单因素ANOVA 方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 胰腺组织病理学改变
胰腺组织HE染色结果显示,SO组大鼠胰腺腺泡结构规则,未见明显异常(图1A);SAP组大鼠胰腺表现为小叶间隔的局灶性扩张、胰腺小叶水肿、腺泡细胞大片状坏死和炎性细胞大量浸润(图1B),胰腺组织病理学评分与SO组相比显著升高(P<0.05,图1C)。同时,相比SO组,SAP组大鼠血清中淀粉酶浓度显著升高,差异具有统计学意义(P<0.05,图1D)。
2.2 结肠组织中GC-C mRNA表达情况
大鼠结肠组织中GC-C mRNA在SO组表达最高,在SAP-12 h组表达最低(P<0.05,图2)。与SO组相比,GC-C mRNA在SAP-12 h组、SAP-24 h组和SAP-48 h组中表达降低(P<0.05)。与SAP-12 h组相比,SAP-24 h组和SAP-482 h组结肠组织中GC-C mRNA表达水平升高,差异具有统计学意义(P<0.05)。
2.3 结肠组织中GC-C、Claudin-1的表达情况
GC-C主要表达于肠上皮细胞胞膜上,免疫组化染色结果显示,SAP-12 h组中GC-C阳性表达明显低于SO组、SAP-24 h组和SAP-48 h组(图3A、C);免疫蛋白印迹法进一步证实,SAP-12 h组结肠组织中GC-C表达最低(P<0.05,3D、E)。Claudin-1为位于肠上皮细胞外侧膜上的带状结构,免疫组化染色结果显示SAP-12 h组中Claudin-1阳性表达低于其余组,差异具有统计学意义(P<0.05,图3B、C)。
2.4 结肠组织病理学改变
结肠组织HE染色结果显示,SO组大鼠肠道粘膜连续,间质未见明显炎性细胞浸润;SAP-12 h组大鼠肠道粘膜表现为不同程度的断裂、缺损,间质水肿并伴有炎性细胞浸润,黏膜肌层形态欠规整,组织病理学评分相比SO组显著升高(P<0.05);Linaclotide组结肠粘膜缺损、间质炎性细胞浸润程度均较SAP-12 h组好转,病理学评分降低(P<0.05,图4A、B)。相比SO组,SAP-12 h组血清中TNF-α、DAO、D-Lac浓度显著升高,差异具有统计学意义(P<0.05),而Linaclotide组血清中上述各分子表达水平均低于SAP-12 h组(P<0.05,图4C~E)。
2.5 Linaclotide组结肠组织中GC-C、Claudin-1的表达情况
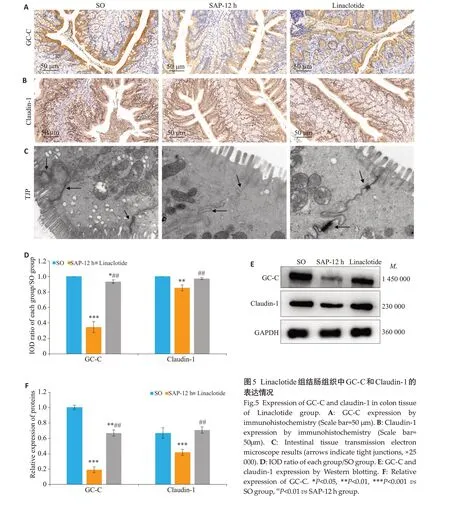
各组建模成功后12 h收集结肠组织,免疫组化染色结果显示,Linaclotide组中GC-C、Claudin-1阳性表达高于SAP-12 h组(P<0.05,图5A、B、D);免疫蛋白印迹法结果进一步证实,在建模后12 h SAP组结肠组织中GC-C、Claudin-1 表达低于SO 组和Linaclotide 组,而Linaclotide组中GC-C、Claudin-1表达较SAP-12 h组升高(P<0.05,图5E、F)。肠道透射电镜结果显示,SO组肠道上皮细胞结构完整,细胞间隙可见正常连续的细胞间紧密连接,细胞器结构清晰正常;SAP-12 h组可见细胞间紧密连接严重缺失,线粒体肿胀;Linaclotide组可见少数紧密连接存在(图5C)。

图1 各组大鼠胰腺组织病理学检查及血清淀粉酶活性Fig.1 Pathological examination of rat pancreatic tissue and serum amylase activity in each group.A:HE staining of pancreatic tissue in SO group(Scale bar=100 μm).B:HE staining of pancreatic tissue in SAP group (Scale bar=100 μm). C: Histological score of pancreatic tissue. D: Serum Amylase activity.***P<0.001 vs SO group.
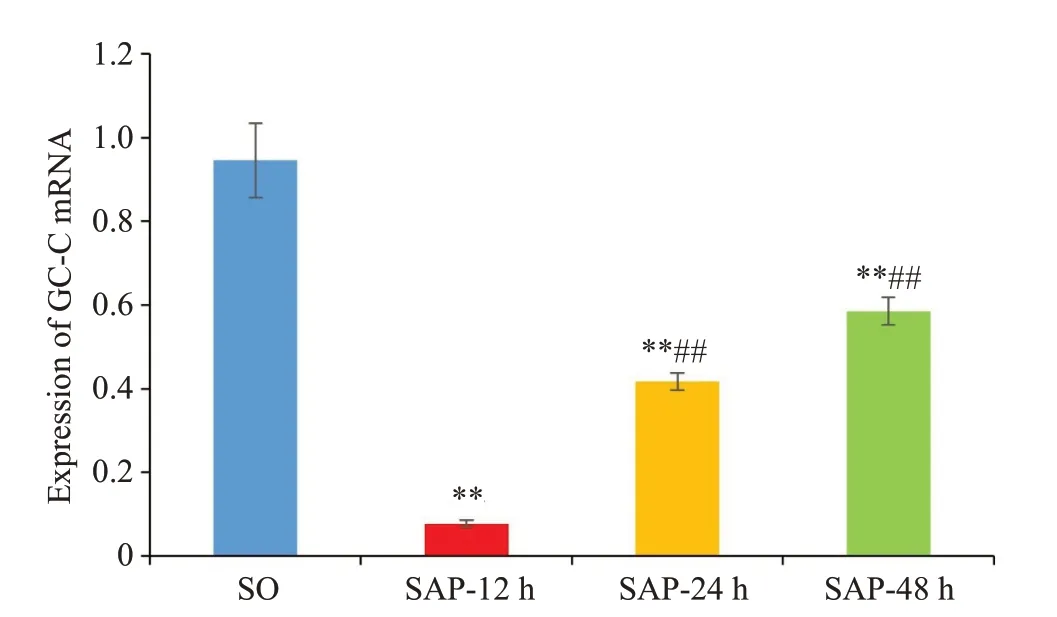
图2 大鼠结肠组织中GC-C mRNA的表达情况Fig.2 GC-C mRNA expression in rat colon tissue.**P<0.01 vs SO group,##P<0.01 vs SAP-12 h group.
3 讨论
SAP在世界范围内都是一种高发病率、高入院率和高死亡率的消化系统疾病,器官衰竭是疾病严重程度的主要决定因素,也是患者早期死亡的主要原因[25]。而肠道损伤被认为是MODS的始发事件[26]。SAP早期的炎症级联反应、微循环障碍以及缺血再灌注都会对肠屏障造成损伤[27-29]。此外,一项研究表明[30],静脉输注肠缺血大鼠的肠系膜淋巴液会加重胰腺炎严重程度,突出肠道在SAP发病机理中的重要作用,针对SAP相关性肠损伤的研究可能为探究SAP潜在治疗新靶点提供理论支撑。
在本研究中,我们采用5%牛磺胆酸钠经胰胆管逆行注射诱发SAP,该造模方法已得到广泛认可。相比SO组,SAP组各时间点血清中促炎因子和淀粉酶浓度均显著升高;此外,胰腺组织表现出更加明显的组织水肿、腺泡细胞坏死和炎性细胞浸润,表明SAP大鼠模型诱导成功。同时,与SO组相比,SAP组结肠组织表现为粘膜不同程度断裂缺失、间质水肿、炎性细胞浸润,肠道病理损伤评分与血清DAO、D-Lac浓度显著升高,提示SAP伴有明显肠道损伤。
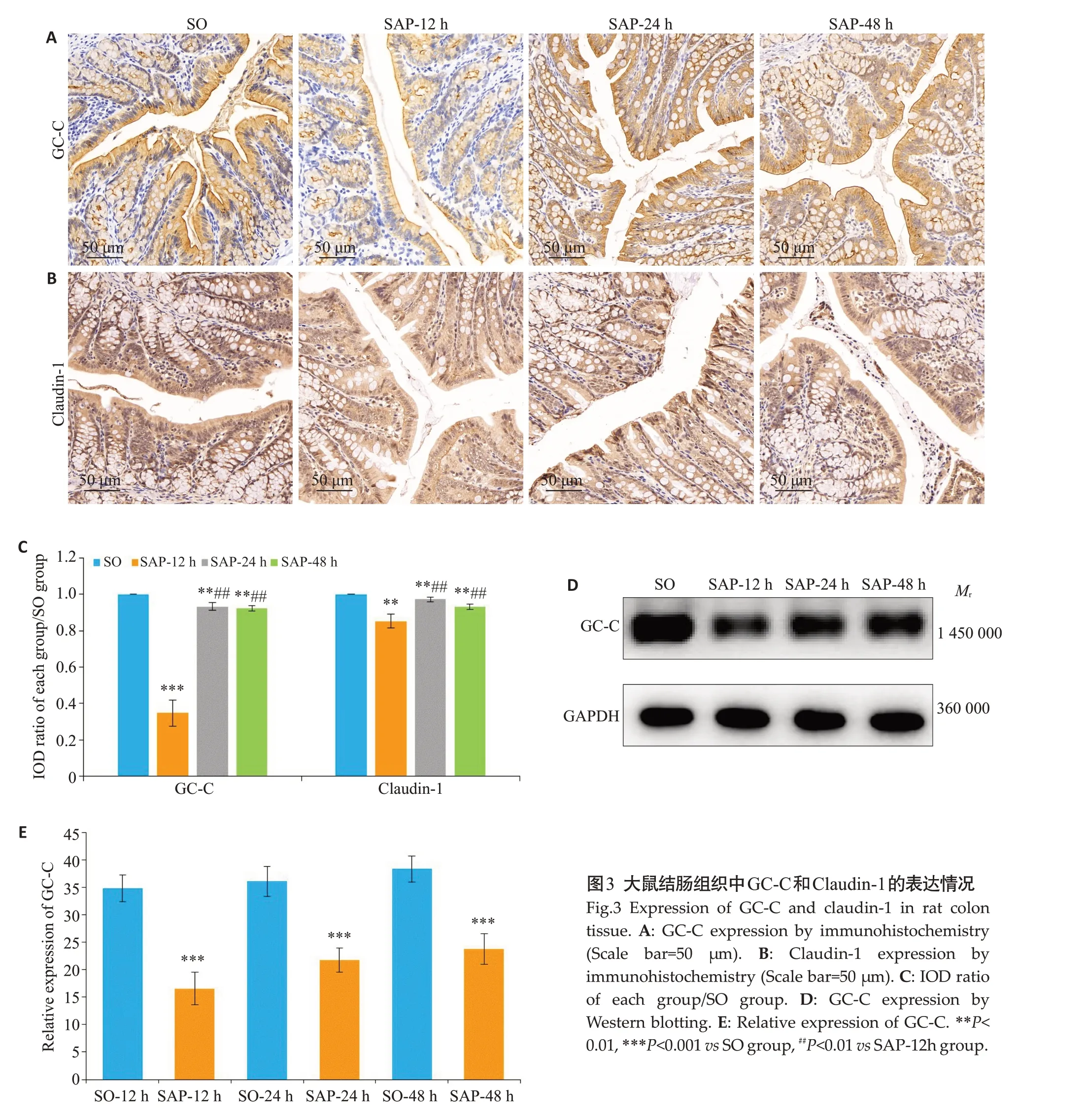
SAP相关性肠损伤主要表现为肠屏障功能的破坏以及炎性反应的激活。肠屏障由肠道上皮细胞、细胞间紧密连接、菌膜、肠上皮黏液层以及肠道相关淋巴组织构成[31]。其中,细胞间紧密连接对肠屏障功能影响最大,为位于肠道上皮细胞外膜顶端的狭长带状结构,可以紧密封闭细胞间隙。完整的肠屏障可有效阻隔肠道中微生物和内毒素进入血液循环避免引起肠源性感染。研究表明[32],GC-C可通过影响肠上皮细胞TJP的表达来维持肠屏障功能的完整。在GC-C敲低小鼠中,发现肠道上皮细胞通透性增高是由于GC-C信号的丢失导致肠上皮中肌球蛋白轻链激酶过度磷酸化,进而破坏肠道组织中紧密连接蛋白的组装,从而减少Claudin-2和黏附分子A的表达水平[21]。Lin等[33]通过体内与体外实验证实,GC-C调节肠道粘膜完整性与Claudin-2和Claudin-4的表达增加密切相关。在本研究中,我们通过免疫蛋白印迹、免疫组织化学及RT-PCR明确GC-C在SAP相关性肠损伤中的变化规律。实验结果表明,GC-C在SAP-12 h组中表达显著低于SO组、SAP-24 h组和SAP-48 h组,在SAP-24 h组中的表达低于SAP-48 h组,呈现出先下降后逐渐恢复的趋势。肠道免疫组织化学结果同样证实了该趋势。提示GC-C与SAP相关性肠损伤的严重程度具有相关性,GC-C于建模后12 h表达最低,是肠损伤最严重的大概时间点。此外,我们发现与SO组相比,Claudin-1在SAP-12 h组中阳性表达低于其余组,但SAP-24 h组和SAP-48 h组组间差异不明显。更重要的是,我们发现GC-C与Claudin-1具有相似的变化趋势。因此,通过给予SAP大鼠灌胃GC-C激动剂Linaclotide来干预,并选择在建模后12 h收集组织标本进行检测,实验结果表明,Linaclotide 组结肠组织中GC-C和Claudin-1的表达较SAP组升高,表明激活GC-C可能通过调节Claudin-1的表达来影响肠屏障的功能完整性。有研究发现GC-C维持肠上皮稳态是通过与受体结合后升高胞内cGMP进而抑制AKT磷酸化来实现[34],也有研究表明胞内升高的cGMP可通过影响PKG II的活性,进一步调节TJP的表达来影响肠屏障完整性[18]。那么在SAP相关性肠损伤中GC-C是如何影响Claudin-1的表达来维持肠屏障的完整还需要我们进一步证实。以上研究表明GC-C在维持肠屏障功能完整性上具有重要作用,并有望成为由于肠道高通透性致病的治疗靶点。

图4 各组大鼠结肠组织病理学检查及血清DAO、D-Lac、TNF-α活性Fig.4 Pathological examination of rat colon tissue and serum DAO,D-Lac,and TNF-α activity in each group.A: HE staining of colon tissue in each group (Scale bar=100 μm). B: Histological score of colon tissue. C: Serum content of TNF-α in each group. D: Serum content of DAO in each group. E: Serum content of D-Lac in each group.**P<0.01,***P<0.001 vs SO group,##P<0.01 vs SAP-12 h group.
SAP相关性肠损伤的另一表现是炎症反应的激活。近年来,一些研究表明GC-C/cGMP信号传导通路还与机体炎症调节有关。在炎症早期阶段,GC-C的缺失会加速炎症性肠病(IBD)的病情进展[35]。在炎性反应中,绝大多数会引起机体活化B细胞核因子κ轻链增强子(NF-ĸB)系统的激活[36]。相反,抑制NF-ĸB系统就能抑制微生物产物、炎性因子和许多趋化因子对炎性细胞的诱导,而GC-C/cGMP信号传导通路可以负性调控炎性因子的表达。据报道,人IBD样本的全基因分析显示,GC-C在活动性IBD中均显著下调,且与炎性因子IL-1a、IL-1b、TNF-α、IFN-γ的增加呈负相关[37]。Freihat等[38]研究白细胞介素-1受体相关激酶3(IRAK3)假激酶结构域中GC-C中心的作用,结果显示野生型IRAK3能产生cGMP,而GC-C中心定点突变则减少了cGMP的产生,对未转染的对照细胞进行细胞渗透性cGMP处理后发现cGMP可通过下调NF-ĸB信号来抑制炎性反应,表明GC-C/cGMP的存在可以影响炎症级联反应下游信号通路。在本研究中,与SO组相比,SAP组血清中DAO、D-Lac、TNF-α浓度显著升高,而Linaclotide组血清中上述因子水平较SAP组均下降,表明激活GC-C可负性调控炎症反应,可能与肠屏障的恢复有关,也可能直接对炎症反应产生影响,但其具体调控机制还需进一步深入研究。
综上所述,本研究分析了GC-C在SAP相关性肠损伤中的变化规律及作用,为后续探索以GC-C为治疗靶点开发SAP治疗新策略提供了新的观点和思路。
利益冲突:文章的全部作者声明,在课题研究和文章撰写过程不存在利益冲突。
机构伦理问题:实验过程遵循了国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》和本地及国家法规。实验动物在麻醉下进行所有的手术,并尽一切努力最大限度地减少其疼痛、痛苦和死亡。