血清磷脂酶A2受体抗体预测利妥昔单抗治疗特发性膜性肾病疗效价值的初探
2021-04-14张雪琴姜鸿杨淑芬赵红娟陆晨
张雪琴 姜鸿 杨淑芬 赵红娟 陆晨
新疆维吾尔自治区人民医院肾病科,乌鲁木齐 830001
特发性膜性肾病(idiopathic membranous nephropathy,IMN)所致的肾病综合征,是导致终末期肾病的主因之一[1],年发病率约为十万分之一,并有逐年上升的趋势[2]。IMN的临床特点复杂多变,预后不一,其中约20%~25%的IMN患者可自发缓解,而大约40%的患者在10年后发展为终末期肾病[3]。2009年首次对磷脂酶A2受体抗体(anti-phospholipaseA2 receptor antibody,PLA2R-Ab)做了报道后[4],膜性肾病的研究有了突破性进展。随后大量研究发现PLA2R-Ab能够预测IMN患者的疗效及预后[5],B细胞功能障碍在膜性肾病发病中占据重要的地位,利妥昔单抗能够高选择性耗竭B细胞,作为治疗IMN的新型药物逐渐进入历史舞台,成为学者们关注的热点[6]。本研究就基线PLA2R-Ab水平对利妥昔单抗治疗IMN效果的预测价值展开了研究。
资料与方法
一、研究对象
1.纳入标准 (1)2017年8月1日至2020年5月31日在新疆维吾尔自治区人民医院经肾脏病理活组织检查首次确诊为IMN及外院诊断IMN在我院随访的成年患者(18~80岁);(2)在2周内两次非同日24 h尿蛋白定量>5 g[7];(3)使用肾素-血管紧张素至少3个月后,蛋白尿量下降<50%,估算肾小球滤过率(estimated glomerular filtration rate,eGFR)≥40 mL·min-1·(1.73 m2)-1。
2.排除标准 (1)继发性膜性肾病:有自身免疫性疾病(系统性红斑狼疮、干燥综合征)、慢性病毒肝炎(如乙肝)、内分泌代谢疾病(如糖尿病)、恶性肿瘤(如多发性骨髓瘤)等引起的;(2)药物(如非类固醇抗炎药、重金属);(3)明确诊断合并其他肾病综合征;(4)中途更换治疗方案。本研究所遵循的程序符合伦理学要求,并经新疆维吾尔自治区人民医院伦理委员会批准(批准编号20180118150)。
二、临床资料的收集
1.一般资料 性别、年龄等。
2.检验资料 (1)尿液检查:尿常规、24 h尿蛋白定量等;(2)血液检查:血肌酐、血尿素氮、血尿酸、血浆白蛋白、PLA2R-Ab、eGFR值。
3.肾脏病理 光镜、电镜及免疫荧光结果。
三、治疗方案
患者首剂静脉滳注375 mg/1.73 m2利妥昔单抗(复宏汉霖提供)。如果6个月时蛋白尿在从基线减少≥25%但是没有完全缓解,且CD19+B细胞计数>5个,均给予利妥昔单抗。如果在6个月时观察到完全缓解,则不需要给予第二个疗程。如果蛋白尿在6个月内减少<25%,则认为患者治疗失败停用利妥昔单抗。
四、随访
自每例患者开始治疗之日起计算,根据患者血清PLA2R-Ab水平分为阳性组和阴性组,每3个月进行1次随访,随访指标包括24 h尿蛋白定量、尿微量白蛋白、血肌酐、尿素氮、血浆白蛋白、尿蛋白/肌酐比值等指标以及当前治疗方案。上述指标可通过住院随访查询新疆维吾尔自治区人民医院住院电子病历系统、门诊系统、电话随访的形式收集上述相关资料。随访终点为IMN部分缓解和完全缓解(根据2012年KDIGO指南,完全缓解定义:至少间隔1周的两次测量,24 h尿蛋白定量<0.3 g或尿蛋白/肌酐比值<300 mg/g,且血清白蛋白、血肌酐水平正常;部分缓解定义:至少间隔1周的两次测量,24 h尿蛋白定量<3.5 g或尿蛋白/肌酐比值<3500 mg/g,且24 h尿蛋白定量较最高峰值下降至少50%,血清白蛋白较基线值有所升高或正常,血肌酐水平稳定)。
五、统计学方法
采用SPSS 19.0软件进行数据的统计学处理,符合正态分布且方差齐性的计量资料以Mean±SD表示,运用两独立样本的t检验,计数及等级资料运用χ2检验。用Kaplan-Meier法分析各组缓解率,用Log-rank检验比较组间缓解率,Cox单因素及多因素风险回归模型调整影响疗效的因素。P<0.05为差异有统计学意义。
结 果
一、基线资料
本研究共纳入132例患者,其中12例患者被剔除,失访率为9.0%,最终纳入120例患者,将其分为PLA2R-Ab阳性组(n=87)及PLA2R-Ab阴性组(n=33),两组在体重、基线肌酐、eGFR、尿酸、24 h尿蛋白定量、血浆白蛋白等方面差异有统计学意义(P<0.05),其余方面均差异无统计学意义。(表1)
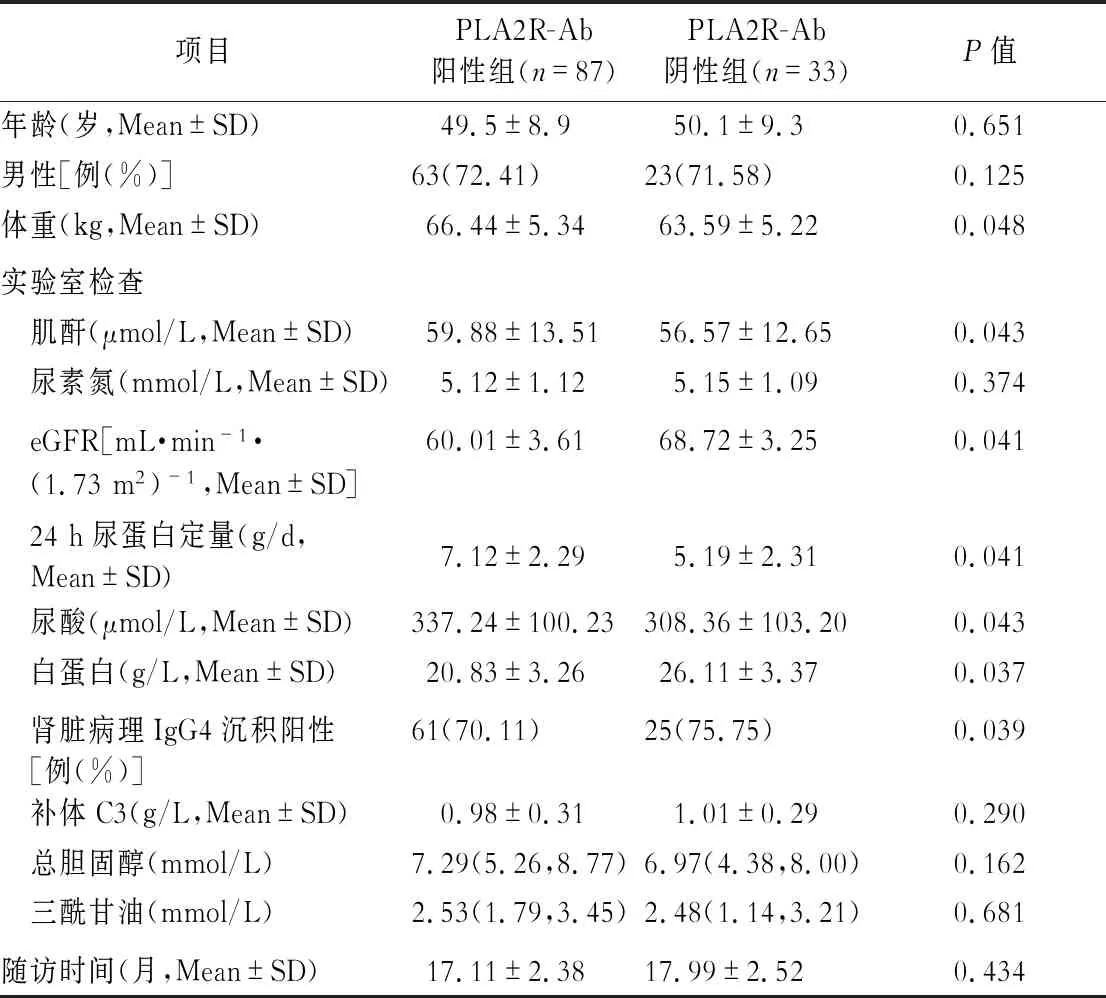
表1 2组患者基线资料
二、随访情况
本研究共持续34个月,中位随访时间为17.11个月,在随访期间,达到完全缓解17例,达到部分缓解14例,总缓解率为25.9%。
三、疗效
将所纳入的患者分为PLA2R-Ab阳性组(n=87)及PLA2R-Ab阴性组(n=33)。研究表明,PLA2R-Ab阳性组使用利妥昔单抗治疗后达到部分缓解的有8人(9.1%),而PLA2R-Ab阴性组有9例(27.3%,χ2=5.057,P=0.0245),见图1。PLA2R-Ab阳性组达到完全缓解有6例(6.9%),而PLA2R-Ab阴性组达到完全缓解有8例(24.2%,χ2=7.506,P=0.0061),见图2。
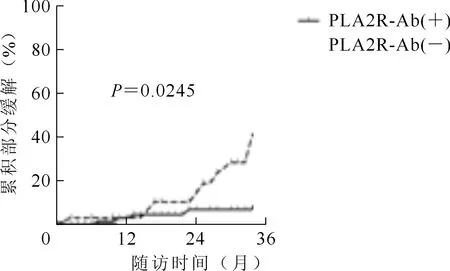
图1 RARA阳性组与阴性组的累积部分缓解率比较
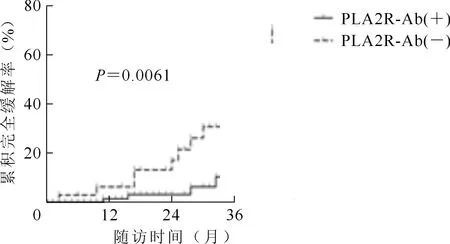
图2 RARA阴性组与阴性组累积完全缓解率的差异
由表2可见,单因素及多因素Cox回归分析矫正两组具有统计学差异的因素后得出PLA2R-Ab及肾组织IgG4阳性可作为预测IMN患者使用利妥昔单抗后完全或部分缓解率的独立因素,同时24 h尿蛋白定量在一定程度上也可能影响疗效,但体重、肌酐、eGFR、尿酸、白蛋白水平对疗效无影响。
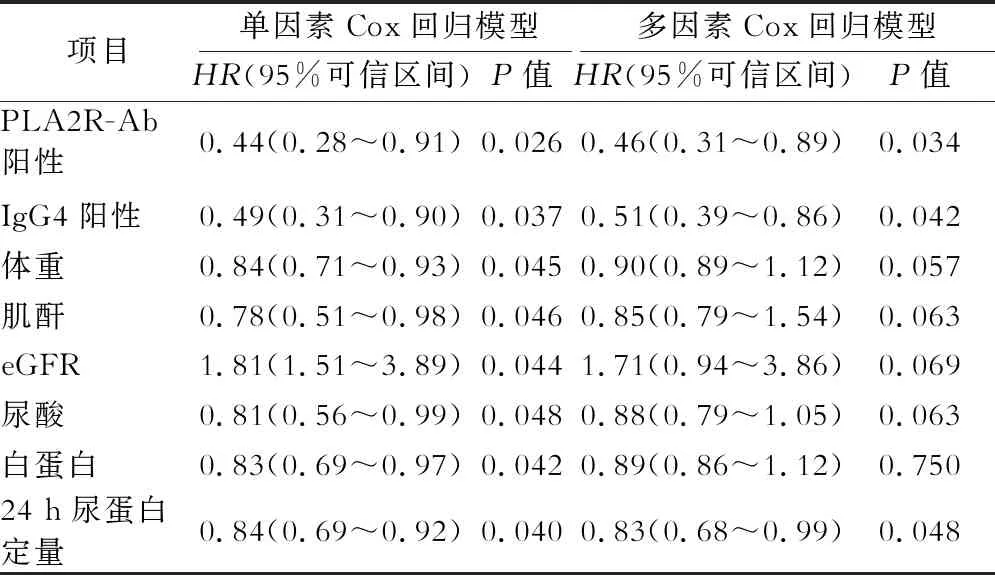
表2 单因素及多因素Cox回归模型分析IMN患者使用利妥昔单抗后完全或部分缓解影响因素
讨 论
大量蛋白尿是IMN使用免疫抑制治疗的必要条件[8]。但也有研究发现血清PLA2R-Ab滴度高,24 h尿蛋白定量低的IMN患者,在免疫抑制剂治疗后无效者,也会发展为大量蛋白尿,可能是由于PLA2R在治疗中发生了表位扩展,继而加重了IMN患者的蛋白尿[9]。由此可见,蛋白尿量并不能预测IMN的预后[10]。本研究发现患者蛋白尿量结果能够在一定程度上影响利妥昔单抗的疗效,因为蛋白尿量能够反映肾小球基底膜损伤情况,从而反映病变严重程度,而如根据蛋白尿的严重程度来评估治疗效果,需在治疗后3~6个月。因此,需去探索更敏感的预测IMN疗效的生物学标志物,指导治疗方案的调整。早有研究显示,对于肾功能不全、初治、复治及难治的患者,可使用利妥昔单抗CD20靶向治疗,利妥昔单抗有望成为重度PMN的一线治疗药[11]。本研究就基线PLA2R-Ab水平对利妥昔单抗治疗IMN效果的预测价值展开了研究。
PLA2R-Ab在诊断、鉴别诊断IMN方面发挥举足轻重的作用。日前,研究者逐渐将目光移至PLA2R-Ab在IMN治疗中的监测作用,NEJM上发表了一篇研究显示:PLA2R-Ab是利妥昔单抗治疗IMN有效性的早期标志物。相较于对症支持治疗,联合利妥昔单抗可显著降低PLA2R-Ab水平[12],而在MN患者治疗过程中,监测PLA2R-Ab水平可评估MN的免疫缓解率,高PLA2R-Ab水平(>204 U/mL)提示疾病活动性,治疗上建议加用免疫抑制治疗。若治疗后PLA2R-Ab滴度下降未大于50%,提示预后不良。此外,获得临床缓解后PLA2R-Ab持续阳性提示复发的可能性较大,且PLA2R-Ab较尿蛋白等临床指标提前3个月提示疾病复发。本研究结果显示,PLA2R-Ab阳性的患者完全或部分缓解率均明显低于阴性组,这与先前研究结果一致,可能因特发性膜性肾病患者足细胞上存在PLA2R,由被激活的B细胞产生的免疫球蛋白与肾小球原位抗原结合形成免疫复合物沉积于肾小球基底膜[13],导致后续补体系统激活、毛细血管壁和裂隙膜损伤,继而导致足细胞功能损害和蛋白尿形成[14]。因此,本研究认为血清PLA2R-Ab是监测疾病活动及临床疗效的敏感指标,可指导个体治疗方案的调整[15]。
本文可能存在以下局限性:(1)样本量小;(2)新疆地区对于慢性肾脏病的一般管理情况差如血压管理,目标值低于130/80 mmHg,饮食钠限制为每天少于4 g,饮食中蛋白质限制每天每千克体重0.8 g至 1 g蛋白质等。(3)未能进一步探索PLA2R-Ab抗体滴度及肾组织IgG4沉积的强度与疗效具体的相关性。(4)本研究仅初探PLA2R-Ab预测利妥昔单抗疗效,未能在随访过程中检测PLA2R-Ab抗体水平,从而更好地评估疗效。(5)仅6个月后监测CD19决定后续治疗方案,未能更全面的评估患者的疗效及预后。上述不足也是本团队未来努力的方向。
综上所述,血清PLA2R-Ab阳性的IMN患者使用利妥昔单抗治疗的疗效差。因此,对于此类临床应予以重视,早期采取干预措施,亟需寻找新的治疗方案。鉴于本研究的局限性,需更多的大样本、多中心的RCT去证实。
利益冲突所有作者均声明不存在利益冲突
