犬瘟热病毒YD株的分离鉴定及其H基因序列分析
2021-04-13张建普马丽利周利锋
张建普,马丽利,周利锋*
(1.河南省偃师市动物卫生监督所,河南 偃师 471900;2.上海启盛生物科技有限公司,上海 201203)
犬瘟热(canine distemper,CD)是由犬瘟热病毒(canine distemper virus,CDV)引起的急性、高度接触性传染病。CDV属于副黏病毒科、麻疹病毒属,宿主范围广,可感染犬科、鼬科、浣熊科及多种野生动物,主要侵害易感动物的呼吸系统、消化系统和神经系统,是当前养犬业和毛皮动物养殖业危害最大的病原之一[1]。19世纪60年代以来,CDV弱毒疫苗的使用使该病得到了控制,但是近年来,世界各地相继出现了犬瘟热的暴发[2-6]。随着毛皮动物养殖业和宠物产业在我国的不断发展,犬瘟热在各地毛皮动物养殖场和宠物养殖场也常有发生,给我国经济动物养殖业造成了经济损失。CDV是单股负链RNA病毒,基因组全长15 690 nt,编码核衣壳蛋白(N)、磷蛋白(P)、基质膜蛋白(M)、融合蛋白(F)、血凝素蛋白(H)、大蛋白(L)蛋白。其中H蛋白是CDV囊膜糖蛋白,对病毒本身和宿主都非常关键。病毒感染的起始阶段需要借助H蛋白和宿主细胞受体结合来吸附于宿主细胞上;宿主针对H蛋白产生的保护性免疫反应可以阻止CDV的感染[7]。另外,H基因在6个基因中变异率最高,因此成为研究CDV变异情况的主要目的基因[8]。本试验从江苏疑似犬瘟热病犬的脾、肺和肠系膜淋巴结混合病料中成功分离了1株病毒,经鉴定该病毒为CDV强毒株,并对其H基因全长序列进行了分析。
1 材料与方法
1.1 病料
江苏某动物医院疑似犬瘟热病犬,采集其脾、肺和淋巴结。
1.2 细胞及主要试剂
表达犬淋巴细胞信号活性分子(SLAM,CD150)的Vero-SLAM细胞系由本实验室保存。细胞生长液为含7%胎牛血清的DMEM,维持液为2%胎牛血清DMEM,Gibco胎牛血清购自Life Technologies,DMEM购自北京清大天一生物技术有限公司,CDV单克隆抗体购自北京世纪元亨动物防疫技术有限公司;羊抗鼠FITC荧光抗体购自Sigma。病毒RNA提取试剂盒购自天根生化科技有限公司;RNA PCR Kit(AMV)Ver.3.0购自TaKaRa公司。PCR仪购自北京鼎昊源科技有限公司,型号:DHS96G;多样品组织研磨机购自上海净信实业发展有限公司,型号:Tiss-24;荧光倒置显微镜购自OLYPUS,型号:CKX41。
1.3 参考毒株
犬瘟热活疫苗CDV-11株,购自齐鲁动物保健品有限公司。
1.4 实验动物
3月龄比格犬5只,购自上海交通大学农学院;9~10周龄水貂、10~12月龄水貂各5只,购自江苏启东某貂场;9~10周龄狐狸5只,购自上海南汇某狐场。以上动物血清CDV中和效价均小于1∶4。
1.5 病料处理
将采集的病犬的脏器剪碎,按重量加入DMEM(含有1 000 IU/mL的青霉素和1 mg/mL的链霉素),制成10%组织悬液,用多样品组织研磨机将其研磨成匀浆,8 000 r/min 于4 ℃离心30 min,吸取上清,于-70 ℃保存。
1.6 病毒的分离培养
Vero-SLAM细胞长成单层后,接种准备好的组织上清,37 ℃吸附1 h,然后加入1%维持液,于37 ℃,5% CO2培养箱中培养,逐日观察,出现80%细胞病变(CPE)时收毒。同时设细胞对照。
1.7 TCID50测定
将病毒进行10倍的倍比稀释,然后接种在覆盖有Vero-SLAM细胞的96孔细胞培养板中,每个稀释度5孔,100 μL/孔,置于37 ℃,5% CO2细胞培养箱中培养6 d,观察CPE,按照Reed-Muench法计算CDV滴度。
1.8 间接免疫荧光(IFA)鉴定
将病毒原液进行10倍的倍比稀释,接种在覆盖有每孔2×104个Vero-SLAM细胞的96孔细胞培养板中,每个稀释度5孔,0.1 mL/孔,置于37 ℃ 5% CO2细胞培养箱中,培养4 d后,弃去培养基,用PBS(0.01 mol/L,pH值7.2)洗涤1次,每孔加入100 μL 75%乙醇,室温固定30 min,弃去固定液,用PBS洗涤1次,自然干燥,加入1∶100稀释的CDV单克隆抗体,80 μL/孔,37 ℃作用1 h,PBS洗3次,每次间隔5 min,然后加入1∶200稀释的羊抗鼠荧光二抗,37 ℃作用1 h,PBS洗3次,每次间隔5 min,干燥后,在荧光显微镜下观察,出现特异性亮绿色则为阳性,反之为阴性。
1.9 血凝试验
参照《中华人民共和国兽药典》附录12,分别用1%的豚鼠、鸡、猪、人“O”型红细胞,对分离的第1代病毒进行血凝试验,检测病毒的血凝谱;同时,确定病毒感染材料中是否存在犬腺病毒(CAV)、犬副流感病毒(CPIV)或犬细小病毒(CPV)等外源病毒,此3种病毒均具有血凝性。
1.10 RT-PCR鉴定
1.10.1 引物设计和合成
根据Sanjay等[9]报道合成1对引物扩增N基因部分片段,N-F(5′-GTTAGCTAGTTTCATCCT-3′)和N-R(5′-GGTCCTCTGTTGTCTTGG-3′),预期扩增419 bp片段。参考GenBank中CDV全基因参考序列(登录号:AF378705),利用软件Primer Premier 5.0设计1对引物扩增H基因,H-F(5′-CTCAGGTAGTCCARCAATG-3′)和H-R(5′-CCTCAGGGTATAGAATCTGGT-3′),预期扩增2 007 bp片段。引物由上海生物工程有限公司合成。
1.10.2 病毒RNA提取
按照病毒RNA提取试剂盒的产品说明书提取病毒RNA。
1.10.3 RT-PCR检测
按照RNA PCR Kit的产品说明书进行RT-PCR。
N基因PCR程序为:94 ℃预变性3 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,扩增30个循环;最后72 ℃延伸7 min,4 ℃保存。
H基因PCR程序为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸2 min,扩增30个循环;最后72 ℃延伸10 min,4 ℃保存。
1.11 致病性试验
攻毒组3只犬,每只静脉接种2.0 mL,鼻内1.0 mL 分离的第1代细胞毒(104.625TCID50/mL),对照组1只,接种DMEM细胞培养液,接种量和接种途径与攻毒组一致。观察10 d,然后剖检,采集脾、肺和肠系膜淋巴结,按照1.6所述分离病毒。按照表1安排进行试验。参考文献[10]制定临床评分系统,正常为0分;死亡为20分;与正常体温相比,变化不大于0.5 ℃记为1分,大于0.5 ℃记为2分。见表2。

表1 动物分组
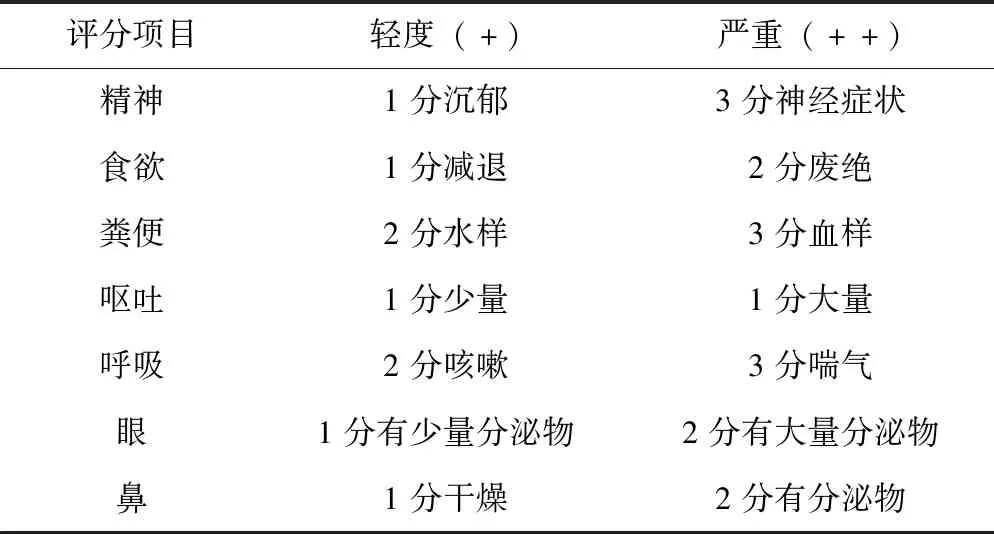
表2 动物感染犬瘟热临床评分标准
1.12 H基因测序和分析
按照TaKaRa的RNA PCR Kit说明书进行RT-PCR。PCR程序为94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸2 min,扩增30个循环;最后72 ℃延伸10 min,4 ℃保存。PCR产物经1%的琼脂糖凝胶电泳鉴定,按照DNA纯化试剂盒说明书回收目的条带,由上海生物工程有限公司测序。使用DNAStar 7.1对测得H基因序列进行比对分析,NetNGlyc 1.0 对推导的氨基酸序列进行分析,使用Mega 5.02绘制系统发生树。

表3 参考基因序列
2 结果
2.1 病毒的分离
在Vero-SLAM细胞上接种病料组织悬液,48 h出现合胞体、细胞溶解、胞浆空泡化、细胞脱落等细胞病变(CPE)(见图1)。测定第1代细胞毒滴度为104.625TCID50/mL。
2.2 间接免疫荧光鉴定
感染分离病毒的Vero-SLAM细胞有特异性绿色荧光,对照细胞无荧光(见图2)。
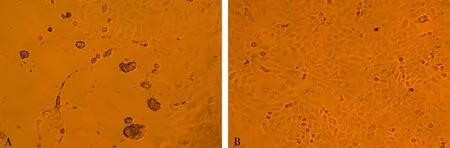
A. 接种病料的Vero-SLAM细胞;B.细胞对照图1 Vero-SLAM细胞接种病料组织后的形态变化(100×)
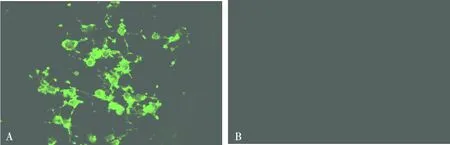
A.感染分离病毒后的Vero-SLAM细胞;B.细胞对照图2 IFA鉴定结果(200×)
2.3 血凝谱和外源病毒检测
分离病毒不能凝集豚鼠、鸡、猪、人“O”型红细胞,说明分离株无血凝活性,且病毒感染材料中无CAV、CPV和CPIV。
2.4 RT-PCR鉴定
通过1%琼脂糖电泳,分离病毒RT-PCR产物大小为419 bp,与预期相符(见图3)。

M.100 bp DNA Marker;1.CDV YD株;2.阳性对照图3 N基因RT-PCR扩增结果
2.5 对不同动物的致病性
接种分离病毒后第5~7天,动物开始出现体温升高、精神沉郁、食欲减退、鼻镜干燥、眼鼻有浆液性分泌物等症状,观察至21 d,未见神经症状。1号狐狸于攻毒后第8天患急性犬瘟热死亡。第21天剖检可见肠系膜淋巴结肿大,小肠黏膜出血,肺脏肉变,出血,脾脏肿大,出血等病变。攻毒后第4天开始可以从粪便和鼻拭子中检测到CDV。对照组未观察到异常症状和病理变化。临床累计得分表明,攻毒组动物得分明显高于对照组,说明攻毒组动物均出现犬瘟热症状。详情见表4。以上结果鉴定分离的病毒为CDV,命名为YD株。
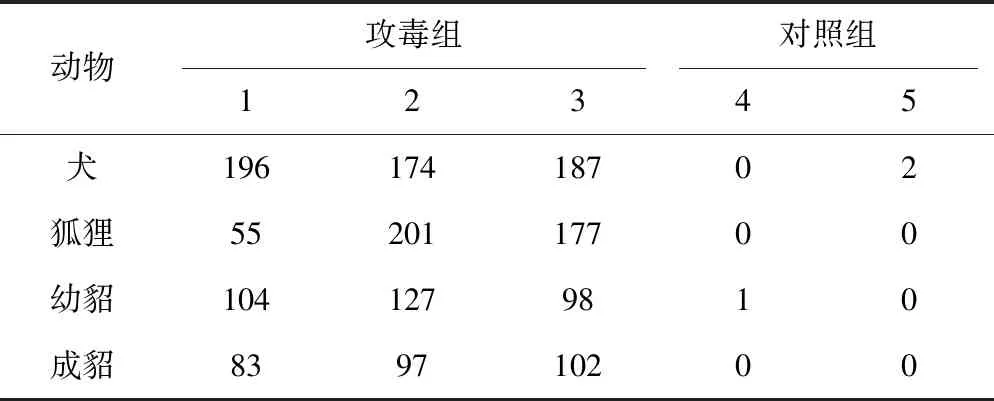
表4 分离病毒攻毒后动物21 d评分累计结果
2.6 H基因测序和分析
利用H基因特异性引物,经PCR扩增后获得大小为2 007 bp的片段,与预期大小相符(见图4)。YD株H基因仅含有1个ORF,全长1 824 bp,编码607个氨基酸。YD株H基因与强毒株核苷酸同源性为92.8%~99.7%,氨基酸同源性为93.0%~99.7%,与国内强毒株核苷酸同源性较近,为98.4%~99.7%,而与疫苗株核苷酸同源性较远为91.2%~91.5%,氨基酸同源性为90.3%~91.2%。利用Mega 5.02绘制系统发生树(见图5)。从系统发生树中可以看出,CDV分为两大分支,疫苗株和野毒株,后者分5个基因型,YD株与国内野毒株在一个大分支中,属于国内流行基因型Asia-1型。此外,CDV YD株推导的H蛋白氨基酸中有保守的12个半胱氨酸(Cys)残基,9个潜在天冬酰胺连接(N-)糖基化位点,分别在第19~21、149~151、309~311、391~393、422~424、456~458、584~586、587~589、603~605位(见图6)。

1.阴性对照;2.阳性对照;3.CDV YD株;4.DNA 分子量标准(DL 1000)图4 H基因RT-PCR扩增结果

图5 CDV H基因核苷酸序列的系统进化树

注:阴影部分为潜在N连接糖基化位点(N-X-S/T);▼为Cys位点图6 CDV 不同分离株H蛋白氨基酸序比对分析
3 讨论
CDV对外界环境的抵抗力差,其脂质囊膜结构易被光、热破坏,导致病毒灭活,使得病毒分离成功率较低[3]。因此,临床组织病料采集时尽量处于低温环境,采集后尽快低温保存,这样才能使病毒在接种细胞前不被灭活。另外,采样的部位、时间、样品处理、病程类型、病犬的抗CDV抗体水平等因素都对病毒的分离有一定的影响,但最主要的因素是分离CDV所选细胞是否敏感。Vero-SLAM细胞可以表达犬淋巴细胞信号活性分子(SLAM,CD150),CDV感染细胞时通过识别SLAM进入细胞进行复制[11],大大提高了CDV的感染效率,并且感染后的细胞会出现明显的CPE,便于进行病毒分离和滴度测定。病料组织在接种Vero-SLAM细胞48 h后,出现了与CDV疫苗株相同的变化,如细胞溶解、胞浆空泡化、合胞体等CPE,测定分离病毒第1代细胞毒滴度为104.625TCID50/mL。分离的病毒不凝集豚鼠、猪、鸡和人“O”型红细胞,一方面说明该病毒无血凝性,另一方面说明该病毒材料不含CAV、CPV或者CPIV,通过间接免疫荧光检测证明该病毒为CDV。通过RT-PCR鉴定可以扩增到419 bp的目的条带,与CDV疫苗株一致。犬、水貂、狐狸接种分离毒株后5~7 d开始出现犬瘟热症状,并可以监测到感染动物排毒。对动物的致病性试验也为不同动物的CDV攻毒模型的建立提供一定的参考。以上结果均符合犬瘟热病毒特点[12],证明分离的病毒是犬瘟热病毒。
CDV主要分为7个基因型,Asia-1、Asia-2、Europe、Europe Wildlife、vaccine(America-1)、America-2、Arctic[12],另外,近几年一些地区出现了新的病毒谱系,预示着它们可能是新的基因型,例如Africa、Asia-3、Argentina和America[13-17]。H基因系统发生树结果表明,CDV具有地理性分布现象,YD株与国内的毒株同源性较高组成一个系,欧美和日本各成一个系。另外,其分布与宿主无关,进化树中不同宿主来源的毒株均成随机分布。这些结果与其他学者报道一致[18-19]。蛋白质糖基化程度可能影响病毒的抗原性,CDV H蛋白潜在的N连接糖基化位点不同可能会破坏重要的中和相关表位位点[20-22]。目前最常用的疫苗株是Onderstepoort和Convac,两者的N连接糖基化位点分别是6个和7个,而野毒株为8个或9个,其中309~311位(H蛋白位置)为野毒株特有。这些遗传差异可能是近年来暴发犬瘟热的重要原因[23]。YD株H蛋白中有9个潜在的N连接糖基化位点(N-X-S/T),与国内大多数野毒株相同,而第584~586位为国内毒株所特有。CDV H蛋白中天冬氨酸(Cys)对该蛋白成熟过程的正确折叠是必要的[24],YD株H蛋白中可见12个保守的Cys残基,且所在位置均与其他毒株相同。
综上所述,本试验从病犬组织中成功分离到1株CDV强毒株;H基因测序分析显示,该毒株属于Asia-1型。研究结果为当前中国CDV毒株变异情况提供了参考,为疫苗研发奠定了基础。
