草鱼白介素10基因的克隆表达及其双抗体夹心ELISA检测方法的建立
2021-04-13胡忠俊吕丽丽李槿年
胡忠俊,周 昊,吕丽丽,李槿年
草鱼白介素10基因的克隆表达及其双抗体夹心ELISA检测方法的建立
胡忠俊,周 昊,吕丽丽,李槿年*
(安徽农业大学动物科技学院,合肥 230036)
为建立检测草鱼白介素10(IL-10)的双抗体夹心ELISA方法,首先克隆IL-10基因、构建与表达原核表达重组质粒pET-32a-IL-10,并对表达产物进行纯化,以获得重组IL-10(rIL-10)纯化蛋白。然后,以纯化的rIL-10蛋白为免疫原制备兔源及鼠源抗rIL-10的多克隆抗体,并对其进行纯化与酶标记。最后,以纯化的鼠抗rIL-10抗体为捕获抗体,rIL-10纯化蛋白为夹心抗原,HRP标记的兔抗IL-10纯化抗体为检测抗体,通过优化反应条件,建立双抗体夹心ELISA检测方法。结果显示,该方法的优化反应条件包括,捕获抗体的最佳包被浓度为20 μg·mL-1,检测抗体的最佳稀释度为1∶3 200,最佳封闭条件是使用5%脱脂奶粉,37 °C封闭1.5 h,样品反应时间为2 h,以450值≥0.174作为阳性判定标准。该方法的板内及板间重复性变异系数小于10%,最低检测限量为24.29 ng·mL-1,与草鱼白介素6、草鱼肿瘤坏死因子、小鼠白介素10、小鼠干扰素和小鼠单核细胞趋化蛋白均无交叉反应。结果表明,建立的双抗体夹心ELISA方法具有较好的特异性、重复性和灵敏度,可用于草鱼白介素10的快速检测。
草鱼白介素10;克隆表达;抗体制备;双抗体夹心ELISA
白介素-10(Interleukin 10,IL-10)是一种由单核巨噬细胞、树突状细胞、B细胞、CD8+T细胞和NK细胞等细胞分泌的多功能免疫调节因子,参与多种细胞和疾病的生物调节[1-4]。IL-10不仅具有抑制调节性T细胞增殖、促炎因子的合成与抗原递呈等免疫抑制作用,还可发挥促进肥大细胞、NK细胞和B细胞的活化和分化,增强单核巨噬细胞的吞噬作用[5-7]。因此,体内IL-10水平是评价机体免疫状况或疫苗免疫效果的重要指标之一。
细胞因子可通过生物活性、免疫学和分子生物学方法检测[8]。酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)因其快速、特异和灵敏等优点,是最常用的细胞因子检测方法[9]。目前已有商品化ELISA检测试剂盒用于人源和鼠源IL-10检测。
1 材料与方法
1.1 试验材料
原核表达载体pET-32a由实验室保存,限制性核酸内切酶、T4DNA 连接酶和pMD-18T Vector Cloning Kit 购自(大连)TaKaRa生物技术工程有限公司,DNA 回收试剂盒、质粒小提试剂盒以及BL21感受态细胞购自(北京)天根生化科技有限公司,标记的鼠抗兔和兔抗鼠HRP-IgG 购自北京全式金生物技术有限公司,Protein G 亲和层析纯化柱购自GE公司,亲和层析镍柱购自北京瑞达恒辉科技发展有限公司,BCA蛋白测定试剂盒购自赛默飞世尔科技公司;新西兰大白兔(约2 kg)和BALB/C 小鼠(5~6周龄,雌性)购自安徽医科大学实验动物中心,草鱼(约250 g)购自合肥高新技术农业园,草鱼白介素6重组蛋白(rIL-6)和草鱼肿瘤坏死因子重组蛋白(rTNF-α)均由本实验室制备,小鼠白介素10(mIL-10)、小鼠干扰素(mIFN-γ)和小鼠单核细胞趋化蛋白-1(mMCP-1)由安徽农业大学传染病学实验室馈赠,VA5免疫增强剂由江苏省农业科学院动物免疫工程研究所惠赠。
1.2 CiIL-10基因的克隆表达
1.2.1IL-10基因的克隆 以草鱼头肾组织cDNA为模板,用IL-10基因的特异性引物(F:5′- CCGTTAGTGCTTTTCTCTCTTT-3′,下划线处为I酶切位点;R:5′-CCGATGA TTTTCTCTAGAGTCATCTT-3′,下划线处为I酶切位点)PCR扩增其全长序列。PCR反应体系(25 μL)包含2×PCR Mix 12.5 μL,上、下游引物(20 μmol·L-1)各1.0 μL,模板2.0 μL,ddH2O 8.5 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。产物回收纯化后,克隆至pMD-18T构建重组克隆质粒pMD-18T-IL-10。
1.2.2IL-10基因原核表达载体的构建、诱导表达及纯化 重组克隆质粒和pET-32a载体质粒经I/I双酶切后用T4DNA连接酶连接,转化至BL21感受态细胞。转化液涂布于含100 μg·mL-1氨苄青霉素的LB培养板,次日挑取单菌落进行PCR鉴定,并从阳性菌中抽提质粒进行双酶切和测序鉴定。随后,将阳性菌株扩大培养至6000.4,加入终1.0 mmol·L-1的IPTG,180 r·min-1、30 ℃诱导表达6 h。离心收集菌体后经PBS洗涤、冻融、超声破碎、离心收集上清和沉淀进行12% SDS-PAGE分析。重组蛋白经亲和层析柱纯化后再用BCA蛋白测定试剂盒检测其浓度。
1.3 兔抗CiIL-10多克隆抗体的制备、纯化及酶标记
1.3.1 多克隆抗体的制备 用PBS将rIL-10蛋白配成浓度为1 mg·mL-1的蛋白液,与司本白油佐剂以及VA5 免疫增强剂乳化混合成免疫原。以1 mg rIL-10·只-1注射于兔颈背部皮内,免疫后第14、 21天各加强一次。第28天采集心脏血、分离免疫血清。
1.3.2 多克隆抗体的纯化与酶标记 免疫血清依次经饱和硫酸铵分级沉淀、PBS透析除盐和Protein G 亲和层析柱纯化来提纯兔抗IL-10抗体。BCA蛋白测定试剂盒测定纯化抗体的浓度,SDS-PAGE分析其纯度。采用碘酸钠法[16]用辣根过氧化物酶(HRP)标记兔抗IL-10抗体,并用50%饱和硫酸铵沉淀法除去游离的酶及酶-酶聚合体,得到酶标兔抗IL-10抗体,通过SDS-PAGE分析其纯度,间接ELISA法检测其效价。
1.4 鼠抗CiIL-10多克隆抗体的制备与纯化
免疫原制备同1.3.1。以200 μg·只-1的剂量颈背部皮下多点注射,免疫BALB/C小鼠,其余免疫程序同1.3.1。鼠源免疫血清经Protein G亲和层析纯化柱纯化后,采用1.3.2方法测定其浓度、纯度与效价。
1.5 双抗体夹心ELISA检测方法的建立
1.5.1 捕获抗体与检测抗体最佳工作浓度的确定 采用方阵滴定法确定捕获抗体(纯化的鼠抗IL-10抗体)和检测抗体(酶标兔抗IL10抗体)的最佳工作浓度。主要步骤是:分别以浓度为20、10、5、2.5和1.25 μg·mL-1的捕获抗体按100 μL·孔-1包被酶标板。次日,经PBST洗涤后,用含5%脱脂奶粉37 ℃封闭2 h。洗板后,加入浓度为30 ng·mL-1的rIL-10蛋白,100 μL·孔-1,37 ℃作用2 h。洗板后,分别加入1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200和1∶6 400稀释的检测抗体,100 μL·孔-1,37 ℃孵育1 h。洗板后,加TMB底物液,37 ℃显色5 min,加50 μL终止液,测定450值。同时作阴性对照和空白对照,根据450值以及P/N值确定两种抗体的最佳工作浓度。
通过对部分职业院校教师调查和分析,目前教师在教科研能力主要两种倾向,第一种倾向是认为自己只要上好课就行了,高不可攀的教科研与自己关系不大,有这种认识的大多数是普通专业教师;第二种倾向是想致力于提升自己教科研综合能力,但找不到交流合作培训的平台,持这种观点的教师基本都是骨干教师、专业带头人。
1.5.2 最佳封闭液与封闭条件的选择 分别用5%脱脂奶粉、5%BSA和5%明胶作为封闭液,在37 ℃ 1.5 h、37 ℃ 2 h和4 ℃ 12 h条件下封闭后进行抗原抗体反应,每组重复3孔,经底物液显色后测定450值,取平均值并计算P/N值,确定最佳封闭液及封闭条件。
1.5.3 双抗体夹心ELISA检测方法的操作程序 根据上述优化最佳条件,加入待检样品(100 μL·孔-1,重复3孔),37 ℃作用2 h,PBST洗涤3次,加入1∶3 200稀释的酶标兔抗IL-10(100 μL·孔-1),37 ℃作用1 h,再洗涤。最后,加TMB底物液,37 ℃避光显色5 min,终止反应后测定450值。同时设立阳性、阴性和空白对照。
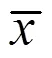
1.6 双抗体夹心ELISA检测方法的灵敏度试验
将rIL-10纯化蛋白倍比稀释为1 000、500、250、125、62.5、31.25、15.625、7.813、3.906和1.953 ng·mL-110个不同浓度,绘制标准曲线,得出线性回归方程,计算检测下限。
1.7 双抗体夹心ELISA检测方法的特异性试验
按上述双抗体夹心ELISA程序,在同一条件下对rIL-10、rIL-6、rTNF-α、mIL-10、mIFN-γ和mMCP-1样品进行检测,确定方法的特异性。
1.8 双抗体夹心ELISA检测方法的重复性试验
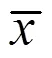
2 结果与分析
2.1 原核表达重组质粒pET-32a-CiIL-10构建与鉴定
结果如图1显示,PCR扩增出与预期目的基因大小一致(558 bp)的DNA条带,见图1(a);双酶切后得到大小约为6 539 bp和558 bp的DNA条带,见图1(b),分别与空载体pET-32a和IL-10 基因的大小相符,见图1(b)。结果表明原核表达重组质粒pET-32a-IL-10构建成功。
2.2 重组CiIL-10蛋白的诱导表达与纯化
结果如图2所示,空质粒和重组质粒经诱导表达后分别在21 kDa和39 kDa附近出现2条浓染的蛋白条带,分别与预期的标签蛋白与rIL-10蛋白的分子量大小一致,说明重组质粒pET-32a-IL-10得到表达(泳道1, 2)。超声后的上清和沉淀部分经电泳分析显示重组蛋白可同时以可溶性与包涵体形式表达,但以后者为主(泳道4)。可溶性表达的rIL-10蛋白经亲和层析柱纯化后,凝胶成像系统软件分析其纯度约为97%(泳道5),BCA蛋白测定试剂盒测得其浓度为0.9 mg·mL-1,可用作后续试验中的免疫原和夹心抗原。
2.3 兔抗rCiIL-10抗体的制备与标记
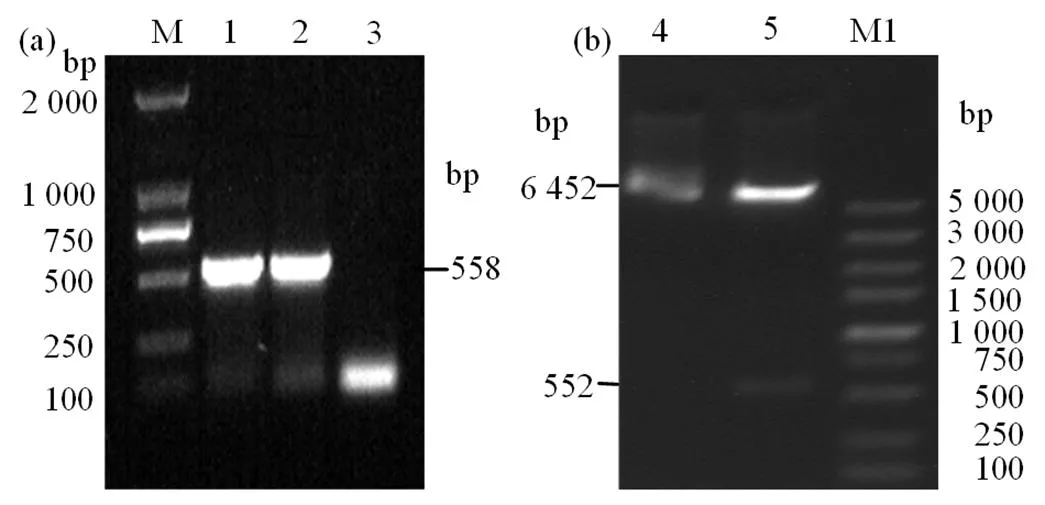
免疫血清经饱和硫酸铵分级沉淀法、PBS透析除盐和Protein G 亲和层析法纯化。12% SDS-PAGE分析显示其纯度约为95%,见图3(a),BCA蛋白测定试剂盒测得其浓度为1.7 mg·mL-1。12% SDS-PAGE分析显示酶标抗体的纯度约为97%,见图3(b),间接ELISA方法测得其效价高达1∶838 860 800。结果表明,所制备的酶标兔抗rIL-10抗体可作后续双夹心ELISA检测方法建立中的检测抗体。
(a) pET-32a-CiIL-10的PCR鉴定,(b)pET-32a-CiIL-10的双酶切鉴定;M. DNA分子质量DL2 000, 1. pMD18-T-CiIL- 10的PCR产物, 2. pET-32a-CiIL-10的PCR产物, 3. 阴性对照,4.重组表达质粒pET-32a-CiIL-10,5.重组表达质粒pET-32a-CiIL-10的EcoRI/XhoI酶切产物,M1.DNA分子质量DL5 000。
Figure 1 PCR and double enzyme digestion identification of recombinant plasmid pET-32a-IL-10

M.蛋白分子量标准,1.诱导的空质粒pET-32a,2.诱导的重组质粒pET-32a-CiIL-10,3.超声破碎后的上清部分,4.超声破碎后的沉淀部分,5.纯化的rCiIL-10蛋白。
Figure 2 SDS-PAGE analysis of expression products obtained by inducing recombinant plasmid pET-32a-IL-10
2.4 鼠抗rCiIL-10抗体的纯度、浓度与效价
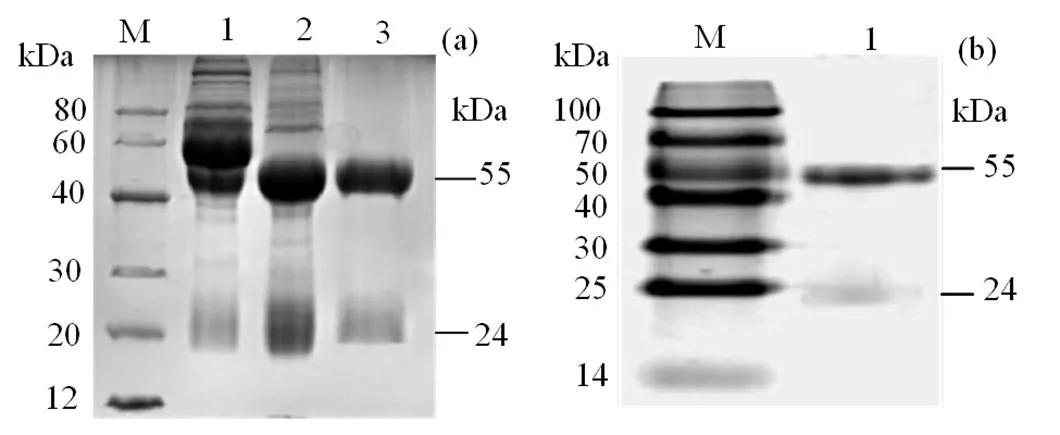
小鼠免疫血清经Protein G亲和层析法纯化后,其纯度约为95%(图4),浓度为1.2 mg·mL-1,间接ELISA方法测得其效价为1∶6 553 600。结果表明所制备的抗体可作后续双夹心ELISA检测方法建立中的检测抗体。
2.5 CiIL-10双抗体夹心ELISA检测方法的条件优化
2.5.1 捕获抗体和检测抗体的最佳工作浓度 方阵滴定试验的结果,捕获抗体(鼠抗IL-10抗体)的最佳包被浓度为20 μg·mL-1,检测抗体(酶标兔抗IL10抗体)的最佳稀释度为1:3 200,此时的P/N值最大,为4.082。
(a)纯化前后兔抗rCiIL-10抗体的SDS-PAGE分析,(b)纯化后兔抗rCiIL-10酶标抗体的SDS-PAGE分析;M.蛋白质分子标准量,1.纯化前兔抗rCiIL-10抗体,2.饱和硫酸铵沉淀后的兔抗rCiIL-10抗体,3.纯化的兔抗rCiIL-10抗体,M1.蛋白质分子标准量,4.纯化后的兔抗rCiIL-10酶标抗体。
Figure 3 SDS-PAGE analyses of rabbit anti-rIL-10 antibody before and after purification as well as purified Rabbit anti rIL-10 antibody labelled with enzyme
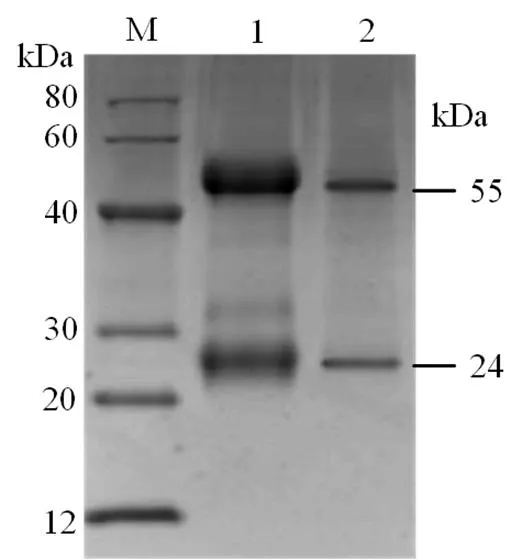
M. 蛋白分子量标准;1.纯化前的;2.纯化后的。
Figure 4 SDS-PAGE analysis for the mouse anti- rIL-10 antibody before and after purification
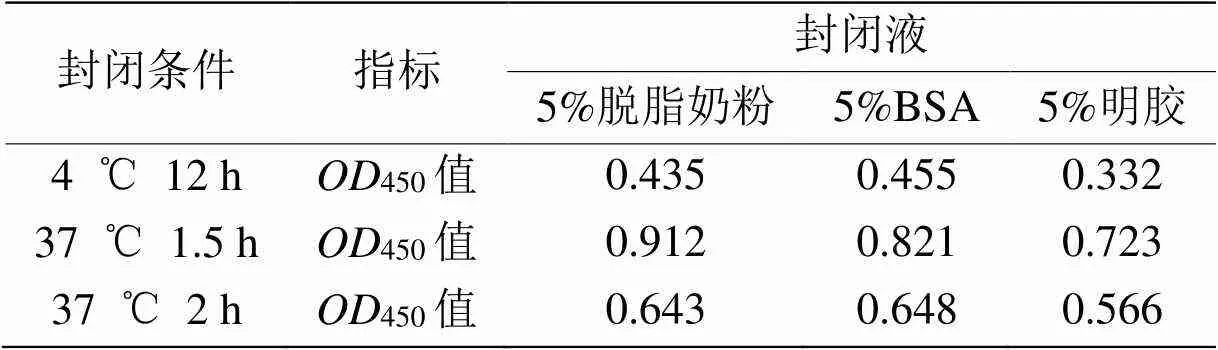
表1 最佳封闭液与封闭条件的确定

表2 30份阴性血清的OD450值
2.5.2 最佳封闭液与封闭条件 用5%脱脂奶粉、5%BSA和5%明胶作为封闭液,在不同条件下进行封闭酶标板,经底物液显色后选择450值接近1.0时对应的封闭液及其作用温度与时间作为最佳封闭液与封闭条件。由表1可见,5%脱脂奶粉为最佳封闭液,其最佳封闭条件为37 ℃封闭1.5 h。最佳封闭液筛选结果与李艳婷等[18]和王方等[19]报道一致。

图5 CiIL-10双抗体夹心ELISA方法的标准曲线
Figure 5 The standard curve of double antibody sandwich ELISA for detectingIL-10
2.6 CiIL-10双抗体夹心ELISA检测方法的临界值
2.7 CiIL-10双抗体夹心ELISA检测方法的灵敏性
以rIL-10浓度的对数为横坐标,450值为纵坐标绘制标准曲线图。由图5所示, rIL-10蛋白浓度的对数值范围在1.495~2.699内与450值具有较好的线性关系。该标准曲线的线性回归方程为=0.665 4−0.747 8,为rIL-10浓度的对数,相关系数2为0.994 9。将阴阳临界值0.174代入线性回归方程,得出所建立方法的最低检测限量为24.29 ng·mL-1。

表3 特异性试验结果
2.8 CiIL-10双抗体夹心ELISA检测方法的特异性
采用建立的双抗体夹心ELISA方法在同一条件下对rIL-10、rIL-6、rTNF-α、mIL-10、mIFN-γ和mMCP-1样品进行检测。结果如表3,除了rIL10的检测结果为阳性外,其余样品均为阴性,说明所建立的双抗体夹心ELISA方法的特异性强。
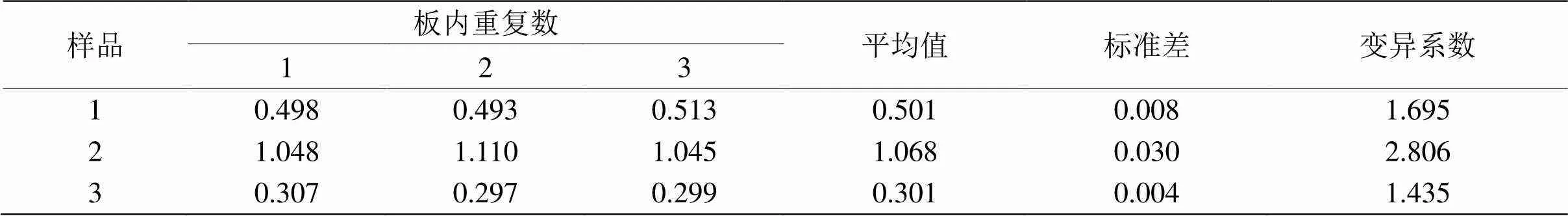
表4 板内重复性试验结果
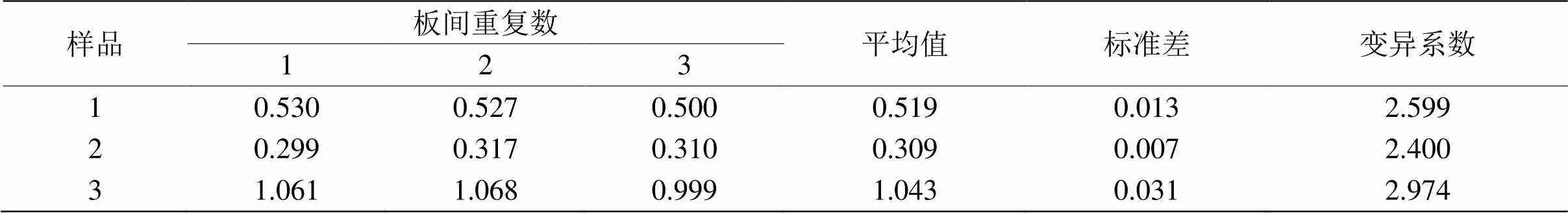
表5 板间重复性试验结果
2.9 CiIL-10双抗体夹心ELISA检测方法的重复性
用LPS刺激后的草鱼肠巨噬细胞上清液作为检样进行板内和板间重复性试验。结果由表4和5可见,板内与板间重复试验的变异系数均小于10%,说明建立双抗体夹心ELISA检测方法的重复性好。
3 讨论
白介素-10(IL-10)是一种多功能免疫调节因子。针对目前尚无检测IL-10检测试剂盒的现状,本研究建立了检测IL-10的双抗体夹心ELISA方法。夹心抗原、捕获抗体与检测抗体是影响双抗体夹心ELISA的三大关键因素。由于无商品化的IL-10蛋白作标准品,本研究利用原核表达系统克隆表达IL-10基因,制备rIL-10纯化蛋白。rIL-10可同时以可溶性和包涵体形式表达。尽管包涵体蛋白的表达量较高,但其空间结构的变化可能影响其抗原性,而可溶性表达蛋白能够保持与天然蛋白在结构和活性上基本一致。因此,本试验使用Ni-Charged Resin亲和层析柱仅对可溶性rIL-10蛋白进行纯化,凝胶成像系统软件分析其纯度约为97%,BCA蛋白测定试剂盒测得其浓度为0.9 mg·mL-1。结果表明,所制备的rIL-10纯化蛋白可用作抗体制备的免疫原和方法建立中的夹心抗原。
捕获抗体与检测抗体的选择及其质量直接影响双抗体夹心ELISA检测方法的特异性与灵敏度。多数学者倾向于使用相较于多克隆抗体有更好的特异性与均一性的鼠源单克隆抗体作为捕获抗体,兔源多克隆抗体作为检测抗体[20]。但是,多克隆抗体制备简便、成本低廉、与固相载体的结合能力强,有文献报道[21]鼠源抗体IgG重链可变区的氨基酸数目比兔源抗体多,有利于结合更多的抗原表位,使鼠源多克隆抗体结合抗原的特异性更强。已有学者利用兔源及鼠源二种多克隆抗体成功建立了双抗体夹心ELISA方法[22-25]。因此,本研究选用鼠抗rIL-10纯化多克隆抗体为捕获抗体,酶标兔抗rIL-10多克隆抗体为检测抗体,以提高双抗体夹心ELISA检测方法的特异性。
本研究采用方阵滴定法确定了捕获和检测抗体的最佳工作浓度,并优化了封闭液种类与封闭条件,最终建立了检测IL-10的双抗体夹心ELISA方法。进一步对所建方法进行性能评估,结果显示该方法的最低检测限量为24.29 ng·mL-1,与草鱼其他细胞因子以及小鼠IL-10、小鼠干扰素和鼠单核细胞趋化因子等均无交叉反应,板内及板间重复试验的变异系数均小于10%。结果表明本研究所建立方法的特异性强、重复性好且灵敏度较好。此外,该方法能在5~6 h完成检测且对仪器要求不高,解决了采用荧光定量PCR检测方法带来的操作繁琐,耗时费力,易受操作条件影响等问题,从而为监测或检测草鱼体内IL-10水平提供了快速有效的方法。
[1] MOORE K W, DE WAAL MALEFYT R, COFFMAN R L, et al. Interleukin-10 and the interleukin-10 receptor[J]. Annu Rev Immunol, 2001, 19(1): 683-765.
[2] SARAIVA M, O'GARRA A. The regulation of IL-10 production by immune cells[J]. Nat Rev Immunol, 2010, 10(3): 170-181.
[3] 周文超, 黄生耀, 李薇,等. 移植患者CD4+CD25+ CD127low调节性T细胞、TGF-β1 及IL-10的表达[J]. 国际检验医学杂志, 2020, 41(2): 221-223.
[4] CONTI P, KEMPURAJ D, KANDERE K, et al. IL-10, an inflammatory/inhibitory cytokine, but not always[J]. Immunol Lett, 2003, 86(2): 123-129.
[5] COUPER K N, BLOUNT D G, RILEY E M. IL-10: the master regulator of immunity to infection[J]. J Immunol, 2008, 180(9): 5771-5777.
[6] 万小颖, 李挺, 秦立志, 等. 白细胞介素-10研究进展[J]. 畜牧与兽医, 2013, 45(3): 94-98.
[7] MANNINO M H, ZHU Z, XIAO H, et al. The paradoxical role of IL-10 in immunity and cancer[J]. Cancer Lett, 2015, 367(2): 103-107.
[8] 徐顺清, 刘衡川. 免疫学检验[M]. 2版. 北京: 人民卫生出版社, 2015.
[9] LEQUIN R M. Enzyme immunoassay (EIA)/enzyme- linked immunosorbent assay (ELISA)[J]. Clin Chem, 2005, 51(12): 2415-2418.
[10] ZOU J, CLARK M S, SECOMBES C J. Characterisation, expression and promoter analysis of an interleukin 10 homologue in the puffer fish, Fugu rubripes[J]. Immunogenetics, 2003, 55(5): 325-335.
[11] SAVAN R, IGAWA D, SAKAI M. Cloning, characterization and expression analysis of interleukin-10 from the common carp, Cyprinus carpio L[J]. Eur J Biochem, 2003, 270(23): 4647-4654.
[12] INOUE Y, KAMOTA S, ITO K, et al. Molecular cloning and expression analysis of rainbow trout () interleukin-10 cDNAs[J]. Fish Shellfish Immunol, 2005, 18(4): 335-344.
[13] ZHANG D C, SHAO Y Q, HUANG Y Q, et al. Cloning, characterization and expression analysis of interleukin-10 from the zebrafish ()[J]. J Biochem Mol Biol, 2005, 38(5): 571-576.
[14] WEI H, YANG M, ZHAO T, et al. Functional expression and characterization of grass carp IL-10: an essential mediator of TGF-β1 immune regulation in peripheral blood lymphocytes[J]. Mol Immunol, 2013, 53(4): 313-320.
[15] NAM B H, MOON J Y, PARK E H, et al. Conserved gene structure and function of Interleukin-10 in teleost fish[J]. J Animal Vet Adv , 2014, 13(12): 774-782.
[16] PAVLIUCHENKO N, HAZARNIAN V, BASSIL M. Modification of periodate oxidation method to produce HRP-IgG conjugate and test its stability overtime[J]. Am J Mol Biol , 2019, 9(2): 52-63.
[17] 陶会竹, 肖宁, 赵雨婷, 等. 草鱼肠巨噬细胞的分离培养与鉴定[J].水产学报,2018,42(10):1606-1614.
[18] 李艳婷,侯喜林.牛呼吸道合胞体病毒双抗体夹心ELISA检测方法的建立[J]. 中国人兽共患病学报, 2017, 33(7): 628-636.
[19] 王方,张泽财,袁悦,等.伪狂犬病病毒gB蛋白单抗的制备及其夹心ELISA检测方法的建立[J].中国兽医学报, 2020, 40(2): 225-230.
[20] GAO Y, HUANG X, ZHU Y, et al. A brief review of monoclonal antibody technology and its representative applications in immunoassays[J]. J Immunoassay Immunochem, 2018, 39(4): 351-364.
[21] 黄名英, 傅安静, 田润. 鼠源和兔源多克隆抗体的比较试验[J]. 黑龙江畜牧兽医, 2017, 519(2): 175-177.
[22] 李卫,彭俊平,谷长勤,等.鸡白细胞介素-6原核表达及双抗夹心ELISA方法的建立[J]. 中国兽医学报, 2011, 31(11): 1614-1618.
[23] 邓桂花, 张雯佳, 梁少聪, 等. 人内皮唾液酸蛋白改良双抗体夹心ELISA检测方法的建立[J]. 现代免疫学, 2017, 37(2): 41-46.
[24] 刘传志,牛莹莹,陈元安, 等. 小鼠17β-hsd10的克隆、表达及双抗夹心ELISA方法的建立[J]. 生物工程学报, 2014, 30(11):1774-1780.
[25] 张伟, 程蓓蓓, 陈舜, 等. 基于鹅T细胞表面CD4分子胞外区的双抗体夹心ELISA检测方法的建立[J]. 中国预防兽医学报, 2016, 38(9):729-733.
Cloning and expression ofinterleukin-10 (IL-10) gene and establishment of double antibody sandwich ELISA for detection ofIL-10
HU Zhongjun, ZHOU Hao, LVU Lili, LI Jinnian
(School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036)
To establish a double-antibody sandwich ELISA method for the detection ofinterleukin 10 (IL-10). Firstly,IL-10 gene was cloned, the prokaryotic expression recombinant plasmid pET-32a-IL-10 was constructed and expressed in the study, and the recombinantIL-10 (rIL-10) protein was purified to obtain the purified protein. Subsequently, rabbit anti-rIL-10 polyclonal antibody and mouse anti-rIL-10 polyclonal antibody were prepared using the purified rIL-10 protein as an immunogen purified and labeled with enzyme. Finally, double-antibody sandwich ELISA (DAS-ELISA) was used, in which the purified mouse anti-rIL-10 antibodies, the purified rIL-10 protein and the HRP-labeled rabbit anti-IL-10 purified antibodies were used as capture antibodies. The sandwich developed the antigen and detected the antibody by optimizing the reaction conditions. The results showed that the optimal reaction conditions of the developed method included coating with the capture antibodies at the concentration of 20 μg·mL-1, probing with the HRP-labeled rabbit anti-IL-10 antibodies at the proportion of 1∶3 200, sealed with 5% degreasing milk powder at 37 °C for 1.5 hours, 2 hours of reaction time, and judging with450value≥0.174 as a positive criterion. The coefficient of variation of repeatability within and between plates was all less than 10%, in the developed method minimum detection limit was 24.29 ng·mL-1. In addition, the established DAS-ELISA could detectIL-10specifically, no cross-reaction with other cytokines including grass carp interleukin-6, grass carp tumor necrosis factor, mouse interleukin-10, mouse interferon, or mouse monocyte chemoattractant protein. Our results indicated that the estab-lished double-antibody sandwich ELISA in this study possessed a better specificity, reproducibility and sensitivity, which might be used for the rapid detection ofIL-10.
interleukin 10; clone and expression; antibody preparation; double- antibody sandwich ELISA
S917; S965.112
A
1672-352X (2021)01-0073-06
10.13610/j.cnki.1672-352x.20210319.021
2021-3-24 9:43:10
[URL] https://kns.cnki.net/kcms/detail/34.1162.s.20210319.1548.042.html
2020-02-09
国家自然基金面上项目(31672698)资助。
胡忠俊,硕士研究生。E-mail:hzj19962020@163.com
李槿年,教授,博士生导师。E-mail:lijinnian2000@163.com
