水淹胁迫下的水竹根系生理响应与适应特征
2021-04-13傅松玲苏文会范少辉储昊煜倪惠菁
金 艺,李 旭,傅松玲,苏文会,范少辉,景 雄,储昊煜,倪惠菁
水淹胁迫下的水竹根系生理响应与适应特征
金 艺1, 2,李 旭1,傅松玲1*,苏文会2,范少辉2,景 雄2,储昊煜2,倪惠菁2
(1. 安徽农业大学林学与园林学院,合肥 230036;2. 国际竹藤中心,国家林业局竹藤科学与技术重点试验室,安徽太平竹林生态观测研究站,北京 100102)
水竹(Oliv.)是优良的笋材两用竹种,对其研究多围绕其丰产培育技术开展,关于水竹对水淹胁迫的适应特征与响应机制尚不清楚。为探究水淹胁迫下水竹的根系泌H+特征等生理响应及适应特征,通过人工模拟胁迫梯度,采用非损伤微测技术(NMT),测定水竹根系在全淹及半淹条件下的H+流速、抗氧化酶活性、内源激素含量以及非结构性碳水化物含量等变化规律。结果表明:水竹遭受水淹胁迫后根系所处环境的酸碱水平发生改变,根系泌H+现象明显,随胁迫时间延长,通过自身调节适应胁迫逐渐使得H+外排现象回落。水竹根系超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性整体随胁迫程度增强而上升。另外,根系的淀粉和可溶性糖含量随水淹胁迫时间延长逐渐下降,水淹胁迫短时间内影响了水竹体内非结构性碳水化合物的含量,但含量仍在正常范围之内。综上,水竹遭受水淹胁迫后根系所处环境的酸碱水平发生改变,短时间内影响了水竹体内碳水化合物的含量,显著提高了根系抗氧化能力以清除活性氧(ROS);通过内源激素的协同作用,抑制自身生长以适应淹水环境。
水竹;水淹胁迫;根部H+流速;抗氧化能力;内源激素;非结构性碳水化合物
自然界中水本身对植物无害,但淹水所引起的次生胁迫使得植物根系处于缺氧状态,进而引起无氧呼吸导致植物体内产生乙醇、乙醛等有毒物质的累积。水淹胁迫作为一种常见的非生物因子胁迫之一,对植物的形态学、生理生化特性等方面会产生一定影响[1]。耐涝植物可通过自身的生理生化调节机制消除有害影响,适应湿水(水淹)环境。在水淹胁迫响应过程中,离子、多元醇、多胺、碳水化合物、氨基酸、蛋白质等物质均参与胁迫的信号转导保护其细胞、大分子物质,使植物减轻或免受水分胁迫导致的消极影响。我国是持续性暴雨及洪涝灾害频发的国家,特别是受东亚夏季风和青藏高原影响的长江流域,大量的林地极易遭受水淹胁迫,对我国林业生态建设产生了不利影响[2]。植物遭受外界胁迫时体内产生大量活性氧(Reactive oxygen species, ROS)。作为一类氧的单电子还原产物,活性氧包括氧的一电子还原产物超氧阴离子(·O2-)、二电子还原产物过氧化氢(H2O2)、三电子还原产物羟基自由基(·OH)和单线态氧(1O2)。高浓度ROS具有很强的氧化能力,能引起质膜的过氧化,累积丙二醛(Malondialdehyde, MDA)等多种有害过氧化产物,造成一系列生理生化紊乱,严重时则影响植物正常生长发育。植物体自身的抗氧化酶防御系统会对ROS及时进行清除以维护自身正常生长[3]。在长期的进化过程中,一些植物能够通过自身代谢途径、抗氧化酶系统以及激素含量水平的调节来抵御短期或较长期的水淹生境得以存活[4]。这些抗氧化酶系统包括:超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)和过氧化物酶(Peroxidase, POD)等。此外,逆境下参与调控植物生理机制的还包括内源激素,如脱落酸(Abscisic acid, ABA)、赤霉素(Gibberellin, GA)和生长素(Auxin, IAA)[5]。研究发现,适当水分胁迫会增加水稻(L.)抗氧化酶活性[6],随着水淹胁迫程度的增加,桑苗()叶片中抗氧化酶活性会显著上升[7],而虎尾草()的POD和CAT活性逐渐上升,SOD活性先升后降[8]。韩乃鹏[9]研究发现,耐受性较强的植物在遭受水淹胁迫时,SOD、POD和CAT活性短时间内会增强,随着胁迫时长的增加,酶活性会逐步减弱。同时,在水淹胁迫下,植物可调节GA和ABA生物合成以提高植物逆境胁迫耐受性[5, 10]。3种美洲黑杨无性系在涝渍缺氧条件下其叶片ABA和茎部乙烯含量显著提高,促进不定根的形成[11]。水淹胁迫下不同无性系杂交鹅掌楸ABA含量表现为先升后降再升,GA含量明显下降,且抗性强的变化幅度小。IAA含量则表现为先降后升再降趋势,抗性强的变化幅度大[12]。水淹胁迫深度及胁迫时间显著影响着耐水淹植物野古草()和秋华柳()非结构性碳水化合物(Non-structural carbohydrate, NSC)含量及生物量的积累,胁迫程度的增加会导致植株可溶性糖和淀粉等NSC含量下降速度加快,直至淹水后期NSC储备近乎消耗殆尽,植株死亡[13]。植物在生长过程中,其根系不仅从周围环境中摄取物质,同时也会向生长介质中分泌质子,释放无机离子等根系分泌物,植物根系细胞将CO2、C2H2、HCO3-、H+、氨基酸等低分子量化合物主动或被动释放到周围根际环境中,根系分泌物吸收和释放的动态变化是植物响应环境胁迫最直接明显的反应[14]。水竹(Oliv.)隶属禾本科刚竹属,是优良的笋材两用竹种,产于黄河流域及其以南[15]。从水竹适生区看,该竹种在河沟两岸甚至长期水淹的洼地均长势良好,能较好地耐水淹胁迫。近年来,水竹的相关研究多围绕其丰产培育技术开展,主要集中在栽培管理技术[16]、造林经营技术[17]和设施栽培[18]等方面,而关于水竹对水淹胁迫的适应特征与响应机制尚不清楚,例如水竹作为适应性强、耐水淹竹种,水淹胁迫环境下根系周围酸碱水平如何变化?水竹体内抗氧化酶系统如何协调运转?如何调配内源激素的分泌?碳水化合物的分配作何反应?鉴于此,本文通过模拟淹水环境,探究不同淹水处理(根系半淹、全淹)下水竹的适应性及生理响应特征,明确其在水淹胁迫下的生理生化适应机制,以期揭示水竹抗水湿规律,为拓展其湿地生态利用提供数据支撑。
1 材料与方法
1.1 研究区概况
验材料取自安徽省黄山市黄山区西北部(30°21’N,118°01’E)太平湖边天然水竹林。该地位于亚热带季风气候区,四季分明,雨量充足,土壤肥沃,小气候特点显著。年平均气温15.4 ℃,年平均降水量1 000 mm以上,年平均无霜期225 d,年平均日照时数1 752.7 h。每年4月底至5月初太平湖水位上涨,届时湖水淹至水竹植株地上部位0.5 ~ 0.8 m处,水淹时长15 d左右。
1.2 试验设计与样品采集处理
2018年10月,于太平湖天然水竹林随机带蔸(平均高约20 cm、直径约25 cm)挖取60棵生长状况一致的健康无虫害一年生(2017—2018)水竹植株(平均胸径1.67 cm,平均株高225.10 cm) 作为试验材料,挖出当下立刻移栽于高30 cm、直径45 cm的移栽盆中,将其根部完全置于移栽盆,覆营养土浇水(盆底预铺5 cm厚营养土,放入竹蔸后填满)。将盆栽苗带回,统一放置于试验大棚中浇水养护至2019年7月。试验设置两个水淹梯度,处理组T1、T2和一个空白对照组CK。处理组Ⅰ为根部半淹,即清水淹至移栽盆50%处(T1);处理组Ⅱ为根部全淹,即将移栽盆100%淹没于清水中(T2);保持正常浇水养护为空白对照组(CK)。共3个处理组,每组20棵水竹植株。2019年7月初将水竹盆栽植株进行水淹处理,按时间梯度分别处理3、6、9、12及15 d,在不同时间梯度处理下于各处理组中随机取3盆水竹植株进行根系采样。取成熟健康鲜根样品,从植株上分离后立即对样品进行速冻处理(按处理组存放入预先盛满冰袋的泡沫箱),随即置于–20 ℃冰箱保存,用于相关生理指标的测定。
1.3 水竹根系生理指标测定
利用非损伤微测技术NMT (Non-invasive micro-test technology,美国扬格公司Younger USA LLC, Amherst, MA 01002, USA,旭月公司Xuyue (Beijing) Sci. &Tech. Co., Ltd., Beijing, China)检测水淹胁迫下水竹盆栽苗一级侧根、二级侧根成熟区H+流速变化(图1)。该试验中对水竹盆栽苗根部进行统一的全水淹处理,设置3个时间梯度:24、48和72 h,另设置一个空白对照(Normal watering, NW)。采样时对各处理时间梯度下的试验苗根部,用蒸馏水冲洗干净,分别选取无破损且外观一致的根,使用滤纸条和树脂块,将一条根部固定在培养皿底部,露出检测区域。向培养皿中加入测试液(0.5 KCl,0.1 CaCl2,0.5 MES,pH 6.0),浸没根部,静置30 min,再弃去测试液,加入5~10 mL新鲜测试液,上样检测。在显微镜下找到成熟区上的1个待测位点,将H+流速传感器置于距根表面检测位点30 μm处,开始检测,每个位点检测5 min,每组检测6个重复。操作imFluxes V 2.0软件(旭月公司Xuyue (Beijing) Sci. &Tech. Co., Ltd., Beijing, China) 直接读取并输出H+流速数据,流速单位为pmol·cm-2·s-1,其正值代表外排,负值代表吸收。超氧化物歧化酶活性采用氮蓝四唑(NBT)光化还原法测定[19];过氧化氢酶活性采用过氧化氢分解法测定[19];过氧化物酶活性采用愈创木酚法测定[19];丙二醛含量采用硫代巴比妥酸(TBA)法测定[20];赤霉素、脱落酸和生长素含量采用酶联免疫吸附分析法(ELISA, Shanghai Enzyme-linked Biotechnology Co., Ltd., Shanghai, China)测定[21]。淀粉及可溶性糖采用蒽酮比色法测定[22]:在提取液中加入盐酸,105 ℃消煮120 min,活性碳脱色,过滤,滤液加入蒽酮,沸水浴12 min,测定吸光度。

图1 非损伤微测技术检测根系成熟区H+流速实测图
Figure 1 Measurement chart of H+flux in maturation zone of root system by non-invasive micro-tests
1.4 数据分析
文中所有数据均运用WPS Office 2019和SPSS 20.0统计软件进行分析,图表均采用R studio 3.6.3和Sigmaplot 12.5软件完成。采用LSD多重比较分析不同处理梯度各参数的显著性差异,显著性水平设定为= 0.05。采用双因素方差(Two-way ANOVA)分析时间、处理及其相互作用对植物生理性状的影响(SOD、CAT、POD、MDA、ABA、GA、IAA、可溶性糖和淀粉)。采用R studio 3.6.3进行PCA主成分分析。
2 结果与分析
2.1 水淹胁迫对水竹根系H+流速特征的影响
水竹根系在遭遇水淹胁迫后,其根系的一级侧根及二级侧根均表现出泌H+趋势,二级侧根对淹水的泌H+响应较一级侧根更为敏感。随着水淹时间的增加,根系泌H+能力呈现先增强后减弱的趋势(图2)。不同水淹时间处理下的水竹一级侧根H+净流速均表现为外排,二级侧根H+净流速均表现为吸收状态。其中,一级侧根淹水处理24 h时的H+外排现象最明显;二级侧根在受到水淹胁迫后,H+净流速下的吸收水平显著低于对照组(< 0.05),此后随着水淹胁迫时间的延长,H+流速变化不显著。分析认为,水竹的H+流速变化体现了淹水下水竹对低氧胁迫的自适应过程,根系受水淹胁迫进行无氧呼吸致使泌H+现象加剧,改变了根系所处的酸碱环境。

图2 水淹胁迫下不同胁迫时长水竹根系(一级根、二级根)H+流速
Figure 2 Comparison of root (the first-order lateral root and the second-order lateral root) hydrogen ion flux (secretion capacity) ofOliv. under different flooding time
2.2 水淹胁迫对水竹根系抗氧化能力的影响
双因素方差分析表明,胁迫强度和胁迫时长对水竹根系SOD、CAT和POD酶活性影响显著(< 0.01),胁迫强度和胁迫时长交互水竹根系SOD酶活性影响显著(< 0.01),胁迫时长对水竹根系丙二醛(MDA)含量影响显著(< 0.01)(表1)。半水淹T1和全水淹T2两种淹水模式处理下不同淹水时长的水竹根系抗氧化酶活性及膜脂过氧化产物MDA含量的变化情况结果(图3)表明,淹水后的水竹根系SOD、CAT和POD酶活性均显著高于未淹水的空白对照组(< 0.05)。随着淹水时长的增加,水竹根的抗氧化酶活性增强,且全淹组较半淹组的抗氧化酶活性强。在不同淹水处理下,水竹根系中MDA含量较CK组并无显著性差异(> 0.05)。
2.3 水淹胁迫下水竹根系内源激素含量的变化
双因素方差分析表明,胁迫强度和胁迫时长及其交互作用对水竹根系ABA、GA和IAA含量影响极显著(< 0.001,< 0.01) (表1)。随着胁迫时间的增加,半水淹(T1)和全水淹(T2)两种水淹强度下,水竹根系ABA含量均呈现上升趋势,且在第15天处理下的ABA含量达到峰值,水淹胁迫组 (T1和T2) 的水竹根系ABA含量显著高于其对照组(CK)(< 0.05)(图4)。随着淹水处理时间的增加,水竹根系GA和IAA含量均呈下降趋势。除第9天淹水处理外,其余各处理时间梯度下,胁迫组水竹根系的GA和IAA含量均显著低于对照组,且根系在全水淹处理下GA和IAA含量均显著低于半水淹处理含量(< 0.05)。不同淹水模式处理下水竹的SOD、CAT、POD、MDA、ABA、GA及IAA 7种生理指标的PCA分析结果(图5)显示,其根部的第一主成分方差贡献率为75.8%,第二主成分方差贡献率为10.9%,共贡献达86.7%,第一、第二主成分能够反映不同分组间7个生理指标的差异。且各生理指标间存在显著相关性,IAA、GA与其他生理指标显著负相关,其余各生理指标间均呈现显著正相关性。

不同小写字母表示相同胁迫时长时不同胁迫强度间的差异显著性(P < 0.05)。下同。
Figure 3 Effects of different stress intensities and different stress duration to activities ofSOD(A), CAT(B), POD(C) and MDA(D) in the root system of
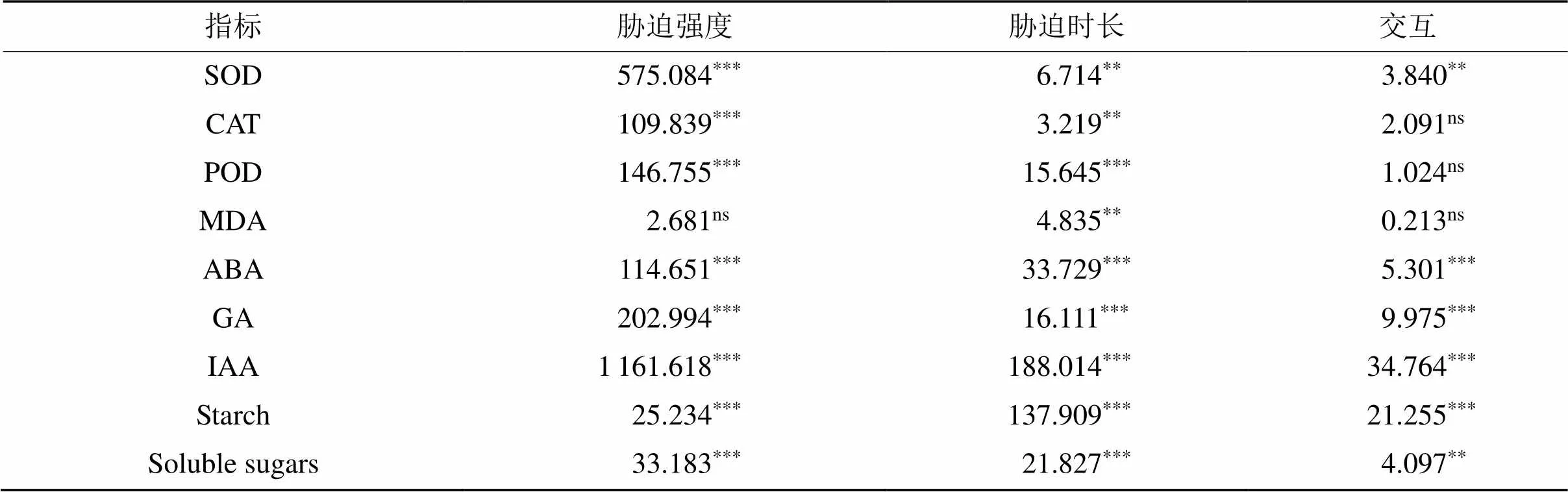
表1 胁迫强度与时长对水竹根系各生理指标的双因素方差分析
注:表中数值为值,***<0.001,**<0.01和*<0.05。
2.4 水淹胁迫对水竹叶根非结构性碳水化合物含量的影响
双因素方差分析表明,胁迫强度和胁迫时长及其交互作用对水竹根系可溶性糖和淀粉含量影响极显著(< 0.01) (表1)。不同时间淹水处理(T1、T2)下水竹根系中的可溶性糖和淀粉含量较CK组均有下降,且随着淹水处理时间的增加,水竹根系非结构性碳水化合物含量呈下降趋势(图6)。

图4 不同胁迫强度不同胁迫时长下水竹根系内源激素含量
Figure 4 Endogenous hormone contents in root system ofOliv. under different stress intensities and different stress duration

图5 不同水淹胁迫下水竹根系各生理指标的主成分分析
Figure 5 Principal component analysis of physiological indexes in roots and leaves ofOliv.

图6 不同时长水淹胁迫对水竹叶片及根系非结构性碳水化合物含量的影响
Figure 6 The effect of water flooding stress on the leafand root non-structural carbohydrate concentrations inOliv.
3 讨论与结论
在植物生长过程中,根系一方面从生长介质中摄取养分和水分;另一方面,也向生长介质中分泌质子(H+)等低分子量化合物,根系的酸碱(pH)可调控植物根系的生长,H+吸收和释放的动态变化是植物响应环境胁迫的直接生理反应[15, 23]。我们发现,水淹胁迫下水竹根系整体上对H+呈外排状态,随胁迫时间的延长,H+外排现象逐渐减弱。研究表明,水淹处理对水竹产生次生胁迫,根系进行无氧呼吸致使H+外排现象加剧,这改变了水竹根系所处环境的酸碱水平,随胁迫时间延长,水竹通过自身调节适应胁迫,逐渐使得H+外排现象回落,可见水竹对水淹胁迫具有较好的生理调控能力。抗氧化酶系统将胁迫过程中形成的过氧化物歧化为水和氧气等物质。植物在正常的生理活动中体内会产生活性氧,逆境胁迫下活性氧增加打破活性氧的平衡[24]。植物会通过抗氧化酶系统对产生的活性氧进行清除[25-26]以维持自身正常生长。正常情况下,植物体在受到逆境胁迫时,体内抗氧化酶活性会随活性氧的累积而显著升高[25-27]。庞欣等[28]在研究汞胁迫对小麦幼苗抗氧化酶活性的影响时发现小麦幼苗受到汞胁迫后根系SOD酶活性显著增加。张永峰等[29]发现随着混合盐碱处理浓度的增大,经处理的苗期紫花苜蓿叶片的SOD酶、CAT酶和POD酶活性均呈上升趋势。自由基作用于脂质发生过氧化反应产生丙二醛,毒害植物细胞。MDA含量可以反映植物遭受逆境伤害的程度。当植物长期处于逆境胁迫下,ROS的大量产生导致植物体内抗氧化酶系统对于活性氧的清除失衡时,MDA将会累积。李会云等[30]发现随土壤含盐量增加,MDA含量逐渐升高。本研究中水竹根系中的SOD、CAT和POD酶活性整体随胁迫程度增强而上升,说明水竹自身抗氧化酶系统对水淹胁迫造成的次生胁迫引起缺氧所产生的ROS产生了响应,为清除多余的超氧阴离子和过氧化氢,其自身保护酶活性显著增强。水竹根系MDA含量在各胁迫强度及时间节点下整体差异未达显著水平(> 0.05),因此在为时15 d的胁迫处理下未造成水竹体内活性氧清除失衡,也未引起水竹细胞大量的膜脂过氧化反应。从水竹根系ABA含量的变化情况可看出,水竹根系是通过提高根系ABA含量来应对淹水环境胁迫,以调节自身对胁迫环境的适应能力。在淹水环境中水竹通过调节GA和IAA激素含量减缓其自身生长速率,以缓解环境胁迫造成的相关生理响应以提高其抗逆性。此外,水淹胁迫显著影响了水竹根系ABA、GA和IAA含量水平,在淹水处理的15 d内,根系激素产生了应激性反应,胁迫环境下根系GA和IAA含量降低,ABA含量升高,水竹根系通过其自身内源激素含量调节来应对淹水环境所带来的不良生长影响。李迎春[31]在研究水淹胁迫对河竹()生理生化的影响时发现,其自身酶活性、激素水平和碳水化合物代谢等均存在明显的水位效应和时间效应,能在一定时间内有效运行自身抗氧化酶系统和调节激素水平以应对水淹胁迫。本研究发现,淹水环境下水竹同样能有效调控自身抗氧化酶系统(SOD、POD和CAT)以及激素水平(GA、IAA和ABA)作出了相应的抗逆生理响应,并且水竹具较强的合理范围内的碳水化合物的代谢水平,通过适应性生理保证了根系正常的生长和代谢,这对其能够在水淹环境下保持较好的生理状态,维持较长时间的正常生存具有重要意义。非结构性碳水化合物(NSC,主要组成是可溶性糖和淀粉),为植物生长和代谢提供底物,可被植物各器官储存[32]。植物器官中NSC含量影响植物对环境胁迫的响应,这个参数反映了C供应水平、植物生长、缓冲能力和适应策略[33-36]。环境胁迫会致使植物大量消耗细胞内NSC,胁迫程度的增加会导致植株可溶性糖和淀粉等碳水化合物下降速度加快,水淹后期NSC储备近乎消耗殆尽,死亡率增加[13]。有些植物全淹环境下根系可溶性糖和淀粉含量显著降低,胁迫解除后含量又会明显升高[37]。可溶性蛋白作为渗透调节物质能在逆境胁迫下保护细胞膜系统免遭破坏。本研究在历时15 d短时间水淹胁迫下,水竹根系的可溶性蛋白含量上升,淀粉和可溶性糖含量随时间延长逐渐下降,淹水胁迫短时间内影响了水竹体内营养物质和碳水化合物等渗透调节物质的含量,水竹通过渗透调节物质含量的变化对周围环境的改变作出应答。水竹在水淹胁迫环境下表现出了良好的自我调控能力,各组水竹在水淹胁迫试验结束时仍保持良好的生长,此结果为将水竹作为河湖湿地生态环境修复材料提供了理论基础。随着全球气候的日益恶化,极端天气频发[38],使得减轻生态系统负荷压力、依靠生态系统的自我调节能力与自组织能力使其向有序的方向进行演化显得尤为重要。未来湿地生态系统修复、植物种类筛选仍是值得探究的课题,进一步了解水竹对水环境有害物质的净化能力和作用机制仍是值得研究的方向。然而,本研究只讨论了水竹淹水适应性的生理响应规律,任何生理层面上的调控机制都是通过相关基因水平上调或下调而引起的,因此,从分子水平揭示水竹的水淹胁迫适应性的分子机制,为培育具有耐水淹能力强的竹子种类和生态型更是值得进一步研究的课题。
[1] 谢雯颖. 土壤水分胁迫对植物生理生态影响的研究进展[J]. 科教导刊(电子版), 2015(36): 188.
[2] 黄荣辉, 陈栋, 刘永. 中国长江流域洪涝灾害和持续性暴雨的发生特征及成因[J]. 成都信息工程学院学报, 2012, 27(1): 1-19.
[3] 李璇, 岳红, 王升, 等. 影响植物抗氧化酶活性的因素及其研究热点和现状[J]. 中国中药杂志, 2013, 38(7): 973-978
[4] 谭淑端, 朱明勇, 张克荣, 等. 植物对水淹胁迫的响应与适应[J]. 生态学杂志, 2009, 28(9): 1871-1877.
[5] 潘瑞炽. 植物生理学[M]. 7版. 北京: 高等教育出版社, 2012.
[6] 黄万勇, 卢成, 郑世宗, 等. 淹水胁迫对水稻植株抗氧化酶变化的影响[J]. 排灌机械工程学报, 2017, 35(11): 1008-1012.
[7] 崔雪, 饶良懿, 周其令. 水淹胁迫下饲料桑苗()叶片形态及部分酶活性的变化[J]. 生态学杂志, 2018, 37(12): 3633-3639.
[8] 夏斌, 刘莹, 胡尚春, 等. 水淹胁迫对虎尾草生理指标的影响[J]. 东北林业大学学报, 2019, 47(7): 31-36.
[9] 韩乃鹏. 水淹胁迫对乐安河河岸带植物群落的分布、生理和生长状况的影响[D]. 南昌: 江西师范大学, 2017.
[10] 牛亚利, 赵芊, 张肖晗, 等. 赤霉素信号在非生物胁迫中的作用及其调控机制研究进展[J]. 生物技术通报, 2015, 31(10): 31-37.
[11] 徐锡增, 唐罗忠, 程淑婉. 涝渍胁迫下杨树内源激素及其它生理反应[J]. 南京林业大学学报, 1999, 23(1): 3-5.
[12] 潘向艳. 杂交鹅掌楸不同无性系对淹水胁迫的反应[D]. 南京: 南京林业大学, 2006.
[13] 叶小齐, 曾波. 三峡库区两种耐水淹植物的存活率和碳水化合物储备关系[J]. 水生生物学报, 2013, 37(3): 450-457.
[14] 张福锁. 根分泌物及其在植物营养中的作用(综述) [J]. 北京农业大学学报, 1992, 18(4): 353-356.
[15] 易同培, 史军义, 马丽莎. 中国竹类图志[M]. 北京: 科学出版社, 2008.
[16] 刘迪钦, 马宗艳. 水竹特性与栽培管理[J]. 湖南林业科技, 2005, 32(3): 64-65.
[17] 楼枝春, 王彩娥, 潘世民, 等. 水竹笋用林经营技术[J]. 林业科技开发, 2002, 16(1): 52.
[18] 严彦, 苏文会, 王玮, 等. 设施栽培水竹出笋及幼竹高生长规律研究[J]. 中国农学通报, 2013, 29(1): 42-46.
[19] 陈建勋, 王晓峰. 植物生理学实验指导[M]. 2版. 广州: 华南理工大学出版社, 2006.
[20] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[21] SERGEEVA E, LIAIMER A, BERGMAN B. Evidence for production of the phytohormone indole-3-acetic acid by cyanobacteria[J]. Planta, 2002, 215(2): 229-238.
[22] 邹琦. 植物生理生化实验指导[M]. 北京: 中国农业出版社, 2003.
[23] 王玉书, 刘海, 袁玲. 空心莲子草根系分泌物对无机磷细菌的负化感效应[J]. 土壤学报, 2017, 54(6): 1486-1496.
[24] 牛亚利, 赵芊, 张肖晗, 等. 赤霉素信号在非生物胁迫中的作用及其调控机制研究进展[J]. 生物技术通报, 2015(10): 31-37.
[25] 李璇, 岳红, 王升, 等. 影响植物抗氧化酶活性的因素及其研究热点和现状[J]. 中国中药杂志, 2013, 38(7): 973-978
[26] FOYER C H, DESCOURVIÈRES P, KUNERT K J. Protection against oxygen radicals: an important defence mechanism studied in transgenic plants[J]. Plant Cell Environ, 1994, 17(5): 507-523.
[27] 王芳, 孙周平, 刘义玲. 缺氧及氧恢复对马铃薯块茎线粒体中活性氧及抗氧化酶的影响[J]. 植物生理学报, 2014, 50(3): 283-289.
[28] 庞欣, 王东红, 彭安. 汞胁迫对小麦幼苗抗氧化酶活性的影响[J]. 环境化学, 2001, 20(4): 351-355.
[29] 张永峰, 殷波. 混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J]. 草业学报, 2009, 18(1): 46-50.
[30] 李会云, 郭修武. 盐胁迫对葡萄砧木叶片保护酶活性和丙二醛含量的影响[J]. 果树学报, 2008, 25(2): 240-243.
[31] 李迎春. 河竹对淹水环境的生理生态响应特征[D]. 北京: 中国林业科学研究院, 2017.
[32] AI Z M, HE L R, XIN Q, et al. Slope aspect affects the non-structural carbohydrates and C: N: P stoichiometry ofon the Loess Plateau in China[J]. CATENA, 2017, 152: 9-17.
[33] MILLARD P, SOMMERKORN M, GRELET G A. Environmental change and carbon limitation in trees: a biochemical, ecophysiological and ecosystem appraisal[J]. New Phytol, 2007, 175(1): 11-28.
[34] POORTER L, KITAJIMA K. Carbohydrate storage and light requirements of tropical moist and dry forest tree species[J]. Ecology, 2007, 88(4): 1000-1011.
[35] KOZLOWSKI T T. Carbohydrate sources and sinks in woody plants[J]. Bot Rev, 1992, 58(2): 107-222.
[36] MYERS J A, KITAJIMA K. Carbohydrate storage enhances seedling shade and stress tolerance in a neotropical forest[J]. J Ecol, 2007, 95(2): 383-395.
[37] 秦洪文, 刘正学, 钟彦, 等. 水淹对濒危植物疏花水柏枝生长及恢复生长的影响[J]. 中国农学通报, 2014, 30(23): 284-288.
[38] IPCC. Climate Change 2018: Special report on global warming of 1.5 ℃[R]. Cambridge: Cambridge University Press, 2018.
Physiological response and adaptive characteristics ofOliv. roots under waterlogging stress
JIN Yi1, 2, LI Xu1, FU Songling1, SU Wenhui2, FAN Shaohui2, JING Xiong2, CHU Haoyu2, NI Huijing2
(1. School of Forestry and Landscape Architecture, Anhui Agricultural University, Hefei 230036; 2. Anhui Taiping Bamboo Forest Ecosystem Observation Station, Key Laboratory of Science and Technology of Bamboo and Rattan of State Forestry Administration, International Bamboo and Rattan Center, Beijing 100102)
Oliv. is an excellent dual-purpose bamboo species, and researches are mostly carried out on its high-yield cultivation technology. The adaptation characteristics and response mechanism ofOliv. to flooding stress still keep unclear. In this study, to explore the physiological response and adaptation characteristics of the root secretion H+ofOliv. under water stress, we artificially simulated the stress gradient and used non-damage micro-measurement technology (NMT) to determine the H+flow rate, antioxidant enzyme activity, endogenous hormone concentrations and non-structural carbohydrate concentrations in theOliv root system under full and semi-submerged conditions. The results showed that the acid and alkali levels in the root system changed afterOliv. was subjected to flooding stress. The root system secreted H+obviously, and the self-regulated adaptation stress gradually made H+efflux decline with the extension of stress time. The activities of superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD) in the roots of theOliv. increased as the stress level increased. In addition, the starch and soluble sugar concentrations in the root system gradually decreased with the extension of the flooding stress time. The short-term flooding stress affected the concentrations of non-structural carbohydrates in theOliv., but the concentrations were still within the normal range. To sum up, the acid and alkali levels of the environment in the root system of the water bamboo changed after being flooded, which affected the carbohydrate content of theOliv. in a short period of time and significantly improved the antioxidant capacity of the root system to remove reactive oxygen species (ROS); the synergistic effect of endogenous hormones inhibited its own growth to adapt to the flooded environment.
Oliv.; waterlogging stress; root H+flux; antioxidant capacity; endogenous hormones; non-structural carbohydrate
S795
A
1672-352X (2021)01-0001-08
10.13610/j.cnki.1672-352x.20210319.023
2021-3-23 12:11:40
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210319.1548.046.html
2020-05-12
国家科技支撑计划课题(2015BAD04B02)资助。
金 艺,硕士研究生。E-mail:jinyi209@yeah.net
傅松玲,教授,博士生导师。E-mail:fusongling@ahau.edu.cn
