初情期山羊胸腺microRNAs的筛选
2021-04-13姚郅璆李海玲康铁柱司文宇张兴旺方富贵
姚郅璆,李海玲,康铁柱,司文宇,叶 菁,张兴旺,方富贵
初情期山羊胸腺microRNAs的筛选
姚郅璆,李海玲,康铁柱,司文宇,叶 菁,张兴旺,方富贵*
(安徽农业大学动物科技学院,合肥 230036)
为分析初情期前和初情期雌性山羊胸腺中MicroRNA 的差异表达情况,并探讨其在山羊初情期启动过程中所起的作用。对初情期前(n = 3)和初情期(n = 3)山羊的胸腺组织进行了 Solexa 测序,采用 GO 富集和 KEGG 分析评估差异 miRNA 靶基因。在初情期前和初情期的山羊胸腺组织中检测到 538 个 miRNA,其中64 个 miRNA 显著差异表达。与初情期前的山羊胸腺样本相比,初情期胸腺样本中存在 19 个上调基因和 45 个下调基因。KEGG 通路富集分析显示,差异 miRNA 靶基因主要富集在苯丙氨酸,酪氨酸和色氨酸的生物合成,丁螺菌素和新霉素的生物合成等通路以及胆碱能突触和过氧化物酶体增殖物激活受体(PPAR)等与初情期启动相关信号途径。结果提示胸腺中 miRNA 参与山羊初情期启动。
山羊;MicroRNA;初情期;胸腺
MicroRNA(miRNA)是一种长约21~24 nt的非编码RNA,可调控基因转录后翻译的过程。miRNA最初由RNA聚合酶转录为细胞核中的初级miRNA(pri-miRNA)[1]。随后miRNA前体输出到细胞质中,成为成熟的22 nt双链体。成熟的miRNA进入到RNA诱导的沉默复合物中,并通过3'-非翻译区(untranslated region,UTR)结合靶基因[2]。成熟的miRNA在调节细胞功能和分化中起重要作用。
胸腺是重要的免疫器官,参与调节下丘脑-垂体-卵巢轴。研究表明,小鼠幼儿期胸腺切除会导致成年小鼠卵巢发育不全,并引起初情期启动的延迟,以及性类固醇浓度降低和黄体缺失[3]。这些变化与自身免疫性卵巢发育不良相关的免疫活性无关[4]。胸腺肽作为胸腺分泌的一种生物活性分子也影响着生殖功能。胸腺肽注射入下丘脑内侧核引起排卵并降低了全部卵泡中闭锁卵泡的百分比,可能是由于下丘脑内侧促性腺激素释放激素(gonadotropin- releasing hormone,GnRH)释放引起的。脑室内注射胸腺素β4增加了血清中黄体生成素(luteinizing hormone,LH)的水平。在大鼠垂体培养物中胸腺素的添加也刺激LH的释放[5-7]。
初情期是雌性动物发育的重要阶段,标志着首次排卵的发生和生殖能力的开始[8]。影响初情期启动的因素很多,包括遗传因素,神经内分泌因素,环境因素等。随着初情期相关研究的深入,已经确定了影响GnRH产生和释放的几个关键因素,但调控初情期启动过程的具体机制仍未明确。最近的研究表明,初情期的启动受miRNA的调控。在小鼠GnRH神经元中选择性敲除Dicer(没有miRNA生物合成),实验鼠表现出严重的中枢性腺功能减退症[9]。在幼儿期,GnRH神经元中miR-200和miR-155的表达水平升高,通过抑制GnRH的抑制信号增加了GnRH表达[10]。大鼠下丘脑中let-7a和let-7b miRNA的表达在初情期达到最高,并且在初情期延迟/缺失的动物模型中,Lin28 / let-7比率显著增加。在出生后的下丘脑中也检测到miR-132和miR-145表达增加[11]。这些研究表明,miRNA在哺乳动物初情期启动中起着重要作用。然而,miRNA在初情期山羊胸腺中的表达模式仍然未知。因此,通过Solexa测序技术在初情期前和初情期山羊胸腺组织中检测miRNA的表达水平,探讨miRNA在初情期和初情期前山羊胸腺组织的表达差异及其可能参与的生物学过程。
1 材料与方法
1.1 试验材料
本研究使用3只年龄为2.5~3.0个月,体重为(9.9±0.39)kg的健康初情期前安怀雌山羊和3只年龄为4.5~5.0个月,体重为(18.9±0.43)kg的初情期山羊。通过阴道和卵巢生理变化以及公羊试情方法确定初情期。屠宰取胸腺,在液氮下快速冷冻,并保存在–80 ℃环境中。
1.2 总RNA提取及质量检测
使用TRIzol试剂盒(Invitrogen,CA,USA)提取胸腺总RNA,操作严格按照说明书进行。该研究得到安徽农业大学动物保护和使用委员会的认可。
使用1%琼脂糖凝胶检测RNA降解和污染情况。 RNA显示3个条带,分别为28、18 和5 s。使用NanoPhotometer分光光度(IMPLEN, CA, USA)和Qubit®Quat®RNA分析试剂盒测量RNA的纯度和浓度。使用Agilent Bioanalyzer 2100系统(Agilent Technologies,CA,USA)的RNA Nano 6000分析试剂盒确定RNA完整性。
1.3 Illumina Solexa 测序
1.3.1 Small RNA测序文库构建 按照Illumina公司提供的标准步骤生成测序文库。主要步骤为:将NEB 3'接头和5'末端接头分别连接到miRNA,小干扰RNA和Piwi互作RNA的3'末端和5'末端。然后进行反转录并PCR扩增合成为cDNA。随后,使用8%聚丙烯酰胺凝胶(100 V,80 min)对140~160 bp的PCR产物切胶回收,纯化后用于后续序列测定。
1.3.2 测序数据质控 根据制造商的说明,将文库制备物在Illumina Hiseq 2500/2000(Illumina,USA)平台上测序,并产生50 bp单端读数。去除原始序列中的低质量,5'接头污染以及含有polyA/T/G/C和N的比例大于10%的序列,得到过滤后序列(clean reads)用于后续分析。
1.3.3 Small RNA分类注释 对各样品的clean reads,筛选一定长度范围内的小RNA(small RNA)进行后续分析。将clean reads与已知的sRNA数据库进行对比注释。由于存在一个sRNA同时比对上几种不同的注释信息情况,为了将每个小RNA标签仅映射到唯一注释上,遵循以下优先原则:已知miRNA>核糖体RNA(ribosomal RNA,rRNA)>转运RNA(transfer RNA,tRNA)>核小RNA(small nuclearRNA,snRNA)>核仁小 RNA(small nucleolar RNA,snoRNAs)>重复基因>天然反义转录干扰小RNA(natural antisense transcript-derived siRNA,NAT-siRNA)>新miRNA>反式作用的干扰小RNA (trans-acting siRNA,ta-siRNA)[12]。
1.3.4 已知miRNA的检测和新miRNA的预测 已注释的小RNA与miRBase数据库中指定范围序列进行比对,得到各样品匹配上的sRNA的详细情况,包括已知miRNA的二级结构、序列、长度和出现的次数等信息。通过截取一定长度sRNA比对上的参考序列,使用软件miREvo和mirdeep2探寻sRNA二级结构及Dicer酶切位点信息及能量等特征进行新miRNA的预测。
1.3.5 miRNA差异及聚类分析 对初情期和初情期前山羊胸腺文库中已知和新的miRNA的表达进行表达量统计分析,并用每百万条序列转录本(transcripts per million,TPM)进行表达量归一化处理获得差异倍数(fold-change)变化和值[13]。使用火山图推断差异miRNA的整体分布情况,从差异倍数和校正后的显著水平(padj/qvalue)两个水平进行评估,对差异miRNA进行筛选。差异miRNA筛选标准为:qvalue<0.01且log2(foldchange)> 1。将各组比较得到的差异miRNA个数进行统计,以维恩图的方式表示。为了判断差异miRNA在不同试验条件下的表达模式,将所有差异miRNA并集在TPM值中,使用软件pheatmap进行层次聚类分析,将表达模式相同或相近的miRNA聚集成类,进而识别未知miRNA的功能或已知miRNA的未知功能。
1.3.6 差异表达miRNA靶基因预测及功能注释 miRNA靶基因预测通过预测软件进行,对分析得到的已知和新miRNA进行靶基因预测,得到miRNA和靶基因间的对应关系。根据miRNA与其靶基因间的对应关系,对每组差异表达miRNA的靶基因的集合分别进行基因本体论(gene ontology,GO)和基因与基因组京都百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析。GO富集分析用于分析差异表达的miRNA的候选靶基因并确定miRNA靶基因的作用。KEGG途径分析用于鉴定显著富集的代谢途径或信号转导途径。 KOBAS(CBI, China)软件用于KEGG通路的富集统计[14]。富集分析结果以散点图的形式表示。
2 结果与分析
2.1 测序质量及长度分布
初情期和初情期前山羊胸腺RNA提取质量如图1所示,28 s和18 s 均清晰可见。表明RNA质量良好,可以用于后续检测。随后构建初情期和初情期前山羊的胸腺文库,总共产生了15 739 867和11 635 964个原始序列,错误率为0.01%以内。在过滤低质量的序列后,两个RNA-Seq文库在每个文库中仍产生超过96%的clean reads(表1)。这表明这2个高质量文库构建成功。大多数sRNA的长度在21~24 nt之间(图2)。长度为21~24 nt的序列分别占初情期前和初情期山羊的胸腺总序列的74.85%和70.20%。

表1 初情期和初情期前山羊胸腺文库的构建和质控结果

M. DNA Marker;1-3.初情期前山羊4-6.初情期山羊。
Figure 1 Agarose gel electrophoresis of prepubertal and pubertal goat thymus RNA
2.2 已知和新miRNA分析鉴定
将所有sRNA与各类RNA的比对、注释情况进行总结,对样品中对比到的sRNA进行分类统计,结果如图3所示。初情期和初情期前山羊胸腺中总序列中分别存在39.96%和39.80%的已知miRNA序列,0.19 %和0.12 %的新miRNA序列,1.46%和0.87%的snoRNAs序列,其余RNA种类包括tRNA、rRNA、胞质小RNA、外显子和内含子等。将上述序列与miRBase中指定范围序列进行比对,通过软件检测到总共136个新miRNA成熟体,146个新miRNA前体。在已知miRNA的检测中,总共检测到402个成熟体miRNA,257个miRNA前体(表2)。

图2 初情期和初情期前山羊sRNA长度
Figure 2 Frequency distribution of sRNA sequence lengths
2.3 miRNA差异表达
将各组比较得到的差异miRNA个数进行统计,画成维恩图,在初情期和初情期前这2组中共检测出538个差异miRNA(图4)。初情期前和初情期山羊的胸腺中分别检测到37和 16个差异miRNA。在2组之间共有485个差异miRNA。如图5所示,在2个样品之间共有64个显著差异表达miRNA,其中 19个差异miRNA显著下调,45个差异miRNA显著上调。
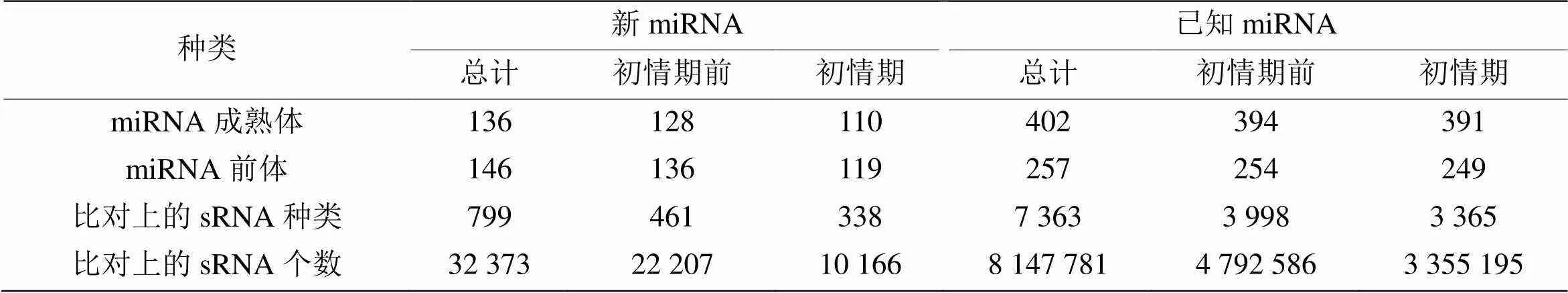
表2 已知miRNA和新的miRNA的数据统计
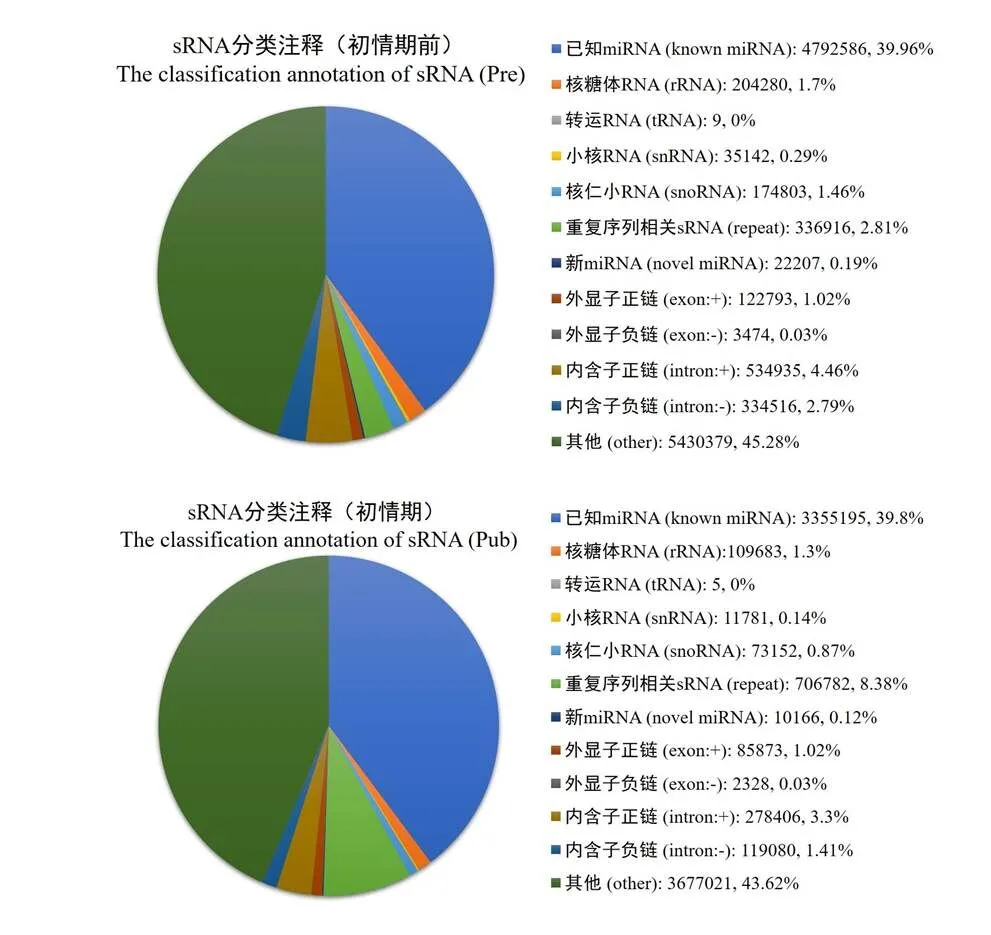
图3 测序得出的sRNA类别
Figure 3 Composition of small RNA classes from Solexa sequencing
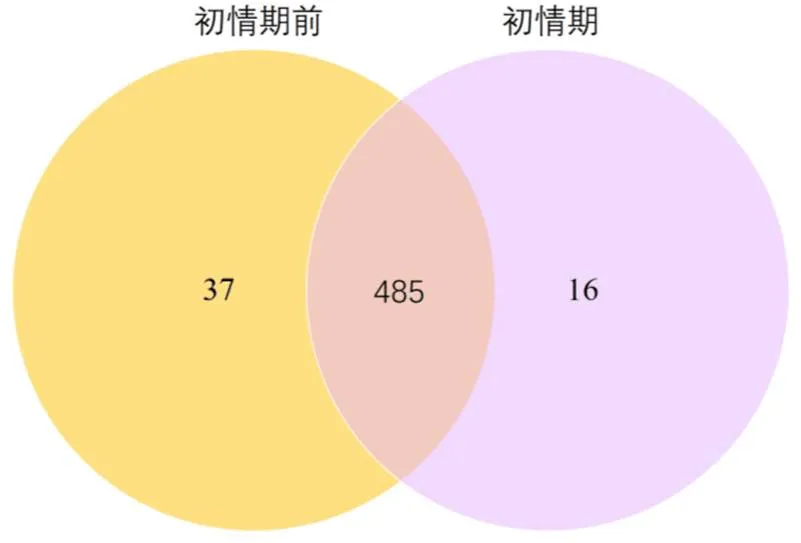
图4 差异表达miRNA维恩图
Figure 4 Differentially expressed miRNAs in the two goat thymus libraries
2.4 miRNA靶基因GO富集和KEGG通路富集分析
GO富集分析表明差异miRNA的靶基因涉及细胞组分,分子功能和生物学过程这3种基因功能类别中的一种或多种。差异miRNA靶基因共显著富集在34种生物学过程中,包括初级代谢过程,大分子代谢过程的调控等方面。靶基因富集在共15种分子功能(表3)。KEGG通路分析表明,在初情期前和初情期胸腺中,miRNA靶基因共涉及26条通路。这些通路包括苯丙氨酸,酪氨酸和色氨酸生物合成,丁二酸和新霉素生物合成,糖胺聚糖生物合成硫酸角蛋白,糖胺聚糖降解和光转导。由于没有信号通路被显著富集,表4中仅展示值前5低以及通路下相关靶基因数最多的5条通路。在这些这些通路中,超过200个靶基因的富集在Rap1信号通路上,但不存在显著差异。

红色,显著上调的差异miRNA;绿色,显著下调的差异miRNA;蓝色,无显著差异的miRNA。
Figure 5 Differential expression analysis of thymus miRNAs between pubertal and prepubertal goats
3 讨论与结论
在本研究中,使用Solexa技术对初情期前和初情期山羊的胸腺组织中的sRNA进行测序。测序结果表明,sRNA文库中的sRNA序列长度集中在20到24 nt之间。与以前的研究相似的是,在总sRNA序列中,22 nt长度的sRNA丰度最高,这是也山羊miRNA最典型的长度[15]。通过将sRNA定位到已知的miRbase,发现了402个已知的成熟体miRNA。根据miRNA前体结构,预测了136种新的miRNA。这极大地丰富了对山羊miRNA转录的理解,并为进一步研究在山羊中miRNA调控网络的作用奠定了基础。初情期前和初情期山羊的胸腺文库分别产生了15 739 867和11 635 964个原始序列,2个文库的clean reads数仍存在差异。通过图2的sRNA长度分析显示,初情期山羊胸腺中长度在21~24 nt之间的sRNA相较于初情期前数量降低。初情期前山羊胸腺中长度在21~24 nt的sRNA共检测到11 038 796个,初情期时为7 542 108个。考虑到miRNA长度位于21~24 nt之间,初情期山羊胸腺原始序列的降低可能由于miRNA下调引起。另外,在初情期山羊卵巢和人类青春期胸腺中也出现这种miRNA减少,原始序列降低的现象[16-17]。具体机制仍需进一步阐明。

表3 样品中候选靶基因的Gene Ontology富集列表
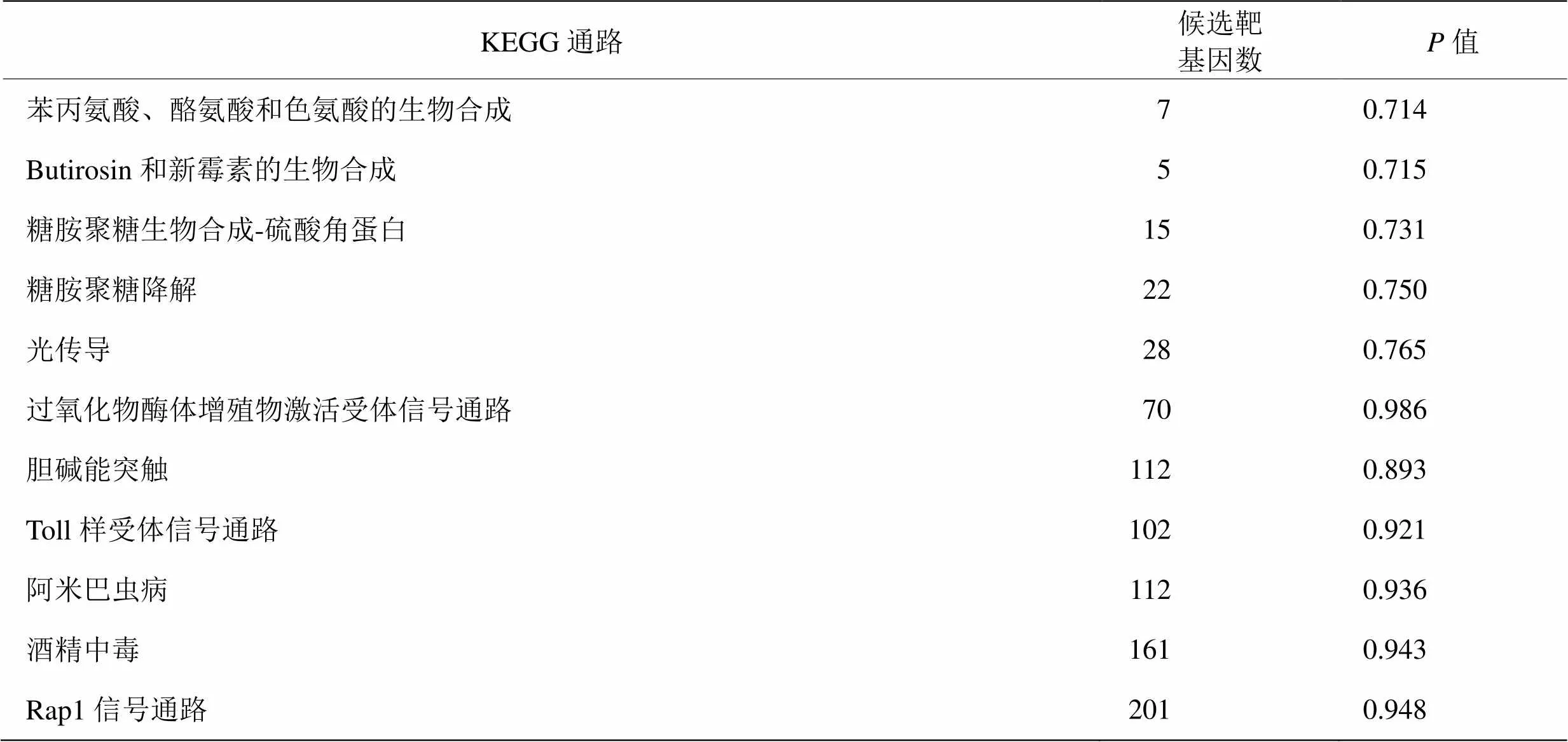
表4 候选靶基因KEGG显著性富集列表
初情期启动的早晚关系到雌性动物的繁殖性能。研究表明,在哺乳动物中,内分泌和免疫系统之间的存在着直接联系。性激素和糖皮质激素参与免疫细胞的发育、分化和功能,并在免疫耐受机制中起作用[17-18]。在初情期启动中起着至关重要的作用的G蛋白偶联受体54 (G Protein-Coupled Receptors 54, GPR54) 同样具有免疫调节功能。GPR54缺乏导致胸腺增大,胸腺细胞增多,初情期前后胸腺微结构发生改变[19]。内分泌系统和免疫系统之间的具体作用机制还没有得到很好的研究。胸腺退化是内分泌和免疫系统之间存在直接联系的证据之一。胸腺是第一个成熟的淋巴器官,在幼年期动物中最大,但随着年龄增长而退化。胸腺退化的时间因物种而异,但在哺乳动物中通常与初情期一致[20]。在雌性白山羊中胸腺从幼年时期到初情期逐渐增大,在初情期达到最大,此后呈现增龄性退化现象[21]。
在初情期前和初情期的山羊胸腺组织中,一共鉴定了538 个差异 miRNA,其中chi-miR-493-5p和 chi-miR-30f-5p在初情期时的胸腺组织中显著下调,在安怀白山羊的垂体以及济宁灰山羊卵巢中同样也发现这两个miRNA差异表达,但在生理或生殖上的功能仍然未知[15,22]。chi-miR-99a-5p在初情期山羊胸腺中同样显著下调,miR-99a是在哺乳动物卵巢中最重要的miRNA群体之一[23],胰岛素样生长因子1受体(Insulin-like growth factor 1, IGF-1R)是miR-99a的直接靶标。miR-99a可通过直接下调IGF-1R抑制乳腺癌细胞的增殖,迁移和侵袭。由于IGF-1R与初情期的启动密切相关[24],因此mir-99a可能参与初情期的调控。
chi-miR-10b-5p、chi-miR-199a-3p和chi-miR- 199a-5p在初情期胸腺组织中极显著下调,这些miRNA参与细胞增殖,凋亡和差异化的过程。其中chi-miR-10b-5p与细胞增殖和肌肉发育相关,chi-miR-10b-5p在初情期山羊胸腺中的显著下调,表明细胞增殖活性受到抑制,为研究初情期山羊胸腺退化提供了重要信息[25]。其他显著下调的miRNA,chi-miR-199a-3p和chi-miR-199a-5p同样参与细胞增殖和凋亡的过程。由于下丘脑-垂体-性腺轴的正常功能依赖于胸腺对内分泌的影响[26]。胸腺素作为胸腺分泌的一种生物活性分子,对初情期的启动起着积极作用。幼儿期小鼠注射胸腺素引起初情期提前[3]。胸腺素能调节腺垂体激素的释放,胸腺切除会导致腺垂体发育异常[27-28],新生小鼠胸腺素基因治疗可以防止循环促性腺激素水平的降低[29]。
体外研究表明,胸腺素可以直接作用于GnRH神经元,并提高垂体促性腺激素水平[30]。胸腺素-4同样在体外培养下丘脑和垂体组织产生GnRH和LH的刺激作用[26]。除直接作用以外,胸腺产生的胸腺素还合成参与生殖内分泌的其他激素,例如褪黑素、神经肽和胰岛素等[31]。胸腺激素的抑制一般由衰老引起,因此miRNA参与的胸腺退化过程对初情期的调控同样有着重要意义。
在KEGG功能富集中,候选靶基因虽然没有显著富集到某一通路,但这些差异靶基因同样涉及一些与初情期相关的途径,例如胆碱能突触[32]和过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors, PPAR)信号途径[33]。值得注意的是PPAR信号同样在初情期婆罗门母牛卵巢中显著富集[34],提示其参与卵巢生物学功能。这些靶基因通路的富集可为该领域的未来研究提供参考。
本试验检测了 miRNA 在初情期前和初情期山羊胸腺组织的表达情况,并对其进行了靶基因预测和功能分析,结果表明山羊胸腺miRNA可能在山羊初情期启动中发挥重要作用。研究结果为探明山羊初情期启动的潜在调控机制提供了重要参考,并有助于阐明miRNA参与生长和繁殖的过程。
[1] DENLI A M, TOPS B B J, PLASTERK R H A, et al. Processing of primary microRNAs by the Microprocessor complex[J]. Nature, 2004, 432(7014): 231-235.
[2] HOLLEY C L, TOPKARA V K. An introduction to small non-coding RNAs: miRNA and snoRNA[J]. Cardiovasc Drugs Ther, 2011, 25(2): 151-159.
[3] GARCÍA L, HINOJOSA L, DOMÍNGUEZ R, et al. Effects of infantile thymectomy on ovarian functions and gonadotrophin-induced ovulation in prepubertal mice: role of thymulin[J]. J Endocrinol, 2000, 166(2): 381-387.
[4] KOSIEWICZ M M, MICHAEL S D. Neonatal thymectomy affects follicle populations before the onset of autoimmune oophoritis in B6A mice[J]. J Reprod Fertil, 1990, 88(2): 427-440.
[5] GARCÍA L, HINOJOSA L, DOMÍNGUEZ R, et al. Effects of injecting thymulin into the anterior or medial hypothalamus or the pituitary on induced ovulation in prepubertal mice[J]. Neuroimmunomodulation, 2005, 12(5): 314-320.
[6] HALL N R, MCGILLIS J P, SPANGELO B L, et al. Evidence that thymosins and other biologic response modifiers can function as neuroactive immunotransmitters[J]. J Immunol, 1985, 135(2 Suppl): 806s-811s.
[7] HADLEY A J, RANTLE C M, BUCKINGHAM J C. Thymulin stimulates corticotrophin release and cyclic nucleotide formation in the rat anterior pituitary gland[J]. Neuroimmunomodulation, 1997, 4(2): 62-69.
[8] CAO G L, FENG T, CHU M X, et al. Subtraction suppressive hybridisation analysis of differentially expressed genes associated with puberty in the goat hypothalamus [J]. Reprod Fertil Dev, 2015, 28(11): 1781-1787.
[9] AVENDAÑO M S, AVENDAÑO M S, VAZQUEZ M J, et al. Disentangling puberty: novel neuroendocrine pathways and mechanisms for the control of mammalian puberty[J]. Hum Reprod Update, 2017, 23(6): 737-763.
[10] MESSINA A, LANGLET F, CHACHLAKI K, et al. A microRNA switch regulates the rise in hypothalamic GnRH production before puberty[J]. Nat Neurosci, 2016, 19(6): 835-844.
[11] SANGIAO-ALVARELLOS S, MANFREDI-LOZANO M, RUIZ-PINO F, et al. Changes in hypothalamic expression of the Lin28/let-7 system and related microRNAs during postnatal maturation and after experimental manipulations of puberty[J]. Endocrinology, 2013, 154(2): 942-955.
[12] CALABRESE J M, SEILA A C, YEO G W, et al. RNA sequence analysis defines Dicer's role in mouse embryonic stem cells[J]. Proc Natl Acad Sci U S A, 2007, 104(46): 18097-18102.
[13] ZHOU L, CHEN J, LI Z, et al. Integrated profiling of microRNAs and mRNAs: microRNAs located on Xq27.3 associate with clear cell renal cell carcinoma[J]. PLoS One, 2010, 5(12): e15224.
[14] MAO X Z, CAI T, OLYARCHUK J G, et al. Automated genome annotation and pathway identification using the KEGG Orthology (KO) as a controlled vocabulary[J]. Bioinform Oxf Engl, 2005, 21(19): 3787-3793.
[15] YE J, YAO Z, SI W, et al. Identification and characterization of microRNAs in the pituitary of pubescent goats[J]. Reprod Biol Endocrinol, 2018, 16(1): 51.
[16] 于兰兰. 参与初情期启动的山羊卵巢miRNA筛选与鉴定[D]. 合肥: 安徽农业大学, 2016.
[17] MOREIRA-FILHO C A, BANDO S Y, BERTONHA F B, et al. Minipuberty and sexual dimorphism in the infant human Thymus[J]. Sci Rep, 2018, 8(1): 13169.
[18] DRAGIN N, BISMUTH J, CIZERON-CLAIRAC G, et al. Estrogen-mediated downregulation of AIRE influences sexual dimorphism in autoimmune diseases[J]. J Clin Investig, 2016, 126(4): 1525-1537.
[19] XING R, LIU F, YANG Y, et al. GPR54 deficiency reduces the Treg population and aggravates experimental autoimmune encephalomyelitis in mice[J]. Sci China Life Sci, 2018, 61(6): 675-687.
[20] REZZANI R, NARDO L, FAVERO G, et al. Thymus and aging: morphological, radiological, and functional overview[J]. Age (Dordr), 2014, 36(1): 313-351.
[21] 蒋书东, 张兴旺, 方富贵, 等. 雌性安徽白山羊胸腺形态学增龄性变化[J]. 畜牧兽医学报, 2018,49(8): 1743-1751.
[22] MIAO X, LUO Q, ZHAO H, et al. Genome-wide analysis of miRNAs in the ovaries of Jining Grey and Laiwu Black goats to explore the regulation of fecundity[J]. Sci Rep, 2016, 6: 37983.
[23] HOSSAIN M M, SOHEL M M, SCHELLANDER K, et al. Characterization and importance of microRNAs in mammalian gonadal functions[J]. Cell Tissue Res, 2012, 349(3): 679-690.
[24] HINEY J K, SRIVASTAVA V K, VADEN ANDERSON D N, et al. Regulation of kisspeptin synthesis and release in the preoptic/anterior hypothalamic region of prepubertal female rats: actions of IGF-1 and alcohol[J]. Alcohol Clin Exp Res, 2018, 42(1): 61-68.
[25] LIAO R R, LV Y, ZHU L H, et al. Altered expression of miRNAs and mRNAs reveals the potential regulatory role of miRNAs in the developmental process of early weaned goats[J]. PLoS One, 2019, 14(8): e0220907.
[26] BLOM J M C, OTTAVIANI E. Immune-neuroendocrine interactions: evolution, ecology, and susceptibility to illness[J]. Med Sci Monit Basic Res, 2017, 23: 362-367.
[27] MARKOVIĆ L. Interaction involving the Thymus and the hypothalamus-pituitary axis, immunomodulation by hormones[J]. Srp Arh Celok Lek, 2004, 132(5/6): 187-193.
[28] KINOSHITA Y, HATO F. Cellular and molecular interactions of Thymus with endocrine organs and nervous system[J]. Cell Mol Biol (Noisy-Le-Grand), 2001, 47(1): 103-117.
[29] REGGIANI P, MARTINES E, FERESE C, et al. Morphological restoration of gonadotrope population by thymulin gene therapy in nude mice[J]. Histol Histopathol, 2009, 24(6): 729-735.
[30] SU S P, SUN X X, ZHOU X H, et al. Effects of GnRH immunization on the reproductive axis and thymulin[J]. J Endocrinol, 2015, 226(2): 93-102.
[31] CSABA G. The immunoendocrine Thymus as a pacemaker of lifespan[J]. Acta Microbiol Immunol Hung, 2016, 63(2): 139-158.
[32] KEAST J R, GLEESON R J, SHULKES A, et al. Maturational and maintenance effects of testosterone on terminal axon density and neuropeptide expression in the rat vas deferens[J]. Neuroscience, 2002, 112(2): 391-398.
[33] BRUNETTI L, LAGHEZZA A, LOIODICE F, et al. Combining fatty acid amide hydrolase (FAAH) inhibition with peroxisome proliferator-activated receptor (PPAR) activation: a new potential multi-target therapeutic strategy for the treatment of Alzheimer's disease[J]. Neural Regen Res, 2020, 15(1): 67-68.
[34] NGUYEN L T, REVERTER A, CÁNOVAS A, et al. Global differential gene expression in the pituitary gland and the ovaries of pre-and postpubertal Brahman heifers[J]. J Anim Sci, 2017, 95(2): 599-615.
Screening of microRNAs in the thymus of pubertal goats
YAO Zhiqiu, LI Hailing, KANG Tiezhu, SI Wenyu, YE Jing, ZHANG Xingwang, FANG Fugui
(School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036)
The objective of the paper aimed to screen the differential expression of MicroRNA in the thymus between prepubertal and pubertal goats. Thymus tissue from prepubertal (=3) and pubertal (=3) goats were analyzed by Solexa sequencing. The target genes of these miRNAs were evaluated using GO enrichment and KEGG pathway analysis to identify critical pathways regulating the onset of puberty in goats. 538 miRNAs were detected in goat thymus tissue. 64 miRNAs were differentially expressed between the two groups. 19 up-regulated and 45 down-regulated genes in the pubertal samples compared with the prepubertal samples. KEGG pathway enrichment analysis revealed that these differentially expressed miRNA target genes were mainly focused on phenylalanine, tyrosine and tryptophan biosynthesis, butirosin and neomycin biosynthesis and the cholinergic synapse and peroxisome proliferators-activated receptor signaling pathway related to the onset of puberty. The results suggested that miRNA in the thymus may be involved in the onset of puberty of the goat.
goat; MicroRNA; puberty; thymus
S827
A
1672-352X (2021)01-0066-07
10.13610/j.cnki.1672-352x.20210319.004
2021-3-23 10:05:55
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210319.1503.008.html
2020-03-05
国家自然科学基金(31972629)资助。
姚郅璆,硕士研究生。E-mail:695025620@qq.com
方富贵,博士,教授,博士生导师。E-mail:fgfang@163.com
