酥瓜果实细菌性斑点病的病原鉴定
2021-04-13程勋辉张立新王晶晶宋江华
程勋辉, 张立新, 王晶晶, 宋江华*
酥瓜果实细菌性斑点病的病原鉴定
程勋辉1, 张立新2, 王晶晶3, 宋江华1*
(1. 安徽农业大学园艺学院 合肥 230036;2. 安徽农业大学植物保护学院 合肥 230036;3. 淮南市农业科学研究所 淮南 232008)
为明确安徽省淮南市地区酥瓜果实斑点病的病原菌,采用常规平板划线法从酥瓜果实病组织分离细菌,通过生理生化特征、分子生物学特性和致病性试验对其进行鉴定。结果表明,从采集的病果中获得36株菌落形态特征相似的细菌分离物,测试菌株均能诱导烟草叶片产生过敏性坏死。采用牙签刺伤法将测试菌株接种健康酥瓜果实,可导致接种点处产生水浸状病斑。BLAST结果表明,2株菌株的16S rRNA序列分别与短小芽胞杆菌GR-8 (CP009108),ATCC 7061(ABRX01000003)的同源性为99.93%和99.58%,2株菌株的基因序列与C4(CP011109)的同源性达99.39%。基于基因的聚类分析证实2株菌株与(C4和GR-8)紧密的聚在一个分支。生理生化试验结果进一步显示,该细菌与文献报道的短小芽胞杆菌的生理生化特征相吻合。结合细菌生理生化特征、16S rRNA和基因的序列分析,以及柯赫氏法则验证,确定引起酥瓜果实细菌性斑点病的病原为。
酥瓜;果实斑点病;鉴定;短小芽胞杆菌
酥瓜(var.Group),别名羊角酥、脆瓜等,是葫芦科甜瓜属甜瓜种的变种。瓜呈羊角形,瓜皮白绿色,瓜肉绿色,瓜瓤桔红色,皮薄、味甜、富含多种维生素,营养价值很高[1-2]。该作物在我国安徽、山东、四川和河南等地均有广泛种植,类型和品种多样。近年来,随着甜瓜种植面积的推广,耕作模式的调整和气候变化的影响,甜瓜病害种类的发生呈现出多样性和严重趋势。瓜类细菌性果斑病是葫芦科植物上的一种严重的世界性病害,该病害主要侵染西瓜、甜瓜和黄瓜等,为害瓜类植株的真叶、茎蔓和果实[3-4]。在瓜类果实上的病斑初为水浸状,圆形或卵圆形,绿褐色;后期扩展成大病斑,颜色变深呈褐色至黑褐色,严重时内部组织腐烂[4]。前人研究将引起该病害的病原鉴定为燕麦嗜酸菌西瓜亚种(subsp.)[5-6],后来将该细菌命名为西瓜噬酸菌()[7]。
2016和2017年,在淮南酥瓜主要生产区发现了一种新的细菌性果实斑点病。病害发生时,酥瓜果实表面密集分布水浸状斑点,表皮内层组织感染后呈水浸状腐烂,病害症状与先前报道的由西瓜噬酸菌引起的瓜类果斑病的症状很相似。该病害在淮南的酥瓜局部种植田块普遍发生,病果发生率达到10%以上,严重影响了酥瓜的经济价值。为弄清安徽淮南地区酥瓜果实斑点病的病原,本研究采用平板划线分离法获得酥瓜果实斑点病的病原菌菌株,并利用生理生化试验、柯赫氏法则验证,以及16S rRNA和基因序列分析对该病原菌进行鉴定,以期为该病害的防治提供理论依据。
1 材料与方法
1.1 病样采集与细菌分离
1.1.1 病样采集 病害样品采集自淮南潘集区酥瓜主要种植区,选取典型病害样本,描述症状及拍照。
1.1.2 细菌分离 选取不同田块收集的发病酥瓜果实,在无菌操作台内用灭菌脱脂棉蘸取75%乙醇擦拭病果发病部位3~5次,然后用灭菌刀片轻轻刮去发病的表皮组织,取下层腐烂果肉组织置入约5 mL无菌水中,然后捣碎病组织、制成带菌的病组织悬浮液,静置10 min。用无菌接种环蘸取病组织悬浮液接种于营养琼脂培养基(NA)上,采用平板划线法进行细菌分离,然后将平板置于28 ℃恒温培养箱中培养24~72 h,待细菌菌落长出后,挑取单菌落进行纯化培养,并将纯化的细菌培养物保存于试管斜面和30%甘油中待用。
1.2 烟草过敏性坏死反应
将分离细菌在NA培养基上活化培养48 h,用无菌水配制浓度为108CFU·mL-1的细菌悬浮液,用无菌注射器将细菌悬浮液从烟叶(中烟100)下表皮注入叶肉细胞间。接种后将烟草植株置于人工气候箱培养24~48 h,培养条件为温度28 ℃,相对湿度85%,12 h黑暗光照交替。观察测试菌株是否能引起烟草过敏性坏死反应,试验重复3次。
1.3 致病性测定
将分离细菌配制成细菌悬浮液(方法同1.2)。选取健康酥瓜(品种:绿美人,淮南市农科所选育),果实表面用灭菌棉花蘸取75%乙醇擦拭消毒、晾干。用灭菌牙签蘸取测试菌株的细菌悬浮液、刺伤接种酥瓜果实,刺入深度约0.5 cm;同时用灭菌牙签蘸取无菌水刺伤接种酥瓜果实作为阴性对照。将接种后的酥瓜分别装入保鲜袋内,然后置入28℃恒温气候箱中,培养48 h后去除保鲜袋,并逐日观察记录酥瓜果实发病情况。
1.4 病原菌分子鉴定
1.4.1 16S rRNA的PCR扩增和测序 以提取菌株的总DNA为模板,采用细菌16S rRNA通用引物fD1/rD1[8]进行PCR扩增。PCR反应体系(25 μL):其中2x EsMasterMix(Dye)(北京康为世纪生物科技有限公司) 12.5 μL,模板DNA 1.0 μL,引物(10 μmol·L-1)各1 μL,ddH2O 9.5 μL。反应体系配好后放入PCR仪(Thermal Cycler S1000)中进行反应。PCR扩增反应程序:94℃预变性2 min;94℃变性30 s,退火温度60℃,时间为30 s,72℃延伸1 min,30个循环;最后72℃延伸2 min。经1%琼脂糖凝胶电泳检测PCR产物,得到单一目的条带后将PCR产物送至南京擎科生物技术有限公司测序。
1.4.2基因的PCR扩增和测序 由于基因能够在芽胞杆菌的近缘种间进行有效区分和鉴定[9],本研究对分离细菌的基因进行PCR扩增和序列分析。以提取菌株的总DNA为模板,利用引物对UP1/UP2r[10]对基因进行PCR扩增。PCR反应体系(25 μL):其中2x EsMasterMix(Dye)(北京康为世纪生物科技有限公司)12.5 μL,模板DNA 1.0 μL,引物(10 μmol·L-1)各0.5 μL,ddH2O 10.5 μL。将配置好的PCR混合物放入PCR仪(Thermal Cycler S1000)中进行反应。PCR扩增反应程序:94 ℃预变性2 min;94 ℃变性30 s,退火温度58 ℃,时间为30 s,72 ℃延伸45 s,30个循环;最后72 ℃延伸2 min。经1%琼脂糖凝胶电泳检测PCR产物,得到单一目的条带后将PCR产物送至南京擎科生物技术有限公司测序。
1.4.3 序列分析及系统发育树构建 采用DNAstar V7.10将获得的序列进行检查和同源性分析,同时在National center for biotechnology information(NCBI)数据库中利用BLAST工具进行序列同源性搜索,明确与测试菌株序列同源性高的参考菌株及其物种;同时将供试菌株的基因序列与从GenBank下载的近缘种参考菌株序列,通过MEGA X 10.1.8软件采用邻接法(Neighbour-Joining)构建系统发育树,分析细菌分离物与已知参考菌株的亲缘关系,以确定测试菌株的分类地位。
1.5 生理生化性状测定
测定分离细菌的生理生化性状,主要包括:革兰氏染色、厌氧性测定,氧化酶反应,接触酶反应,柠檬酸盐利用,10 ℃、30 ℃和45 ℃条件生长,pH5、pH6和pH7生长,明胶液化,酪蛋白、淀粉水解,碳源(聚乙二醇、甘油、山梨醇)利用,氨基酸(L-甘氨酸、L-酪氨酸)利用。具体方法参照《常见细菌系统鉴定手册》[11]。
2 结果与分析
2.1 酥瓜果实斑点病症状
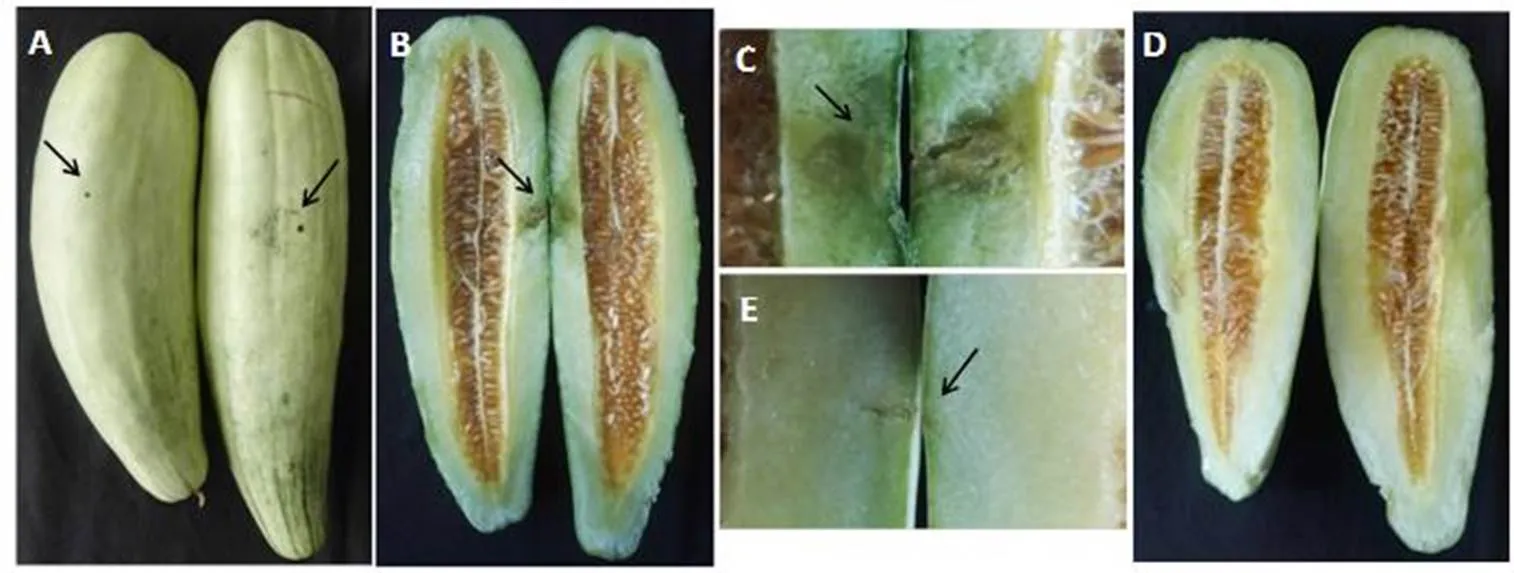
病害初期,瓜皮表面有水浸状斑点,圆形或卵圆形,病斑微隆起果实表面,扩展后病斑中心呈褐色或灰白色,后期表皮组织变软(图1-A,C)。沿果实病斑发病部位纵向切开,表皮下层果肉呈黄褐色并伴有水浸状腐烂(图1-B)。健康酥瓜果实表面和内部没有该症状(图1-D, E)。

A和C:田间发病酥瓜果实的表面症状;B: 田间发病果实的内部症状;D和E: 健康的酥瓜果实。
Figure 1 Symptoms of bacterial fruit spot on crisp melon from the fields in Huainan of Anhui Province

图2 测试菌株接种在烟草叶片上48 h后的过敏性坏死反应
Figure 2 Hypersensitive reaction on tobacco leaves induced by tested bacterial isolates 48 h after inoculation
2.2 病原菌分离与烟草过敏性坏死反应测定
采用平板划线法从来源于淮南不同田块的8个病果中,均分离获得细菌菌落形态相似的单菌落,随机选取36株保存备用。该细菌在NA培养基上菌落为乳白色、光滑、边缘整齐,直径约2 mm。将细菌分离物接种烟草叶片,观察测试菌株的过敏坏死性反应。结果表明,测试的菌株接种烟草叶片24~48 h后,均能引起烟草过敏性坏死(图2)。
2.3 致病性测定结果
将获得的细菌菌株制成细菌悬浮液,采用无菌牙签蘸取菌液、刺伤接种酥瓜健康果实。测试菌株接种酥瓜果实6 d后,果实接种点部位变软,周围出现水浸状病班(图3-A);沿发病部位将果实切开,可观察到果实表皮下层组织变为黄褐色,伴有不同程度的组织腐烂(图3-B, C),与田间发病的果实内部组织症状相似;而用灭菌牙签蘸无菌水刺伤接种的酥瓜果实,则在果实接种点表面和内部均未观察到发病症状(图3-D, E)。采用平板划线法从人工接种发病的酥瓜上重新分离病原,得到与测试细菌的菌落形态一致的细菌分离物,经生理生化试验和基因序列分析证实是,符合和完成柯赫氏法则。
A: 酥瓜接种6 d后的表面症状;B和C:Y1菌株接种酥瓜6 d后的内部症状;D和E:无菌水接种6 d后的内部症状。
Figure 3 Artificially inoculated fruit of crisp melon by toothpick inoculation method within 6 d

图4 基于gyrB基因序列构建的2株细菌及相关近缘种菌株的系统发育树
Figure 4 Phylogenetic tree constructed based on thegene sequences from the two representative strains and closely related species in
2.4 病原菌分子鉴定
通过对2株代表性菌株(Y1和Y2)扩增16S rRNA片段和测序,分别获得长度为1437 bp和 1436 bp的核苷酸序列(MF967216和MF967217)。利用DNAstar V7.10软件分析2条序列,结果显示2株细菌的16S rRNA序列相似度为99.7%。BLAST分析结果表明,2株细菌的16S rRNA序列与已报道的GR-8(CP009108)[12],ATCC 7061(ABRX01000003)[13]和 C4(CP011109)的同源性为99.93%、99.58%和99.86%。采用基因的专化引物从这2株细菌的基因组DNA中扩增得到长度约1.2 kb的目的片段,经测序分别得到1142 bp和1132 bp的核苷酸序列(MF968898和MF968899),2株细菌的基因序列相似性为100%。BLAST分析结果显示,2株菌株的基因序列与C4(CP011109)、GR-8(CP009108)的同源性分别为99.39%和98.77%。基于已报道的芽胞杆菌不同模式种菌株[14]及相关参考菌株,通过对本研究测序菌株和芽胞杆菌属内21株近缘种的序列进行聚类分析,结果表明,选取的2株细菌与C4(CP011109)和GR-8(CP009108)紧密的聚在一起,亲缘关系最近(图4)。
2.5 生理生化性状测定结果
对选取的2株细菌分离物进行了生理生化试验(表1)。结果表明,测试菌株表现出一致的生理生化特征。该细菌为革兰氏阳性、氧化酶反应阳性、厌氧生长阴性、接触酶反应阳性;在10℃、30℃条件下可以生长,45℃条件下不能生长;pH5条件下不能生长,pH6、pH7条件下可以生长;可水解酪蛋白和利用柠檬酸盐;不能使明胶液化、不能水解淀粉、不能利用甘油、山梨醇、聚乙二醇、酪氨酸和甘氨酸。本研究测试菌株的生理生化特征与已报道的ATCC 7061T [13,15]的相似。
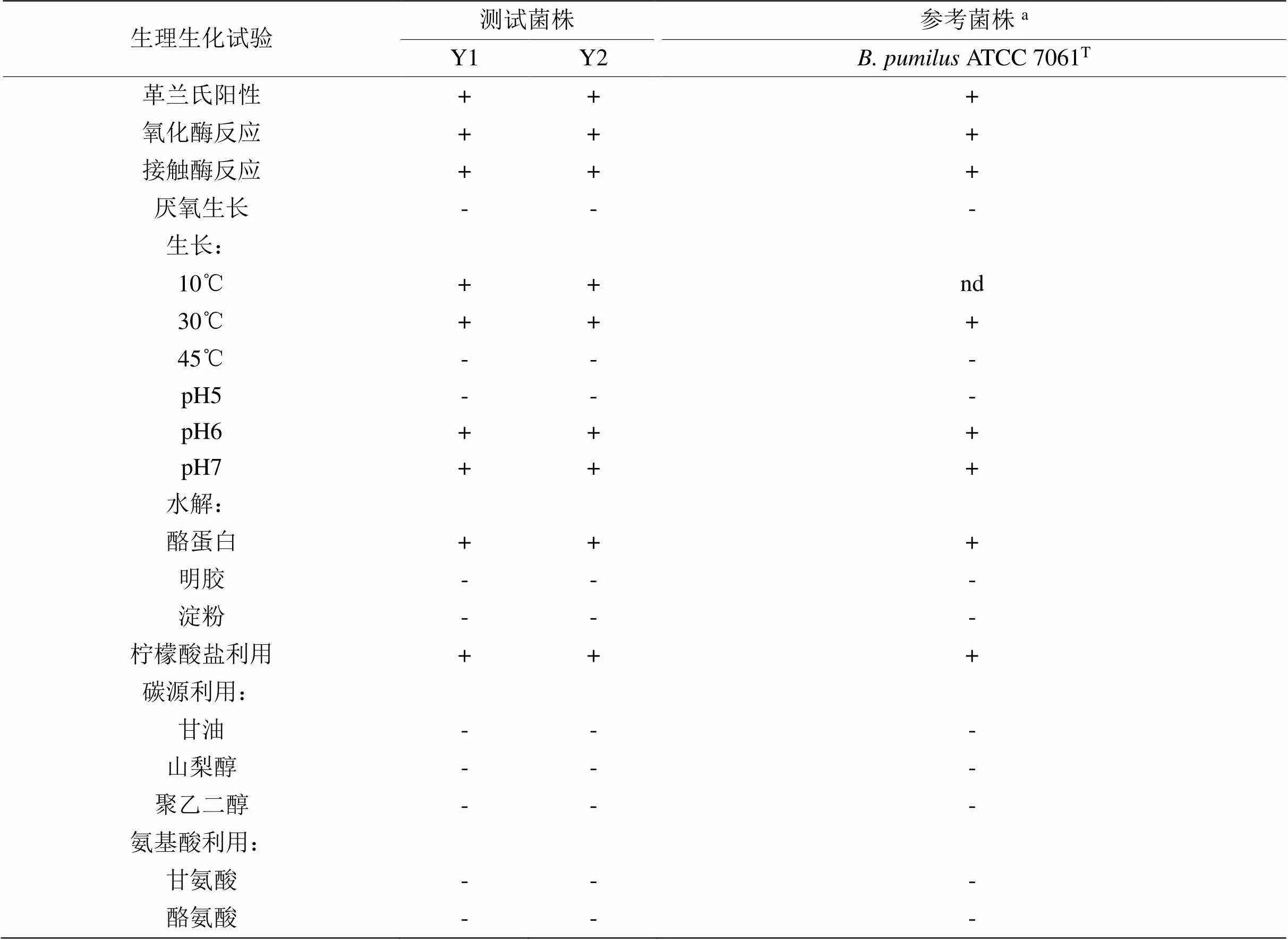
表1 测试细菌菌株的生理生化试验结果
注:‘+’代表阳性,‘-’代表阴性,‘nd’代表没有数据。a数据来源于参考文献[15]。
3 讨论与结论
本研究对引起淮南地区酥瓜果实斑点病的病原进行了分离,将获得的细菌培养物接种烟草,其均能使烟草产生过敏性坏死反应;接种健康酥瓜果实均能导致果实产生水浸状坏死斑,并伴有表皮下层组织黄褐色腐烂,与田间发病果实的症状相似。采用平板划线法从果实发病组织重新分离,获得与先前接种的菌落形态一致的细菌菌落。通过对选取菌株的生理生化试验、16S rRNA和基因序列分析,确定短小芽胞杆菌是引起酥瓜果实斑点病的病原菌。
由于16S rRNA序列在细菌属内的高度保守性,对种间相似度很高的近缘种做进一步的鉴别较为困难[16]。有研究表明,和的亲缘关系很近,尤其在16S rRNA序列同源性上达到99%,但两者在部分生理生化特征方面表现出显著的差异[15]。例如,能水解酪蛋白、可以利用柠檬酸盐、不能使明胶液化、不能水解淀粉、不能利用甘油、山梨醇、聚乙二醇、酪氨酸和甘氨酸等,而则在这些生理生化方面表现出不同的特征。本研究测试菌株的生理生化试验结果与已报道的ATCC 7061T的生理生化特征[13, 15]相吻合。近年来研究认为,基因在细菌近缘种,尤其在芽胞杆菌属内种的分类和鉴定中具有较好的区分能力[10]。本研究中测试的2株细菌与C4的序列同源性高于99%,与(JOVS02000003)、(CP017786)的序列同源性分别为98%和93%。通过基因序列的聚类分析,结果显示这2株细菌与的亲缘关系最近。
近年来由细菌引起植物病害的报道呈上升趋势。2003年该细菌在西班牙被报道可侵染芸豆而引起叶片褐斑[17],2013和2019年在中国相继发现该细菌可引致生姜根腐病[12],贮藏期马铃薯块茎软腐病[18],同时该细菌被报道也可侵染无花果而导致果实腐烂[19]。本研究发现细菌可侵染酥瓜而引起果实斑点病。酥瓜作物在安徽淮南地区广泛种植,是地方经济发展中的特色产业,为当地农民的创业增收发挥着重要作用。酥瓜果实斑点病的发生严重降低了酥瓜果实品质,极大影响了酥瓜的销售和经济效益。本研究明确了引起淮南地区酥瓜果实斑点病的病原菌为,这为该病害的流行监测和进一步的有效治理提供了科学依据。由于酥瓜在我国黄淮海地区的种植规模呈逐年扩大趋势,在接下来的研究中,仍需进一步明确植物病原菌的田间侵染和传播规律,揭示该病原细菌的致病机理,从而为该病害的预测预报和抗病品种选育提供科学理论指导。
[1] 葛继涛, 陈国户, 袁凌云, 等. 酥瓜(var. conomon Group) ISSR-PCR反应体系建立与优化[J]. 分子植物育种, 2016, 14(9): 2441-2446.
[2] 袁凌云, 朱世东, 苏亚, 等. 酥瓜连作对土壤环境及植株光合特性的影响[J]. 安徽农业大学学报, 2017, 44(2): 327-332.
[3] 赵廷昌, 赵洪海, 王怀松. 山东省西瓜、甜瓜发生瓜类细菌性果斑病[J]. 植物保护, 2009, 35(5): 170-171.
[4] 阎莎莎, 王铁霖, 赵廷昌. 瓜类细菌性果斑病研究进展[J]. 植物检疫, 2011, 25(3): 71-76.
[5] 蔡学清,黄月英,杨建珍,等. 福建省西瓜细菌性果斑病的病原鉴定[J].福建农林大学学报(自然科学版),2005,34(4): 434-437.
[6] 吉训聪,肖彤斌,黄伟明,等. 海南甜瓜细菌性果斑病病原菌鉴定[J]. 广东农业科学, 2012, 39(11): 89-91, 95.
[7] YAN L C, HU B S, CHEN G, et al. Further evidence of cucurbit host specificity amonggroups based on a detached melon fruit pathogenicity assay[J]. Phytopathology, 2017, 107(11): 1305-1311.
[8] WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. J Bacteriol, 1991, 173(2): 697-703.
[9] 李献梅, 王小芬, 杨洪岩, 等. 促旋酶(gyrase)B亚单位基因在鉴别细菌近缘种中的应用[J]. 微生物学报, 2008, 48(5): 701-706.
[10] YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing ofgenes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains[J].Appl Environ Microbiol, 1995, 61(10): 1104-1109.
[11] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001:370-384.
[12] PENG Q, YUAN Y H, GAO M Y. Bacillus pumilus, a novel ginger rhizome rot pathogen in China[J]. Plant Dis, 2013, 97(10): 1308-1315.
[13] THOMAS P.Long-term survival of Bacillus spores in alcohol and identification of 90% ethanol as relatively more spori/bactericidal [J]. Curr Microbiol, 2012, 64: 130-139.
[14] LIU Y, LAI Q L, DU J, et al.sp. nov. andsp. nov.[J] Int J Syst Evol Microbiol, 2016, 66(3): 1193-1199.
[15] SHIVAJI S, CHATURVEDI P, SURESH K, et al.sp. nov.,sp. nov.,sp. nov. andsp. nov., isolated from cryogenic tubes used for collecting air samples from high altitudes[J]. Int J Syst Evol Microbiol, 2006, 56(7): 1465-1473.
[16] STACKEBRANDT E, GOEBEL B M. Taxonomic note: a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. Int J Syst Evol Microbiol, 1994, 44(4): 846-849.
[17] FONT M I, BASSIMBA D D M, CEBRIÁN M C, et al. First report ofonvulgaris in Spain[J]. Plant Pathol , 2010, 59(2): 400.
[18] 佘小漫, 汤亚飞, 蓝国兵, 等. 广东省马铃薯块茎软腐病病原菌鉴定[J]. 植物保护学报, 2019, 46(3): 618-625.
[19] IIakim, Naz S, Liaquat F, et al. Presence of Bacilluscausing fruit rot ofin Parkistan [J]. J PLANT PATHOL, 2015, 97(3): 543.
Identification of the pathogen causing bacterial fruit spot of crisp melon
CHENG Xunhui1, ZHANG Lixin2, WANG Jingjing3, SONG Jianghua1
(1. School of Horticulture, Anhui Agricultural University, Hefei 230036;2. School of Plant Protection, Anhui Agricultural University, Hefei 230036;3. Huainan Institute of Agricultural Sciences, Huainan 232008)
To clarify the causal agent of bacterial fruit spot of crisp melon, it was conducted for the bacterial isolation from the symptomatic fruits by plate streaking method in this study. The isolates were tested for pathogenicity assays on the fruit of crisp melon, and the identification by physiological and biochemical tests and molecular methods. A total of 36 bacterial isolates with consistent appearance were recovered from symptomatic tissues. The tested isolates induced hypersensitive reactions on tobacco leaves within 48 h after infiltration and caused water-soaked necrosis in the fruit tissues with the toothpick inoculation method. BLAST results showed that the sequences of 16S rRNA of the two representative strains were 99.93% and 99.58% identity withGR-8 (CP009108) and ATCC 7061(ABRX01000003), respectively. And the sequences ofgene of the two strains were 99.39% identity with that ofC4 (CP011109). Furthermore, a phylogenetic analysis of thesequences showed that the two strains were most closely related toC4 and GR-8 in the phylogenetic tree. The physiological and biochemical tests indicated the characteristics of these bacterial isolates were consistent with those of reference strainsof. Based on the physiological and biochemical characteristics, sequences analysis of 16S rRNA andgene, and verified identified Koch's postulate, the pathogen causing fruit spot of crisp melon was identified as.
crisp melon; fruit spot disease; identification;
S652.908; S436.5
A
1672-352X (2021)01-0052-06
10.13610/j.cnki.1672-352x.20210319.019
2021-3-23 11:15:39
[URL] https://kns.cnki.net/kcms/detail/34.1162.s.20210319.1548.038.html
2019-12-23
合肥市关键技术重大研发项目(ZR201711290010)和安徽省科技重大专项(18030701211)共同资助。
程勋辉,硕士研究生。E-mail:1210385879@qq.com
宋江华,博士,教授。E-mail:jhsong@ahau.edu.cn
