不同添加剂对构树青贮饲料发酵品质及微生物多样性的影响
2021-04-13梁龙飞孙文涛
黄 媛 代 胜 梁龙飞 孙文涛 彭 超 陈 超 郝 俊
(贵州大学动物科学学院草业科学系,贵阳550025)
构树(Broussonetiapapyrifera)作为优质的木本饲料之一,为桑科构树属多年生落叶乔木或灌木,其蛋白质含量高,具有很高的饲用价值[1]。在当前畜牧业迅速发展、蛋白质饲料短缺的情况下,将构树作为饲料使用能够在一定程度缓解饲草资源短缺的问题。研究发现,青贮对构树中木质素或植物纤维具有软化作用,改善构树的适口性[2]。司丙文等[3]研究发现,饲粮中添加杂交构树青贮饲料提高了肉羊的生长性能、免疫力和抗氧化能力。王福传等[4]研究发现,给肉牛饲喂构树青贮饲料能提高其增重。但直接青贮构树会因为原料缓冲能值高、含糖量低等而导致青贮发酵失败[5]。相关研究表明在构树中添加乳酸菌、糖蜜等添加剂能明显改善其营养价值和发酵品质[6-7]。
在青贮过程中,微生物群落的构成和丰度变化会影响发酵品质[8]。因此,全面了解构树青贮开封后微生物的活动规律很有必要,能更好地规避有氧腐败现象。相较于传统的培养方法,高通量测序技术能从更微观的方面研究微生物群落结构的变化,从微生物的种类、丰度等方面解释其多样性。Wang等[9]研究了添加乳酸菌对辣木青贮过程中菌群结构和发酵品质的影响,结果表明添加乳酸菌在提高发酵品质的同时还降低了有害细菌的数量。Dong等[10]研究了多花黑麦草与构树混合青贮过程中菌群结构的动态变化,微生物分析表明乳杆菌属和魏斯氏菌属在整个青贮过程中占优势。有关青贮的研究多是从不同青贮原料、青贮条件等对青贮期间或开封后微生物的影响方面进行探讨,较少将添加剂、青贮品质与微生物多样性结合进行深入探讨。
因此,本试验拟研究不同添加剂对构树青贮饲料发酵品质、有氧稳定性及微生物多样性的影响,旨在为构树饲料化进程提供一定的理论依据和数据支撑,进一步促进构树全产业链的快速发展。
1 材料与方法
1.1 试验材料
构树于2019年6月14日取自贵州省长顺县构树组培基地,为杂交构树,已种植5年,进行第2茬刈割,株高1.8 m左右,刈割留茬高度30 cm左右。构树在刈割后晾晒3.5 h(温度:25 ℃,光照:34.3×103lx),再用铡草机将其切碎至1.5~2.5 cm备用。
糖蜜添加剂主要成分为蔗糖,含糖量约为48%;乳酸菌添加剂主要成分为植物乳杆菌(Laobacillusplantarum)和布氏乳杆菌(Lactobacillusbuchneri),活菌数≥1.0×1010CFU/g;纤维素酶添加剂主要成分为纤维素酶,活性≥30 000 U/g。
1.2 试验设计
以糖蜜作为对照(CK组),在此基础上分别添加纤维素酶(C组)、乳酸菌(L组)、乳酸菌+纤维素酶(LC组),以构树鲜重为基础计算各添加剂的添加量,具体的试验设计见表1。向切碎的原料喷洒加入添加剂的蒸馏水(10 mL/kg),混合均匀后将样品装入聚乙烯青贮袋(28 cm×40 cm),每袋装料为500 g左右,每种处理设3个重复。抽真空机抽真空、密封,室温条件下(25~37 ℃)避光青贮60 d后开封,取样时打开袋,上层2 cm弃用,取袋中间位置的样品混匀,分析营养成分、发酵品质、有氧稳定性,并测定其微生物群落结构。

表1 试验设计
1.3 测定指标及方法
1.3.1 营养成分测定
取青贮样品200 g左右放置于信封内,平铺在105 ℃鼓风干燥箱中,灭酶活20 min左右后在65 ℃烘箱中烘至恒重,用于营养成分测定。干物质(DM)、粗蛋白质(CP)、粗灰分(Ash)、粗纤维(CF)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量参照张丽英[11]的方法测定,水溶性碳水化合物(WSC)含量参考Wang等[12]的方法测定。
1.3.2 pH与发酵品质测定
取青贮样品10 g,加入90 mL蒸馏水,搅拌均匀,4 ℃条件下浸提24 h后再用4层纱布和定性滤纸过滤,得到滤液即为样品的浸提液。测定完pH后置于-20 ℃保存备用,用于发酵品质指标——氨态氮(NH3-N)、乳酸(LA)、乙酸(AA)、丙酸(PA)和丁酸(BA)含量的测定。其中,pH采用上海佑科pH-3C酸度计测定,LA、AA、PA、BA含量采用高效液相色谱法[13]测定,NH3-N含量采用苯酚-次氯酸钠比色法[14]测定,并计算总氮(TN)中NH3-N的占比,即 NH3-N/TN。
1.3.3 有氧稳定性测定
有氧稳定性以有氧稳定时间表示,采用多通路温度记录仪测定。取青贮样品300 g左右于1.5 L敞口瓶塑料桶内,纱布覆盖防止外界微生物污染,将多通路温度记录仪的探头置于饲料中心,同时在环境中放置3个探头,用于监测环境温度,每隔30 min记录1次温度。有氧稳定时间为饲料中心温度超过环境温度2 ℃所用的时间。
1.3.4 微生物多样性分析
1.3.4.1 测序流程
取青贮样品10 g,采用HiPure Soil DNA提取试剂盒进行微生物组DNA的提取,每个样品分别提取3个DNA样本。利用琼脂糖凝胶电泳检测DNA的纯度和浓度,采用PCR扩增细菌细菌16S rDNA的V5~V7区,引物为799F(5′-AACMGGATTAGATACCCKG-3′)和1193R(5′-ACGTCATCCCCACCTTCC-3′)。使用AMPure XP Beads对扩增产物进行纯化,并使用ABI StepOnePlus Real-Time PCR System(Life Technologies,美国)进行定量,将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,根据HiSeq 2500的PE250模式pooling上机测序。
1.3.4.2 信息分析及数据处理
测序得到raw reads,对低质量reads进行过滤,再进行序列拼接、序列过滤、序列去嵌合体等处理,得到优化序列(tags)。用Uparse软件以97%的一致性(identity)对所有样品的优化序列聚类成为操作分类单元(OTU),获得OTU后,根据分析流程,依次进行OTU分析、Alpha多样性分析、微生物群落结构分析等。
1.4 数据统计与分析
试验数据采用Excel 2013软件进行整理,SPSS 20.0进行单因素方差分析(one-way ANOVA),并用Duncan氏法对各组数据进行多重比较,P<0.05表示差异显著,结果用平均值±标准差表示。利用Omicsmart在线平台分析微生物相对丰度,并进行OTU分析、Alpha多样性分析、物种组成分析等。
2 结果与分析
2.1 构树原料特性
构树原料营养成分如表2所示,构树原料DM含量较高,为35.29%;CP含量为19.23%;Ash含量较低,为3.89%;CF含量为17.75%;NDF、ADF含量分别为40.04%、21.75%;WSC含量为7.32%。
2.2 不同添加剂对构树青贮饲料营养成分的影响
由表3可知,与CK组相比,各添加剂组DM、CP和EE含量均显著增加(P<0.05),3个添加剂组之间差异不显著(P>0.05)。添加剂对Ash含量无显著影响(P>0.05)。CK组CF、ADF和NDF含量显著高于C组和LC组(P<0.05)。LC组的WSC含量显著高于其余各组(P<0.05),ADF和NDF含量显著低于CK组和L组(P<0.05)。
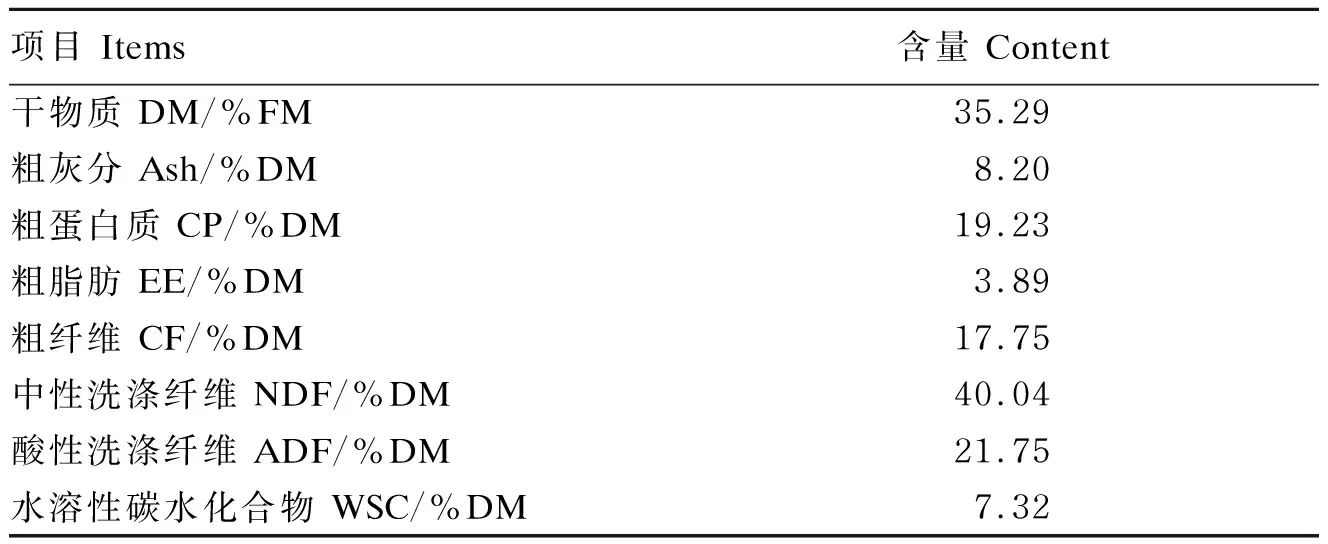
表2 构树原料营养成分

表3 不同添加剂对构树青贮饲料营养成分的影响
2.3 不同添加剂对构树青贮饲料发酵品质的影响
由表4可知,所有组的pH均低于4.2,各添加剂组pH显著低于CK组(P<0.05)。CK组LA含量显著低于各添加剂组(P<0.05),AA含量显著低于C组和LC组(P<0.05),其中L组LA含量最高,LC组AA含量最高。所有组均检测到少量PA,其中L组显著低于其余各组(P<0.05),且各组均未检测到BA。所有组的NH3-N/TN均小于10%,且CK组显著高于其余各组(P<0.05)。

表4 不同添加剂对构树青贮饲料发酵品质的影响
2.4 不同添加剂处理对构树青贮饲料有氧稳定性的影响
由表5可知,CK组的有氧稳定时间最短(126 h),LC组能够保持12 d不腐败,有氧稳定性最好,整体呈现的有氧稳定时间为LC组>C组>L组>CK组。
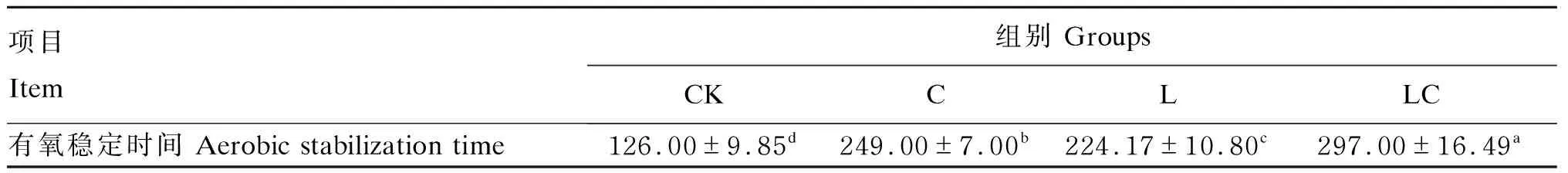
表5 不同添加剂对构树青贮饲料有氧稳定性的影响
2.5 不同添加剂对构树青贮饲料微生物多样性的影响
2.5.1 Alpha多样性分析
表6中数据为构树青贮开封后的微生物Alpha多样性指数。所有组的覆盖度(coverage)均大于0.99,说明测序深度基本全面覆盖微生物的核心组成。总体来看,样本序列数量较大,Chao指数、Ace指数等指标均处在较高的水平,说明样本菌群数量较大,丰度较高,多样性水平也相对较高。相较于CK组,所有添加剂组的Chao指数、Ace指数均有所降低,表明菌群的丰度降低;Simpson指数也有所降低,说明菌群多样性降低。上述结果说明在添加糖蜜的基础上添加乳酸菌、纤维素酶及二者混合添加影响了构树青贮饲料微生物群落的多样性。
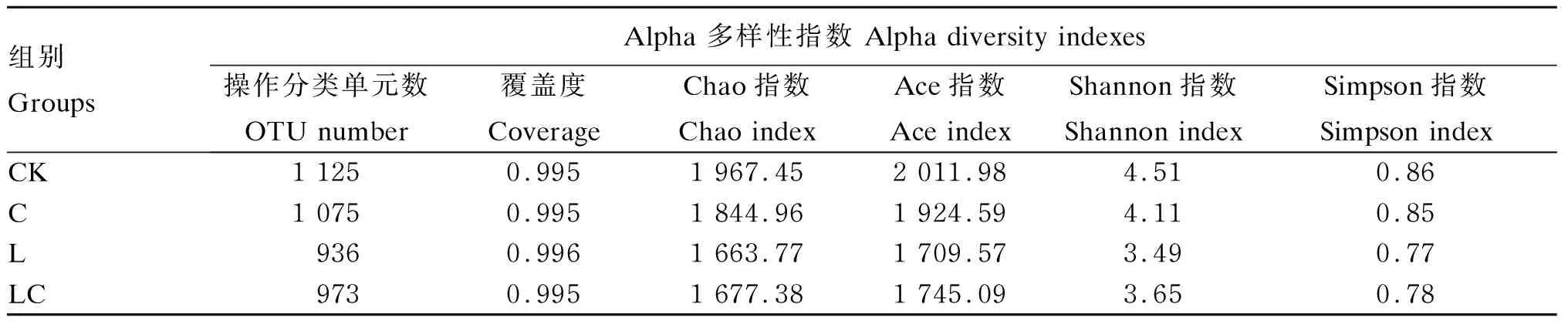
表6 不同样本的Alpha多样性分析
2.5.2 基于门水平的微生物群落结构分析
基于门水平的构树青贮饲料微生物群落结构如图1所示。各组的优势菌门均为厚壁菌门(Firmicutes),其次是变形菌门(Proteobacteria)。除此之外,拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)有少量存在。C组、L组和LC组厚壁菌门的相对丰度相较于CK组(92.45%)均增加,分别达到97.73%、98.16%、98.56%,同时变形菌门的相对丰度降低。这说明添加纤维素酶、乳酸菌以及二者混合添加均可以提高构树青贮饲料中厚壁菌门所占比例,降低变形菌门所占比例。

Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Actinobacteria:放线菌门;Bacteroidetes:拟杆菌门;Fusobacteria:梭杆菌门;Verrucomicrobia:疣微菌门;Acidobacteria:酸杆菌门;Deinococcus-Thermus:栖热链球菌门;Other:其他;Unclassified:未分类的。
2.5.3 基于属水平的微生物群落结构分析
基于属水平的构树青贮饲料微生物群落结构如图2所示。CK组的优势菌属为魏斯氏菌属(Weissella),相对丰度为59.19%,其次为肠球菌属(Enterococcus),相对丰度为18.14%,之后是乳杆菌属(Lactobacillus),相对丰度为6.00%。C组的优势菌属依次为肠球菌属(相对丰度为42.00%)、魏斯氏菌属(相对丰度为38.72%)和乳杆菌属(相对丰度为12.87%),L组的优势菌属依次为肠球菌属(相对丰度为60.54%)、乳杆菌属(相对丰度为19.30%)和魏斯氏菌属(相对丰度为16.27%),相较于CK组,L组、C组肠球菌属、乳杆菌属的相对丰度增加,魏斯氏菌属的相对丰度降低。LC组的优势菌属为肠球菌属(相对丰度为68.32%),其次为乳杆菌属(相对丰度为12.58%)、魏斯氏菌属(相对丰度为15.99%)。
3 讨 论
3.1 不同添加剂对构树青贮饲料营养成分的影响
与青贮前相比,各组构树青贮饲料的DM含量均降低,其中CK组下降最多(4.96%)。这可能是由于CK组没有额外添加乳酸菌,生产乳酸较慢且总量少,同时WSC含量较高,有害微生物迅速增殖造成大量DM损失[15]。CP是青贮饲料的主要营养成分之一,蛋白质的降解会影响牧草的营养价值,进而影响家畜的DM采食量[16]。各添加剂组构树青贮饲料的CP、DM含量较CK组均有不同程度的增加,与张新平等[17]在苜蓿青贮中添加乳酸菌和纤维素酶能较多保存CP的结果一致。这主要是由于青贮过程中乳酸大量产生,pH显著降低,进而抑制了植物蛋白酶和微生物对蛋白质的降解,减少了DM损失,提高了CP含量,同时失活细菌保存在青贮饲料中也增加了菌体蛋白的含量[18]。各组构树青贮饲料的Ash、EE含量较青贮前有一定程度的增加,主要是由于青贮过程中WSC等有机物质的损失,使得这些成分的比例有所提高。
WSC作为青贮发酵的底物,会被乳酸菌分解产生乳酸,从而使青贮饲料的pH降低[19]。本试验中L组较CK组有更低的WSC含量,可能是由于添加乳酸菌后,乳酸菌利用WSC增殖,导致其含量显著降低,与公美玲[20]的研究结果一致。C组主要是因为纤维素酶的添加降解了细胞壁结构[21],所以较CK组WSC含量升高,提高了发酵品质。各组的纤维也较青贮前发生了不同程度的降解,其中C组CF含量最低,是由于纤维素酶能降解纤维素、半纤维素等,促进了细胞壁分解[22]。此外,本试验中各组的ADF和NDF含量较青贮前均有不同程度降低,与任海伟等[23]研究结果一致,主要是因为纤维素酶的添加破坏了纤维间的氢键,释放出细胞内容物,生成了单糖[24],也可能是由于较低的pH构成的酸性环境促进了细胞壁成分的酸解作用[25]。本试验中LC组的ADF和NDF含量在青贮后下降的最多,可能是因为乳酸菌与纤维素酶混合添加于青贮中表现出协同作用,使二者功效得到加强[26]。青贮后,与NDF相比,ADF的降解量较少,这是由于ADF中含有大量的木质素,短时间内较难被微生物降解[27]。
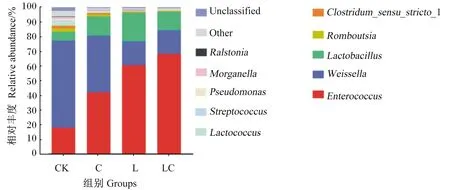
Enterococcus:肠球菌属;Weissella:魏斯氏菌属;Lactobacillus:乳杆菌属;Romboutsia:罗姆布茨菌属;Clostridum_sensu_stricto_1:狭义梭菌属1;Lactococcus:乳球菌属;Streptococcus:消化链球菌属;Pseudomonas:假单胞菌属;Morganella:摩根氏菌属;Ralstonia:青枯菌属;Other:其他;Unclassified:未分类的。
3.2 不同添加剂对构树青贮饲料发酵品质的影响
pH、有机酸是衡量青贮饲料发酵品质的重要指标,品质优良的青贮饲料的pH在3.8~4.2[28]。本试验中CK组pH为4.17,各添加剂组pH较CK组均有不同程度的降低,与李宝明等[29]的研究结果一致。这主要是由于糖蜜的添加为乳酸菌提供了更多的发酵底物,发酵后产生LA,使pH显著降低[30]。L组由于额外添加了乳酸菌,使得发酵初期乳酸菌总量较其他组高,因此发酵产生大量LA。AA主要是由于异质型乳酸菌产生,具有较强的抗真菌能力[31]。本试验中各添加剂组AA含量较CK组都有所增加,L组AA的含量与CK组差异不显著,说明添加的乳酸菌制剂中植物乳杆菌在占主导,发酵产物主要为LA,进一步印证了本试验中各组LA含量的差异结果。BA由腐败菌分解蛋白质、乳酸产生,BA含量越低,饲料的发酵品质越好[32]。本试验中各组均未检测出BA,只形成少量PA。这是由于各组的发酵底物充足,添加添加剂形成的较低pH环境抑制了有害微生物的增殖[33],同时也可能与构树本身具有黄酮类物质,而黄酮类物质具有抑菌作用有关[34]。
NH3-N主要由梭菌等有害微生物以蛋白质为营养进行增殖和植物蛋白酶分解蛋白质产生[35]。NH3-N含量反映了青贮饲料蛋白质降解的程度,本试验中各组的NH3-N/TN均小于10%,达到了优质青贮饲料标准[36]。各添加剂组NH3-N/TN显著低于CK组,其中LC组最低,L组次之。这主要是由于CK组pH降低速度较其余组慢,梭菌等有害微生物以蛋白质为营养增殖,从而产生较多的NH3-N。而添加乳酸菌后形成的较低pH环境抑制了有害微生物和植物蛋白酶的活性,产生的NH3-N较少,且2种添加剂混合添加效果更加明显,与钟书等[37]的研究结果一致。
3.3 不同添加剂对构树青贮饲料有氧稳定性的影响
有氧稳定时间越短说明有氧稳定性越差,越容易发生有氧腐败[18]。在贵州温暖湿润的气候条件下,青贮饲料更容易腐败变质。但本试验中所有组的有氧稳定性均较好,具体表现为LC组>C组>L组>CK组。因为添加基础糖蜜后发酵底物充足,造成较低pH环境,从而抑制了腐败菌的增殖。同型发酵乳酸菌产生的短链脂肪酸(AA、PA、BA)较少,更容易引起好氧变质。异型发酵乳酸菌对真菌有一定的抑制作用,有助于有氧稳定性的提高[38]。L组有氧稳定时间高于CK组,是由于添加的乳酸菌为复合乳酸菌,异型发酵乳酸菌在开封后可分解LA产生AA,抑制好氧变质,延长了有氧稳定时间[39]。C组有氧稳定时间延长主要是由于添加的纤维素酶抑制了腐败菌的增殖[40]。
3.4 不同添加剂对构树青贮饲料微生物多样性的影响
青贮过程是一个复杂的微生物共生的体系,多种微生物共同参与,因其结构与多样性影响着发酵品质与营养成分[41]。本研究采用高通量测序技术对添加不同添加剂的构树青贮后微生物群落结构进行分析,从丰度、结构等定义微生物的多样性。Alpha多样性分析包括了绝大部分微生物的信息,可知添加剂的不同影响到了微生物群落的结构。各组的优势菌门均是厚壁菌门,占据很高的比例,其次是变形菌门。各添加剂组厚壁菌门的相对丰度较CK组都是增加的趋势,其中LC组的相对丰度最高,其次是L组、C组。厚壁菌门是一大类细菌,多数为革兰氏阳性,可以产生芽孢抵抗脱水和极端环境,很多芽孢杆菌可以降解纤维素、淀粉、蛋白质等多种大分子化合物[42]。变形菌门是细菌中最大的一个门类,为革兰氏阴性菌,包括很多病原菌,如大肠杆菌、沙门氏菌、幽门螺杆菌等著名种类[43]。变形菌门的相对丰度随着厚壁菌门相对丰度的升高而相应降低,说明添加乳酸菌、纤维素酶及二者混合添加会减少变形菌门的比例,降低有害微生物的数量,从而降低致病菌对家畜健康存在的潜在风险。
CK组的优势菌属为魏斯氏菌属,各添加剂组的优势菌属是肠球菌属,其次为乳杆菌属。各添加剂组乳杆菌属的相对丰度均高于CK组,说明构树青贮中添加发酵促进剂后,加强了产乳酸的能力,降低了饲料pH,抑制了有害微生物的繁殖[6]。本研究中添加发酵促进剂后使得魏斯氏菌属的相对丰度降低,与杨杨等[44]研究得出的魏斯氏菌属数量在青贮初期较高,发挥作用较大,在青贮后期数量下降的结果一致。以往相关研究[45-46]所得优势菌属不尽相同,可能是由于青贮原料、取样区域等不同导致的。
4 结 论
在添加糖蜜的基础上单独或混合添加乳酸菌与纤维素酶对构树青贮饲料的营养价值、发酵品质及有氧稳定性均有不同程度的提升,并可增加厚壁菌门、肠球菌属及乳杆菌属的相对丰度,同时降低变形菌门、魏斯氏菌属的相对丰度。综合考虑,以乳酸菌与纤维素酶混合添加时效果最佳。
