kartogenin 对骨关节炎的治疗作用机制及其在软骨组织工程学中应用的研究进展
2021-04-13张诗晨金丽鸥郑晓雪王众泽
张诗晨, 金丽鸥, 李 跃, 郑晓雪, 王 婧, 魏 欣, 王众泽, 韩 冰
(1. 吉林大学口腔医院颌面外科,吉林 长春 130021;2. 吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021)
骨关节炎(osteoarthritis, OA) 是一种关节退变性疾病,特点为慢性疼痛、关节炎症及运动受限,在中老年群体中发病率较高,严重影响患者的生活质量并给社会造成极大负担[1-2]。关节软骨组织无血管和神经支配,细胞迁移率低,前体细胞数量少,自我修复能力有限[3]。目前,软骨缺损的临床治疗方法主要包括微骨折术、镶嵌式成形术、自体软骨细胞植入术和基质诱导的自体软骨细胞植入术等,然而这些治疗方法对天然关节软骨结构和功能的恢复效果有限[4]。近年来,间充质干细胞(mesenchymal stem cells, MSCs) 因具有多向分化、免疫抑制和免疫调节能力被认为是治疗软骨缺损最有前景的细胞类型[3],但直接移植MSCs 治疗OA 仍具有局限性,如较高的细胞丢失率和死亡率、纤维软骨的形成以及向非软骨细胞的其他细胞类型分化等[5-6]。此外,常被用于诱导MSCs 发生成软骨分化的转化生长因子β3 (transforming growth factor-β3,TGF-β3) 也因其较短的半衰期以及对软骨肥大和软骨内骨化的诱导等缺陷而造成治疗失败[4,7]。因此,软骨缺损和OA 的治疗仍然是主要的临床挑战。 kartogenin (KGN)是近年来发现的小分子杂环物质,其结构为1 个4-氨基联苯(4-aminobiphenyl, 4-ABP) 和1 个邻苯二甲酸通过 酰 胺 键 相 连 而 成[8]。JOHNSON 等[9]最 早 发 现KGN 可通过促进骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs) 增殖和成软骨分化修复软骨缺损而不影响软骨肥大化相关基因的表达,证明了其促进软骨再生的潜力。此后的大量研究在补充KGN 促进软骨再生修复机制的同时,还揭示了其缓解和治疗OA 的其他作用机制。此外,大量研究利用KGN 分子结构上的羧基、氢键供体位点及氢键受体基团将其以物理结合或化学交联的方法应用于软骨组织工程学中的各类载体,既克服了KGN 高度疏水及存留期短的缺点,也为OA 的软骨组织工程学治疗带来新的思路[5]。近年来,国内外关于KGN 的研究越来越多,但综述类文章较少且均侧重于KGN 促进软骨再生修复的机制及其应用,而缺乏其对OA 治疗作用机制的系统性阐述,对KGN 在软骨组织工程学应用方面的总结也并不全面。本文作者强调KGN 对OA 的治疗作用,并就其作用机制及其在软骨组织工程学中的应用进行全面总结。
1 KGN 对OA 的治疗作用机制
1.1 KGN 促进软骨再生修复
1.1.1 KGN 促进软骨再生修复相关信号通路
KGN 促进软骨再生修复主要是通过促进MSCs的增殖和成软骨分化实现的。JOHNSON 等[9]发现KGN 促进MSCs 成软骨分化的作用主要与其调节核心结合因子β 亚基(core-binding factor β subunit, CBFβ)-Runt相关转录因子1 (Runtrelated transcription factor 1, RUNX1) 转录程序有关。KGN 与细丝蛋白A (filamin A, FLNA)的结合破坏了FLNA 与CBFβ 结合所产生的隔离作用,使得CBFβ 转运至细胞核并与其中的RUNX1结合从而调节转录,促进成软骨分化。通过对此转录程序以及刺猬因子信号通路和TGF-β 信号通路的激活,KGN 还可促进胚胎关节的发育[10]。ZHANG 等[8]发现虽然口服KGN可以减轻OA 的软骨损伤,但在软骨中仅发现了KGN 水解产物4-ABP 的存在,且4-ABP 促进MSCs 增殖和成软骨分化的能力更强,而KGN 可能为其前药形式。进一步研究发现4-ABP 的上述作用是通过激活磷脂酰肌醇3-激酶/蛋白激酶B信号通路实现的,RSK-3为其潜在靶点,从而使得对RSK-3 进行功能调节可能成为促进OA 软骨再生的有效策略。另有研究[11]发现:KGN 还可以通过激活腺苷酸活化蛋白激酶—沉默信息调节因子1 (silent information regulator type 1, SIRT1) 信号通路刺激BMSCs的增殖。ZHOU 等[12]使用搭载了骨形态发生蛋白7 (bone morphogenetic protein 7, BMP-7) 基因的慢病毒过表达载体对滑膜间充质干细胞(synovial-derived mesenchymal stem cells,SMSCs)进行转染,发现BMP-7 可以进一步调节其下游的Smad5 和4 种软骨表型基因的表达,当BMP-7 被沉默后,KGN 对BMP-7 与Smad5 表达的促进作用被明显抑制,证明了KGN 促进MSCs 的成软骨分化作用还可以通过激活BMP-7/Smad5 信号通路实现。
1.1.2 KGN 利用旁分泌机制促进软骨再生修复大量信息表明包括胞外小泡和外泌体在内的旁分泌机制在调节细胞分化、增殖和代谢活动等方面起到不可或缺的作用。小细胞外囊泡(small extracellular vesicles, sEVs)包括50~200 nm 的外泌体和小微泡,内部包含多种生物活性分子,如蛋白质和核酸,转移到受体细胞后可调节其功能。JING 等[13]将sEVs 从KGN 预处理后的人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUCMSCs)中分离出来,发现当其重新被hUCMSCs 内化后,细胞内miR-381-3p 水平明显升高,并可靶向作用于丝氨酸/苏氨酸蛋白激酶1 的3'非翻译区抑制Hippo信号通路,促进hUCMSCs的成软骨分化,与使用包括TGF-β 和胰岛素样生长因子等在内的激素合剂效果相当。此外,MSCs 与KGN-sEV 的联合应用还可明显修复体内软骨缺损。LIU 等[2]成功地将经KGN 预刺激(KGN-BMSCExos)和未经刺激(BMSC-Exos)的BMSCs 所产生的外泌体分离出来并研究了两者对已分化软骨细胞的影响以及对软骨缺损的修复作用;体内和体外实验研究发现:两者均可通过调节软骨细胞代谢促软骨再生和基质形成。 与BMSC-Exos 比较,KGN-BMSC-Exos 的作用更强并可保持已分化软骨细胞的表型,形成的基质中Ⅱ型胶原(collagen Ⅱ,COL Ⅱ)的水平及COL Ⅱ/Ⅰ型胶原(collagen Ⅰ,COLⅠ)的比值较高,与天然软骨基质相似,而且规避了前者对RUNX1 表达抑制的缺陷。另外,与上述实验相同浓度的KGN 在缺乏辅助因子的情况下并未对软骨细胞产生影响,说明微量的KGN 可通过外泌体获得更高的疗效,证明了KGN-BMSCExos 作为一种非细胞制剂治疗OA 的优势[2]。
1.1.3 KGN 与TGFβ-3 协同促进软骨再生修复FAN 等[14]发现KGN 与TGF-β3可协同促进MSCs 成软骨分化,前者的作用与其抑制RUNX1降解有关,而后者与其对Smad3 的激活有关,免疫共沉淀分析证明此协同作用由p-Smad3 与RUNX1 在MSCs 细胞核内相互作用所产生[14]。SHI 等[15]将KGN 与TGF-β3 和BMP-2 联合应用时发现:KGN 明显提高了MSCs 的增殖和成软骨分化速度,且明显降低了COL Ⅰ的表达[15]。有研究[10,16]在比较TGF-β3 和KGN 对人脂肪干细胞成软骨分化的影响时发现: KGN 组X 型胶原(collagen X,COL X)表达水平明显低于TGF-β3组,证明了KGN 对软骨肥大的抑制,这可能与KGN 激活Smad2/3 通路,抑制Smad1/5/8 通路进而抑制RUNX2 的表达有关,表明两者的协同作用既可体现在TGF-β3 对KGN 促软骨再生作用的提高又可体现在KGN 对TGF-β3 诱发软骨肥大作用的抑制[4]。JING 等[17]发现:将KGN 的预处理与TGF-β3 的应用结合起来不仅较两者单独应用时明显提高了hUCMSCs 成软骨基因的表达,而且还明显抑制了后者对骨化基因表达的提高,稳定了软骨细胞表型。进一步使用c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)抑制剂和β-连环蛋白(β-catenin)激活剂进行研究发现:KGN 的预处理可以使MSCs 进入一种JNK 磷酸化增加伴β-catenin表达下调的软骨前体细胞状态,然后在TGF-β3 的诱导下可通过激活JNK/RUNX1 通路,抑制β-catenin/RUNX2 通路在提高TGF-β3 促进软骨形成作用的同时抑制软骨内骨化的发生,从而对TGF-β3 诱导成软骨分化作用产生双重优势。
1.2 KGN 对软骨和软骨细胞的保护作用
JOHNSON 等[9]发现KGN 明显抑制了在肿瘤坏死因子α 和抑瘤素M 刺激下软骨细胞的NO 释放量及软骨外植体中糖胺聚糖(glycosaminoglycan,GAGs) 的释放量。此外,关节内注射KGN 后外周血中软骨寡聚基质蛋白(cartilage oligomeric matrix protein, COMP)水平的降低也证明了OA严重程度的下降[9]。研究[18]表明:KGN 可以保护由IL-1β 损伤后的软骨细胞、新生软骨和软骨外植体。在IL-1β 存在的情况下,KGN 既可以通过降低含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶 5 (a disintegrin and metalloproteinase with thrombospondin motifs 5,ADAMTS-5) 的表达抑制聚集蛋白聚糖(aggrecan)的分解,还可以通过抑制CD44 蛋白裂解将透明质酸(hyaluronic acid,HA) 和aggrecan 锚定在软骨细胞表面。相反,KGN 对软骨细胞特异性基因,如COLⅡ、aggrecan和Sox9 的表达无明显影响,且仅可在IL-1β 存在时提高Smad1 的磷酸化,证明其对已分化软骨细胞的保护作用主要体现在广泛的抗降解作用而非促进合成[18]。白细胞介素10(interleukin-10,IL-10)是一种体内、体外典型的抗炎症细胞因子,对炎症反应、基质金属蛋白酶(matrix metalloproteinases,MMPs) 的表达和破骨细胞的生成均具有抑制作用。研究[1]表明:KGN 可以通过增加IL-10 和金属蛋白酶组织抑制因子3 的表达而抑制炎症及MMPs 的表达,并可阻碍由RANKL 介导的破骨细胞分化和激活,进而减缓OA 的发展和软骨的破坏,而IL-10 的增加与KGN 促进调节T 细胞分化的作用有关。MOHAN 等[19]使用前十字交叉韧带横切术(anterior cruciate ligament transection,ACLT)构建了大鼠膝关节OA 模型并于术后每周在关节内注射125 μmol·L-1KGN,术后第3、6 和12 周使用磁共振成像(magnetic resonance imaging,MRI)检查发现KGN 抑制了软骨基质破坏及其生化改变;此外,血清COMP 和Ⅰ型胶原C 端肽(C-terminal telopeptide of typeⅠcollagen,CTX-Ⅰ)水平低于对照组,说明KGN 降低了软骨和骨的转换率。
1.3 KGN 对lubricin 表达和分泌的促进作用
lubricin,也被称为表层区域蛋白或蛋白多糖4(proteoglycan 4, PRG4),由PRG4 基因编码,是一种由表层软骨细胞和滑膜细胞分泌至滑膜液中的糖蛋白,位于软骨表面,可以通过自我消耗性的边界润滑机制降低关节软骨的摩擦磨损系数,对软骨的稳定起到重要作用[20-21]。研究[9]发现:KGN 可以通过促进MSCs 的成软骨分化提高软骨细胞特异性蛋白lubricin 的合成。LIU 等[20]将KGN 与TGFβ1 和BMP-7 进行组合后应用于BMSCs,发现三者联用时促进lubricin 合成和分泌的作用最强,可产生协同作用,且KGN 的贡献最为显著;三者联用组中c-Myc 和adamts-5 的表达明显下降,证明了lubricin 水平的升高与合成的增加和分解的减少均有密切关联。而后,该团队[22]将KGN 与软骨细胞和BMSCs 联合培养,发现该培养体系的软骨形成作用明显提高,而无需外源性细胞因子的介入;其中lubricin 表达的升高较COL Ⅱ和GAGs 具有延迟性,通过改变此培养基中2 种细胞的比例可以控制lubricin 高表达的时间进而对不同类型软骨缺损进行时空调控。另外,此研究中KGN 的加入对已分化软骨细胞中lubricin、COL Ⅱ和GAGs 的表达并无明显影响。MIYATAKE 等[21]研究了KGN 对单层和微团培养软骨细胞及关节软骨外植体表层软骨细胞的影响,结果发现:KGN 虽然在与TGFβ-1联用时提高了lubricin mRNA 表达水平,但对3 个体系中软骨细胞以及单层培养滑膜细胞中lubricin蛋白表达水平并未产生影响。故该团队认为:KGN 对细胞的影响可能与其成熟程度有关,随着细胞的成熟与分化,KGN 的作用逐渐下降,这与DECKER 等[10]的研究结果一致。然而,DECKER 等[10]在KGN 处理的胚胎肢芽外植体中未能发现lubricin 的明显表达,并认为这与肢芽的年龄过小且缺乏驱化空化所需要的肌肉运动有关;进一步研究发现:Prg4-mCherry 报告基因小鼠的膝关节表层关节细胞在KGN 的刺激下于产后第2 天表现出强烈信号并在28 d 内逐渐加强。这表明除细胞的成熟程度外,KGN 对细胞的作用可能还取决于供体的成熟和分化程度。
1.4 KGN 对软骨下骨的保护和改建作用
除软骨外,软骨下骨也参与了OA 的起始和进展。软骨下骨由软骨下骨板和下方的小梁状骨组成,可通过运输生长因子和细胞因子影响软骨代谢。有研究[11]发现:OA 的发病机制与异常的骨重塑密切相关,而早期的OA 常出现软骨下骨重塑的增加。目前,已有以软骨下骨为靶点治疗OA 的相关研究[19]报道。有研究[23]将微骨折术与术后关节内注射KGN 结合起来治疗兔关节软骨全厚缺损,结果发现:不仅透明软骨含量得到明显提高,软骨下骨也得到适当改建,改良O’Driscoll 组织学评分中软骨下骨相关项目评分较对照组明显升高。MOHAN 等[19]使用MRI 对胫骨和股骨软骨下小梁骨进行检查时发现:OA 模型组骨体积分数项中股骨内、外髁和胫骨内、外侧的数值以及骨小梁数项中股骨外髁和胫骨内侧的数值均明显下降,而KGN 的使用明显抑制了这些数值改变,且MircoCT 定量分析也发现KGN 治疗组中软骨下骨板较对照组更为完整。WANG 等[11]发现KGN 可以通过激活AMPK-SIRT1 信号通路促进BMSCs 的成骨分化。KGN 对AMPK-SIRT1 通路的激活降低了细胞内活性氧(reactive oxygen species,ROS)的水平并提高了细胞内抗氧化酶的表达,因而提高了BMSCs 的抗氧化特性,而抗氧化性有助于MSCs 的成骨分化,结合SIRT1 本身对BMSCs 成骨定向分化所起到的重要调节作用,证明了KGN对OA 软骨下骨组织改建的潜能,有利于MSCs 在骨组织工程中的临床应用。
1.5 KGN 对OA 疼痛的缓解作用
JOHNSON 等[9]使用测痛仪检测了关节内注射KGN 对急性手术诱导大鼠OA 模型所产生痛觉的影响,结果发现:1 μmol·L-1KGN 组较空白损伤组有显著改善,且无明显不良反应。另有研究[1]发现:KGN 抑制了由碘乙酸钠诱发的大鼠关节炎的疼痛反应,提高了关节炎模型的缩足反射潜伏期、撤足阈值(paw withdrawal threshold, PWT)和承重能力。免疫组织化学分析显示:KGN 降低了模型鼠背根神经节(dorsal root ganglion, DRG)中降钙素基因相关肽等疼痛因子的表达。此外,IL-10 基因敲除关节炎小鼠的PWT 较对照组下降,且DRG 的结构受到破坏,体内、体外实验中KGN对IL-10 表达的提高作用,证明了KGN 对OA 疼痛的缓解是通过抑制炎症反应实现的。
2 KGN 在软骨组织工程学中的应用
2.1 纳米级和微米级聚合物
为提高KGN 的溶解性和稳定性,延长其在关节内的存留时间并控制其释放, 大量研究[7,14-15,24-32]选择纳米材料并以纳米颗粒、纳米纤维和纳米管等形式作为KGN 的药物运输载体(表1),这些聚合物或直接用于关节内注射,或与其他治疗性细胞和(或)生物活性分子共同搭载于聚合物支架上用于修复软骨缺损,均得到了较好的效 果。ALMEID 等[5]制备了3种载KGN纳米颗粒,包括疏水带负电的聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]、亲水带正电 的PLGA-聚乙二醇[poly (ethylene glycol),PEG]和亲水带负电的PLGA-PEG-HA 纳米颗粒,并对其理化性质、悬浮稳定性及KGN 释放特点等方面进行研究,结果发现:疏水的PLGA 粒径最小,但悬浮稳定性较好,载药率可达47%但释药率最低,而其余2 种亲水性纳米颗粒粒径较大,但载药率仅为13%~16%,释药率较高且内化作用强,证明了纳米颗粒的表面功能化对其理化性质、释药性和悬浮稳定性等方面的影响,再结合疏、亲水性颗粒与MSCs 之间会出现表面缔合和内化的差异现象,有助于KGN 纳米载体的设计。
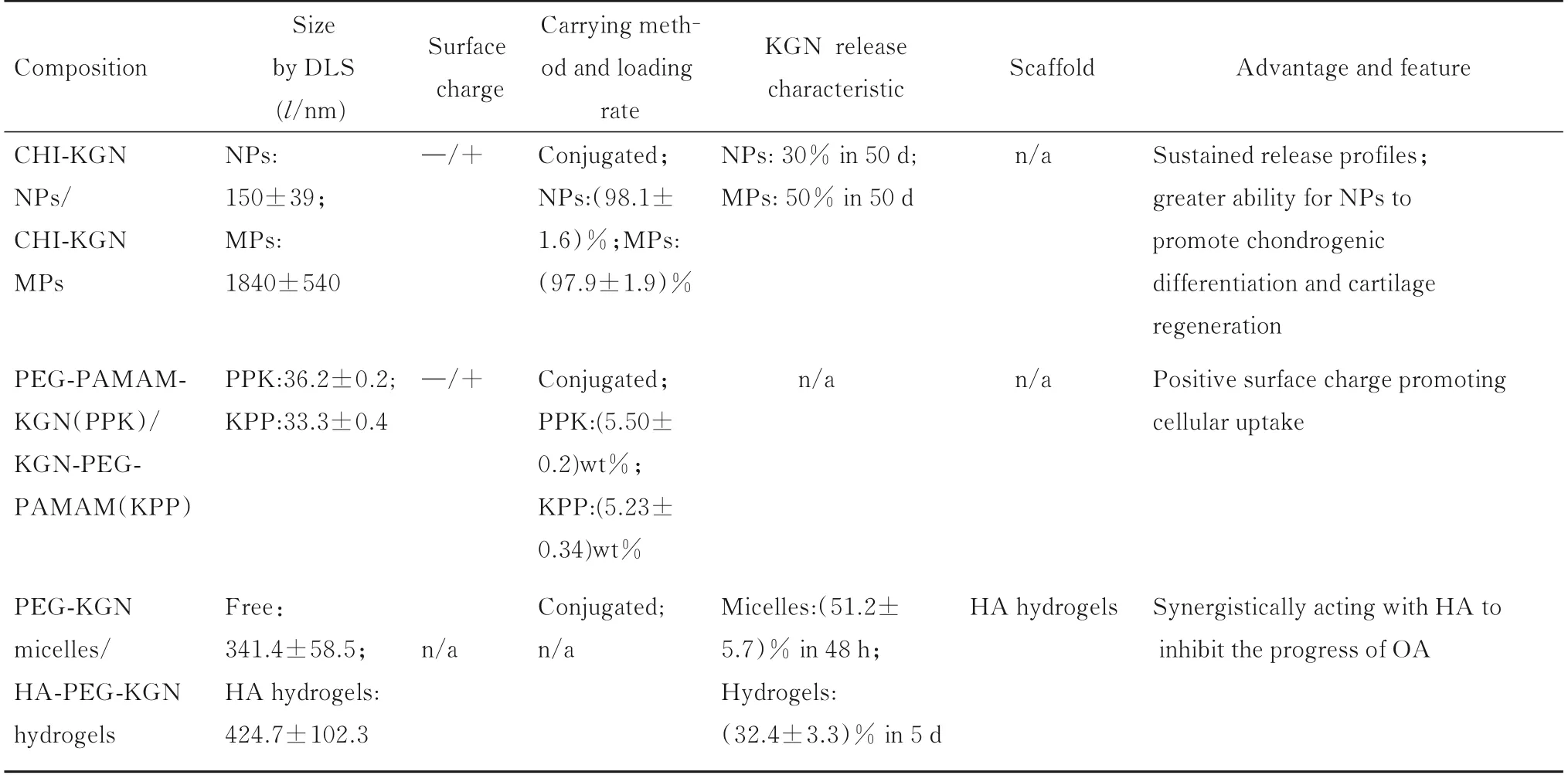
续表
除纳米聚合物外,能延缓释放、降低毒性并提高药效的先进微技术也在广泛开展。MAUDENS等[33]将纳米技术与微颗粒结合构建了一种内部嵌有直径为320 nm 的KGN 纳米晶体聚合物颗粒(KGNNPPs),颗粒直径为13.81 μm,载药率达31.5%,药物释放量可在超过90 d 内保持在半数有效浓度(EC50)以上。此外,颗粒的基质由聚乳酸-Cy7 构成,可用于活体荧光定位。SUN 等[34]使用PLGA包载KGN 形成微球,并将其搭载在COL/CHI/HA 多孔支架上,通过调节微球大小和透明质酸钠(hyaluronic acid sodium, HAS)的含量, 可 使KGN 在21 d 内累计释放率超过90%。另有研究[35]将PLGA-KGN 微球及包含TGF-β1 的纳米颗粒搭载于表层为COL/CHI/HAS, 过渡层为COL/CHI/丝素蛋白的双层多孔支架上,对软骨缺损也起到了极佳的修复效果。
2.2 水凝胶
目前,多种聚合物制成的水凝胶因可提供高含水量的三维微环境而有利于MSCs 在生物活性分子诱导下进行成软骨分化和软骨再生,且水凝胶已作为治疗性细胞和药物载体用于关节软骨的修复[6,14]。LI 等[36]合成了一种PLGA-PEG-PLGA温敏性三嵌段式水凝胶用于联合搭载KGN 及BMSCs 修复软骨缺损,KGN 物理混合于其中,196 h 可累计释放约42.2%。此凝胶含量为20 wt%时的临界成胶温度为31 ℃,低于正常体温,在37 ℃下的平均储能模量可达1.018 kPa。对兔膝关节全层骨软骨缺损模型的研究[36]发现:Gel/KGN/BMSCs 组表现出了最佳修复效果,应用12周后即可完整修复缺损,且再生软骨的机械性能与正常软骨相似。WANG等[37]将搭载了KGN 的PLGAPEG-PLGA 温敏性水凝胶应用于兔膝关节ACLT模型,3 周后发现KGN 组的软骨修复效果最好且关节炎症最轻。LEE 等[38]将扁桃体来源的MSCs、KGN 及由RGD 包被的层状双氢氧化物共同结合于PEG-聚(L-丙氨酸)-聚(L-天冬氨酸)嵌段式水凝胶中构成了一种新型2D/3D 纳米复合物系统,该系统于37 ℃成胶,储能模量达750~820 Pa,可持续释放KGN超过21 d。针对软骨和软骨下骨在细胞类型与基质组成方面的差异,有研究[39]设计了可良好结合并形状可调的光交联双相水凝胶,其上、下层组成不同,可同时应用于软骨缺损及软骨下骨缺损中。该水凝胶软骨层的压缩模量可达(62.7±7.3) kPa,由丙烯酸异氰乙酯修饰的β-环糊精(β-cyclodextrin, β-CD) 及甲基丙烯酰HA构成,KGN 可通过主客体作用搭载于前者的疏水腔内;且HA2CD2组中KGN 在24 d 内的释放量可从42%累计至88%,而在修饰的β-CD 含量提高的HA2CD4组中,KGN 在28 d 内的释放量从25%增至80%,较前者有所延迟;对兔骨软骨交界缺损的实验结果表明:该双相水凝胶可通过部位特异性方式高效修复骨软骨缺损,为生物材料在组织修复中的应用提供了新的化学方法。此前,XU 等[6]利用主客体作用制备了由丙烯酰β-CD 及甲基丙烯酰明胶组成的光交联水凝胶,KGN 搭载于β-CD的部分疏水腔内,可以稳定且速度持续地释放28 d,且该胶体内较弱的主客交联有助于内源性成骨细胞修复软骨下骨。
2.3 其他聚合物支架
有研究[40]使用PGS 和聚癸二酸丙二酯制备了一种形状记忆型支架,KGN 共价交联于其中,支架孔隙率可达(90±2)%,压缩模量为(0.30±0.03) kPa,12 周KGN 的累计释放率可达(76±2)%。该支架的形状记忆性可使其由初始形态在高温下被加工成高度压缩态,室温下临时压缩态稳定,而微创植入体内后可在体温下恢复至初始形态,形状回复率和形变固定率可达97%和98%,降低了支架植入时造成的组织损伤;体内实验证明:该支架可招募内源性MSCs,无需外源性生长因子或种子细胞即可促进软骨修复,且所形成组织与正常软骨组织相似。另有研究[41]制备了一种含有氨基的聚醚酯氨酯脲基[poly (ether-esterurethane) urea-amino, PEEUUN] 支架,共价交联搭载KGN,支架孔隙率达(83.7±3.3)%,杨氏模量为(7.47±0.12)kPa,在31 d 内KGN 累计释放率约42%。该支架弹性较好,可以承受60%的压缩应变,压力释放后可恢复至初始形状。对兔膝关节全厚软骨缺损进行体内实验结果显示:12 周后PEEUUN-KGN 组修复质量最高,且缺损边缘和底部与正常组织融合良好。
3 结 语
综上所述,KGN 可以在多个方面延缓及治疗OA。此外,采用物理结合或化学交联的方法将KGN 搭载于多种聚合物载体上也为OA 的软骨组织工程学治疗创造了更为理想的条件。虽然没有相关临床试验,但已有研究[3]使用OA患者的BMSCs 和骨软骨外植体模拟体内微环境,结果显示:KGN 促软骨再生作用显著并对肥大性分化无明显影响。然而,如何利用KGN 的旁分泌机制以克服目前基于细胞治疗OA 的局限性以及如何对4-ABP 和KGN 进行化学修饰以避免其潜在毒性并提高药效等问题仍需更为深入和详细的研究来解决,以期使KGN 能够最大限度地应用于OA 的临床治疗。
