PKA-PINK1/Parkin信号通路在氧糖剥夺/复氧复糖后大鼠皮质星形胶质细胞凋亡和焦亡中的作用
2021-04-13马美娜周真真郭庆夺于红美
于 红,马美娜,周真真,郭庆夺,于红美
(河北省沧州市中心医院麻醉科,河北 沧州 061000)
中枢神经系统主要由神经元、星形胶质细胞核小胶质细胞等构成,而星形胶质细胞在维持神经元代谢及谷氨酸平衡中扮演着重要角色,一旦缺血再灌注损伤发生后,由于能量代谢及氧供需失衡,可诱发星形胶质细胞和神经元的死亡[1-3]。蛋白激酶A(protein kinase A,PKA)在调控星形胶质细胞线粒体氧化应激中发挥着重要作用,抑制PKA过度激活能够减轻氧化应激造成的细胞凋亡和焦亡[4]。既往研究表明,PTEN诱导性激酶蛋白1(PTEN induced putative kinase 1,PINK1) E3泛素连接酶(E3 ubiquitin ligases,Parkin)途径是特异性调控线粒体自噬的信号通路[5-6],抑制PKA表达上调可减少PINK1募集细胞质内的Parkin,减轻线粒体过度损伤和自噬[7]。本研究拟通过建立体外大鼠原代星形胶质细胞氧糖剥夺-复糖复氧模型,以揭示PKA-PINK1/Parkin信号通路在神经系统缺血再灌注损伤中发挥的作用。
1 材料与方法
1.1实验动物及分组 24 h内的SD新生大鼠,共168只,北京维通利华实验动物技术有限公司负责提供(SYXK(京)2012-0036)。分离脑组织后,行原代大鼠皮质星形胶质细胞培养,并将所分离培养的原代大鼠星形胶质细胞分为4组,每组42只,分别为对照组(C组)、氧糖剥夺组(oxygen-glucose deprivation,OGD/R组),H89+氧糖剥夺(H89+OGD/R, HO组),H89对照组(H组)。其中,凋亡率、焦亡率、生存率、钙离子浓度测定、ROS测定、PKA测定、蛋白免疫印迹实验(Parkin和Pink1表达测定)各需要6只大鼠。
1.2原代大鼠皮质星形胶质细胞培养 出生24 h内的SD大鼠,在无菌平衡盐溶液(D-Hank液)中将大鼠的脑皮质充分剥离,并将皮质剪碎后放置在15 mL的无菌离心管内,取与细胞容积等量的胰酶(0.125%,HyClone,美国)加入离心管内,使其终浓度为0.062 5%,5% CO2培养箱内消化10 min,并在消化至5 min时轻摇1次。消化结束后,向离心管内加入等容量接种液(DMEM-F12,20%FBS,10%HS)(Hyelone公司,美国),以终止消化反应。1 000×g离心5 min后弃去上清液,再次向离心管内加入2~3 mL接种液,吸管吹打2~3下后200目滤网过滤,细胞悬液收集至新的无菌离心管内,倒置显微镜(Olympus公司,日本)下用计算原代细胞密度,并使用接种液将细胞密度调至1×105/mL。37 ℃、CO2浓度为5%的培养箱内进行原代细胞培养,2~3 d半量换液1次,待培养至第7天时,FBS浓度降低至10%。培养至第21天的原代大鼠皮质星形胶质细胞通过星形胶质细胞特异表达蛋白GFAP免疫荧光染色,进行星形胶质细胞鉴定,其阳性表达率超过95%可继续用于实验。
1.3氧糖剥夺模型的建立 实施氧糖剥夺处理前1 h,向HO和H组培养基内加入PKA特异性抑制剂H89(10 μmol/L,批号:L1643,Merck公司,德国)。OGD/R和HO组细胞氧糖剥夺的实施方法为PBS洗涤原代大鼠星形胶质细胞3次后,更换为无糖培养基BBS(HyClone,美国),先向无糖培养基中持续以2 L/min的速度通入100% N230 min,再将培养基放入低氧培养箱(Thermo,美国)内。向低氧培养箱中持续输入95% N2和5% CO2,处理6 h后,将培养基的培养液更换为含有10%FBS的接种液的正常培养基。OGD/R组和HO组培养基在正常的培养环境中继续培养24 h,C组和H组使用PBS洗涤细胞3次,置于含有5% CO2的正常培养箱中培养。
1.4凋亡率、焦亡率和存活率的测定 每组各取6孔,分别采用Annexin V-FITC/PI和cleaved caspase-1/PI双染色法测定皮质星形胶质细胞凋亡和焦亡程度。每孔加入0.125%胰酶2 mL消化并中和后,4 ℃下150×g离心10 min,弃上清重悬细胞并计数,调整细胞浓度至1.5×105个/mL,将收集的细胞重悬于 200 μL 缓冲液中;加入 5 μL Annexin V-FITC或cleaved caspase-1试剂(碧云天生物制剂有限公司,中国),避光室温孵育15~20 min; 加入10 μL PI(50 mg/L),补加缓冲液 200 μL,采用FACS420型流式细胞仪(Becton Dickinson公司,美国)检测,Annexin V-FITC(+)/PI(-)占总细胞的百分比即为星形胶质细胞凋亡率,cleaved caspase-1 (+)/PI(+)占总细胞的百分比即为星形胶质细胞焦亡率。四甲基偶氮唑法(methyl thiazolyl tetrazolium,MTT)法用于测定星形胶质细胞的存活率。向每孔培养基内加入MTT溶液(浓度为5 g/L,碧云天生物制剂有限公司,中国)20 μL,5% CO2的正常培养箱中培养继续孵育4 h。将培养基弃去,向每孔细胞加入150 μL DMSO溶液,充分震荡10 min后,在490 nm波长处使用酶标仪测定各孔的吸光度(A值),以同批次C组作为对比,计算星形胶质细胞存活率[8]。
1.5游离钙离子浓度的测定 每组取6孔,弃去上清培养液后,使用无钙PBS(pH=7.0)洗涤2次,向每孔细胞内加入10 μmol/L Fluo-3/AM(Biotium公司,美国) 200 μL,5% CO2的37 ℃正常培养箱中孵育30 min后取出,使用DMEM培养基漂洗3遍。FV300激光共聚焦显微镜(Olympus公司,日本)下观察荧光强度,激发波长485 nm,检测波长520 nm,采集图像,采用LSM510 25 SP2软件(Zeiss公司,德国)进行分析,以荧光指数反应[Ca2+]i。
1.6ROS水平的测定 每组取6孔,二氯荧光黄双乙酸盐(2′, 7′-dichlorodihydrofluorescein diacetate,DCFH-DA)法测定ROS含量。同上述凋亡率和焦亡率测定方法,向收集的细胞内加入终浓度为10 μmol/L DCFH-DA(Sigma公司,美国)溶液,充分振荡混匀后,37 ℃的5% CO2正常细胞培养箱内避光孵育20 min,每隔5 min吹打数次,孵育结束后在4 ℃下150×g离心5 min,D-Hanks平衡液重悬细胞,FACS420型流式细胞仪在488 nm激发波长、525 nm发射波长下测定荧光强度值,反映ROS含量。
1.7PKA活性检测 每组取6孔,采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测星形胶质细胞质内PKA活性。大鼠原代星形胶质细胞经0.125%胰酶消化10 min后,终止反应,细胞质提取试剂盒(Thermo公司,美国)提取星形胶质细胞的细胞质蛋白。按照每1 mL细胞悬液加入1 mL CER Ⅰ(含有其中1 mmol/L蛋白酶抑制剂)试剂,在研磨器中研磨10次,振荡15 s,静置1 min后加入CER Ⅱ试剂,振荡5 s,静置1 min后,4 ℃下16 000×g离心5 min,取上清液行二喹啉甲酸(bicinchoninic acid,BCA)法测定样品浓度。PKA活性检测依据试剂盒说明书操作(Genmed公司,美国),在96孔酶标板上做好相应标记:标准样品和待测样品,分别加入50 μL Genmed底物液、已准备好的标准液和待测样品、50 μL Genmed反应液,室温下孵育20 min,加入50 μL Genmed酶解液室温下孵育30 min,加入50 μL Genmed终止液,以空白对照孔为零,450 nm波长测定吸光度值,根据标准品吸光度值绘制标准曲线,并计算样品PKA活性。
1.8蛋白免疫印记检测 每组取6孔,使用细胞裂解液(radio-immunoprecipitation assay,RIPA)(索莱宝有限公司,中国)将细胞裂解,超声击碎细胞,BCA法测定细胞内总蛋白浓度。在100 ℃下孵育5 min使蛋白变性,加入loading buffer后,每孔30 μg蛋白样品,8%十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)中电压恒定进行电泳,电流恒定湿转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),5%脱脂奶粉室温封闭1 h后,TBST洗膜,加入兔抗鼠PINK1(1∶500,批号:ab216144,abcam公司,英国)和Parkin(1∶500,ab233434,Abcam,英国)多克隆抗体37 ℃ 1 h孵育,TBST洗膜3次,每次10 min,山羊抗兔二抗(1∶1 000,武汉博士的生物制剂有限公司,中国)25 ℃ 1 h孵育,TBST洗膜3次,每次10 min,ECL发光,以GADPH作为内参照[9],以目的条带和内参条带灰度值的比值反映表达水平。
1.9统计学方法 应用SPSS 11.5统计软件处理数据。计量资料采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1凋亡率和焦亡率实验结果 与C组比较,OGD/R组和HO组皮质星形胶质细胞的凋亡率升高,焦亡率升高,差异有统计学意义(P<0.05);与OGD/R组比较,HO组皮质星形胶质细胞的凋亡率下降,焦亡率下降,差异有统计学意义(P<0.05);C组与H组凋亡率和焦亡率差异无统计学意义(P>0.05)。见表1。
2.2存活率实验结果 与C组比较,OGD/R组和HO组皮质星形胶质细胞的存活率下降,差异有统计学意义(P<0.05);与OGD/R组比较,HO组皮质星形胶质细胞的存活率升高,差异有统计学意义(P<0.05);C组与H组存活率差异无统计学意义(P>0.05)。见表1。
2.3细胞内游离钙离子浓度实验结果 与C组比较,OGD/R组和HO组皮质星形胶质细胞的细胞内游离钙离子升高,差异有统计学意义(P<0.05);与OGD/R组比较,HO组皮质星形胶质细胞的细胞内游离钙离子下降,差异有统计学意义(P<0.05);C组与H组细胞内游离钙离子浓度差异无统计学意义(P>0.05)。见表1和图1。
2.4ROS含量实验结果 与C组比较,OGD/R组和HO组皮质星形胶质细胞的ROS含量升高,差异有统计学意义(P<0.05);与OGD/R组比较,HO组皮质星形胶质细胞的ROS含量下降,差异有统计学意义(P<0.05);C组与H组ROS含量差异无统计学意义(P>0.05)。见表1。
2.5PKA活性实验结果 与C组比较,OGD/R组和HO组皮质星形胶质细胞的PKA活性升高,差异有统计学意义(P<0.05);与OGD/R组比较,HO组皮质星形胶质细胞的PKA活性下降,差异有统计学意义(P<0.05);C组与H组PKA活性差异无统计学意义(P>0.05)。见表1。
2.6Western blot实验结果 与C组比较,OGD/R组和HO组皮质星形胶质细胞的PINK1和Parkin表达升高,差异有统计学意义(P<0.05);与OGD/R组比较,HO组皮质星形胶质细胞的PINK1和Parkin表达下降,差异有统计学意义(P<0.05);C组与H组的PINK1和Parkin表达差异无统计学意义(P>0.05)。见表1和图2。
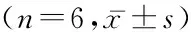
表1 4组大鼠星形胶质细胞凋亡率、焦亡率、存活率、Fluo-3/AM荧光指数、ROS、PKA活性、PINK1和Parkin表达的比较Table 1 Comparison of apoptosis,pyroptosis,viability,Fluo-3/AM fluorescence index,ROS,PKA activity,and expressions of PINK1 and Parkin in cultured rat astrocyte in the four groups
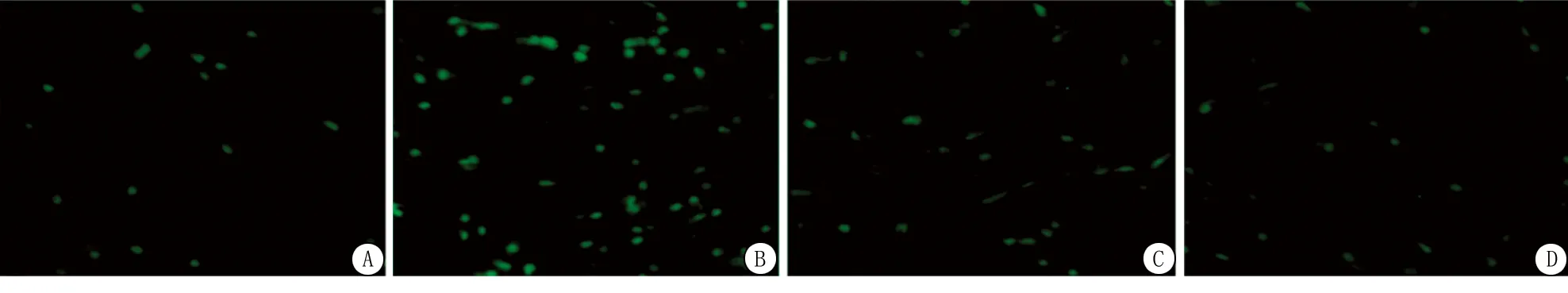
图1 4组大鼠星形胶质细胞钙离子荧光染色
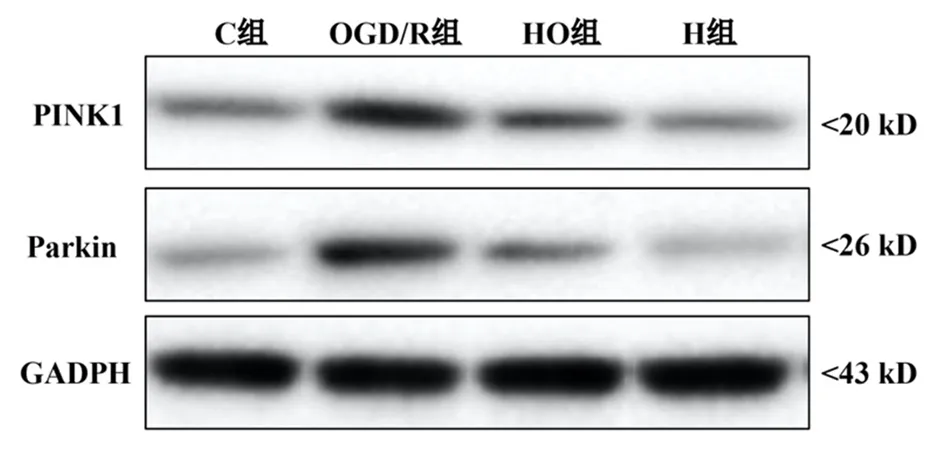
图2 4组大鼠星形胶质细胞PINK1和Parkin表达
3 讨 论
原代培养的大鼠皮质星形胶质细胞是常用的离体研究神经胶质细胞功能的良好模型[10]。氧糖剥夺/复糖复氧是模拟在体缺血再灌注损伤模型中重要体外模型,与单纯的缺氧复氧模型比较,更接近于在体的病理生理状态[11]。Annexin V通过与细胞膜表面的磷脂酰丝氨酸结合,提示细胞处于早期凋亡阶段;PI的阴性与阳性可表示细胞处于凋亡早期或晚期[12]。作为一种已发现的细胞死亡形式,其特征为caspase-1激活后裂解为cleaved caspase-1,形成焦亡小体,启动焦亡程序,cleaved caspase-1/PI联合染色常被用于检测细胞的焦亡程度[13]。本研究表明,大鼠原代星形胶质细胞在氧糖剥夺6 h并复糖复氧24 h后,Annexin V-FITC(+)/PI(-)和cleaved caspase-1(+)/PI(+)细胞明显增加,存活率下降,表明该体外缺血再灌注损伤模型可导致细胞凋亡和焦亡增加,存活率下降。
当机体受到缺血后,线粒体能量缺失;而再灌注发生后可导致线粒体过度氧化应激,ROS过度生成,钙离子超载[14]。既往研究表明,线粒体受损后可导致PINK1快速募集Parkin,形成PINK1/Parkin复合体,引发线粒体外膜包裹,最终诱导细胞色素C释放至细胞质,导致凋亡[15]。ROS的过度生成及钙离子超载后,可激活caspase-1裂解,形成焦亡小体,导致细胞焦亡[16]。本研究结果显示,大鼠原代星形胶质细胞在氧糖剥夺/复糖复氧后,ROS含量增加,细胞内钙离子浓度增加,同时PINK1和Parkin表达水平增加,提示星形胶质细胞的凋亡和焦亡可能与缺血再灌注损伤后,线粒体氧化应激过度导致PINK1/Parkin通路的激活后过度表达相关。
H89透过细胞膜后与PKA结合,影响其下游的底物和亚基结合,从而抑制PKA活性[17];缺血再灌注损伤可导致神经元细胞质内PKA活性增加,抑制PKA过度激活可减少神经元凋亡,其机制可能与PKA减少PINK1/Parkin信号通路激活相关[18]。既往研究表明,降低PKA活化,可减少PINK1/Parkin信号通路的泛素化,减轻帕金森病的恶化进程[19];而增加PKA磷酸化激活,可上调PINK1/Parkin诱发的线粒体自噬,诱发细胞进入凋亡周期[20]。结合参考文献[21]及预实验结果,本研究采用10 μmol/L H89作用于氧糖剥夺/复糖复氧后的大鼠皮质星形细胞,显示H89能够显著抑制PKA活性,同时降低氧糖剥夺/复糖复氧导致的星形胶质细胞凋亡、焦亡和PINK1、Parkin的表达,增加细胞存活率,同时减少ROS生成,抑制细胞内钙离子超载。以上结果表明抑制PKA过度活化可减轻氧糖剥夺/复糖复氧导致的星形胶质细胞线粒体损伤,抑制细胞凋亡和焦亡。
综上所述,抑制PKA过度活化能够减轻氧糖剥夺/复氧复糖后大鼠星形胶质细胞凋亡和焦亡,其机制与抑制PINK1/Parkin信号通路激活相关。
