不同程度单纯性先天性上睑下垂患者提上睑肌的病理研究
2021-04-12罗彦竹黎冬平周娜李俊萍王育红
罗彦竹 黎冬平 周娜 李俊萍 王育红
1中南大学爱尔眼科学院,长沙 410015;2武汉爱尔眼科医院汉口医院眼科 430021
上睑下垂指平视前方时,上眼睑遮盖角膜上缘的范围超过2 mm[1]。单纯性先天性上睑下垂(simple congenital ptosis,SCP)是临床上常见的一种上睑下垂亚型,不仅影响患者的美观,还可能导致视觉及心理发育障碍[2-5]。研究表明,SCP可能有多种发病机制,大多数病例是由于提上睑肌或动眼神经核的发育不良所致,少数病例是由于提上睑肌内外角以及上方的节制韧带过紧,或是眶隔纤维化,从而限制了提上睑肌的活动[6-10]。也有研究提出SCP提上睑肌的病理学改变应归纳为营养不良而非发育不良[11-12],故关于SCP的发病机制仍无定论。在进行病理学观察时,某些提上睑肌标本中可能无法观察到骨骼肌纤维,反而可以观察到较多的平滑肌纤维,这类肌纤维在过去往往被认为是Müller肌[13]。但Alshehri等[14]观察到SCP患者的Müller肌呈萎缩性改变,肌肉中的平滑肌数目明显少于腱膜性上睑下垂患者。有研究发现,正常人的提上睑肌腱膜中也含有少量独立的平滑肌纤维,并且免疫组织化学检测提示α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)在这些肌纤维中呈阳性表达[15-16]。以上研究表明将SCP患者提上睑肌标本中的平滑肌纤维完全视为Müller肌的观点可能并不准确。鉴于此,本研究拟通过光学显微镜观察SCP患者提上睑肌中的骨骼肌纤维,为肌肉病理学的分类提供更多证据;并通过平滑肌标志性蛋白的免疫组织化学检测和肌细胞的透射电子显微镜观察等方法,对患者提上睑肌中的平滑肌纤维进行定性研究,探讨SCP的发病机制。
1 材料与方法
1.1 材料
1.1.1取材及组织来源 收集2018年8月至2019年10月于武汉爱尔眼科医院汉口医院行提上睑肌缩短术的SCP患者68例102眼的提上睑肌标本作为观察组,其中男48例,女20例;年龄2~36岁,中位数年龄为7.50岁;单侧上睑下垂患者34例,双侧上睑下垂患者34例。同时选取武汉市红十字会爱尔眼库提供的8名正常供体的新鲜提上睑肌腱膜和肌腹组织作为对照组,其中男5名,女3名;年龄55~70岁,中位数年龄为63.5岁。参照《上睑下垂诊治专家共识》[1],上睑下垂的诊断标准为患者平视前方,抵消额肌力量后,上睑缘遮盖角膜上缘的范围大于2 mm。观察组纳入标准:(1)明确诊断为SCP,且拟接受手术治疗的患者;(2)患者依从性好。排除标准:(1)其他类型的先天性上睑下垂或后天性上睑下垂患者;(2)重症肌无力、进行性肌营养不良等全身骨骼肌疾病合并有局部上睑下垂表现者;(3)既往有眼睑外伤史、手术史者;(4)提上睑肌肌力差,需联合筋膜鞘手术或额肌悬吊术的患者。对照组纳入标准:(1)签署中国人体器官捐献志愿登记卡,供者家属知情同意;(2)死亡时间不超过12 h。排除标准:(1)既往有眼睑外伤史、手术史者;(2)患者死亡前即有明确的上睑下垂表现。参照上眼睑遮盖角膜的范围将所有观察组标本分为遮盖范围≤4 mm组35眼、遮盖范围>4 mm~≤6 mm组30眼和遮盖范围>6 mm组37眼,观察组提上睑肌标本的临床特征见表1。所有患者均接受提上睑肌缩短术,术中取材时尽可能剔除Müller肌,将靠近肌腹部的提上睑肌标本用于病理学研究。本研究遵循《赫尔辛基宣言》,研究方案经武汉爱尔眼科医院汉口医院医学伦理委员会审核批准(批文号:HKAIER2018IRB-005-01),所有患者及其法定监护人了解治疗方法和取材目的并自愿签署知情同意书。
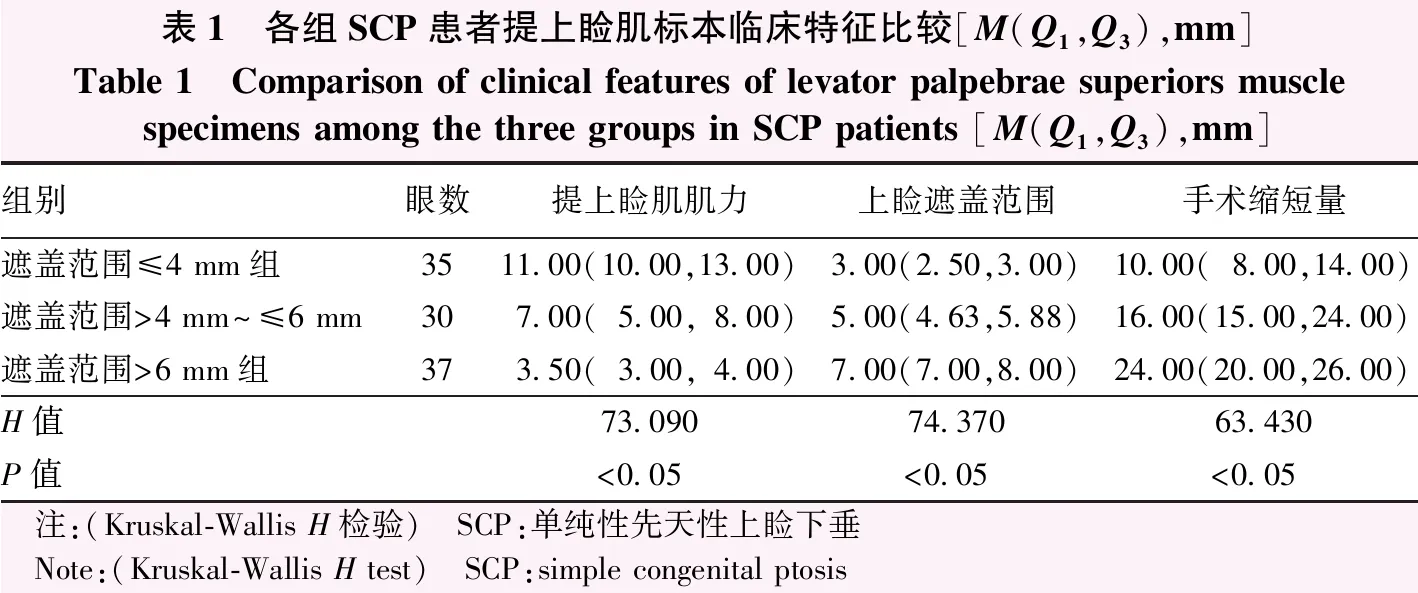
表1 各组SCP患者提上睑肌标本临床特征比较[M(Q1,Q3),mm]Table 1 Comparison of clinical features of levator palpebrae superiors musclespecimens among the three groups in SCP patients [M(Q1,Q3),mm]组别眼数提上睑肌肌力上睑遮盖范围手术缩短量遮盖范围≤4 mm组3511.00(10.00,13.00)3.00(2.50,3.00)10.00(8.00,14.00)遮盖范围>4 mm~≤6 mm307.00(5.00,8.00)5.00(4.63,5.88)16.00(15.00,24.00)遮盖范围>6 mm组373.50(3.00,4.00)7.00(7.00,8.00)24.00(20.00,26.00)H值73.09074.37063.430P值<0.05<0.05<0.05 注:(Kruskal-Wallis H检验) SCP:单纯性先天性上睑下垂 Note:(Kruskal-Wallis H test) SCP:simple congenital ptosis
1.1.2主要试剂及仪器 苏木精-伊红染色试剂盒、Masson三色染色试剂盒、二氨基联苯胺(diaminobenzidine,DAB)试剂盒、鼠抗人α-SMA单克隆抗体(BM0002)(武汉博士德生物工程有限公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗小鼠二抗(5220-0341)(武汉安诺伦生物科技有限公司)。脱水机、包埋机、冻台、组织摊片机(武汉俊杰电子有限公司);病理切片机(上海徕卡仪器有限公司);烤箱(天津市莱玻瑞仪器设备有限公司);微波炉(广东格兰仕微波炉电器有限公司);水浴锅(金坛市江南仪器厂);脱色摇床(北京六一仪器厂);涡旋混合器(南京天悦电子科技股份有限公司);正置光学显微镜、成像系统(日本Nikon公司);钻石切片刀(瑞士戴通公司);透射电子显微镜(美国FEI公司)。
1.2 方法
1.2.1提上睑肌取材及石蜡切片的制作 观察组所有患者术前均详细询问病史,行常规眼部及全身检查,与上睑下垂相关的专科检查包括上睑缘遮盖角膜上缘的范围、睑裂大小、提上睑肌肌力、额肌肌力、Bell征、新斯的明试验及咀嚼试验。所有患者均由同一位经验丰富的手术医师行提上睑肌缩短术,术中截取Whitnall韧带以上的提上睑肌组织进行病理学观察,若缩短的范围未达到Whitnall韧带,则尽可能靠近肌腹端取材,截取组织长度约5 mm。将术中留取的提上睑肌标本用手术贴膜覆盖,尽量减小牵拉、挫伤与挤压等机械损伤,使用弯剪快速截取约1 mm×1 mm×1 mm大小的标本,于1 min内浸入体积分数2.5%戊二醛溶液,4 ℃固定24 h,以备制作透射电子显微镜切片。另一部分放置在质量分数4%多聚甲醛溶液中固定,行常规石蜡包埋,3 μm厚连续切片,备用。
1.2.2Masson三色染色法检测肌纤维面积 将石蜡切片依次放入二甲苯Ⅰ、二甲苯Ⅱ、二甲苯Ⅲ溶液各15 min脱蜡,逐级放入无水乙醇、体积分数95%乙醇、85%乙醇各5 min,自来水清洗。将切片放入质量分数3%重铬酸钾溶液中浸泡过夜,水洗;铁苏木素染液(铁苏木素A液与B液等体积混合)染色3 min,分化,水洗,返蓝,流水冲洗;丽春红酸性品红染色5~10 min,漂洗。将切片放入磷钼酸水溶液浸染1~3 min,苯胺蓝染液染3~6 min。切片用质量分数1%冰醋酸分化,连续快速浸入2缸无水乙醇洗掉醋酸和部分水,并浸入第3缸无水乙醇中彻底脱水5 min,二甲苯透明5 min,中性树胶封片。每张Masson染色切片于40倍光学显微镜下任意选取3个视野拍照,采用ImageJ 1.52a图像分析软件分别计算图像中胶原纤维及骨骼肌纤维面积,分别除以组织总面积,将结果取平均值进而得出每个标本的胶原纤维面积比及骨骼肌纤维面积比。胶原纤维呈蓝色,肌纤维呈红色。骨骼肌纤维呈长柱形,肌细胞内含多个细胞核,位于肌膜的下方;平滑肌纤维呈长梭形,肌细胞内含单个呈长椭圆形或杆状的细胞核,位于细胞中央。染色结果由2位病理科医师进行双盲读片,结果不一致则共同讨论决定。
1.2.3免疫组织化学染色法测定标本中α-SMA表达 将石蜡切片置于65 ℃烘箱中烘片2 h,常规脱蜡至水,置于EDTA修复液中微波修复;冷却后磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗15 min,质量分数3%牛血清白蛋白封闭30 min,加入50 μl鼠抗人α-SMA单克隆抗体(1∶ 100),4 ℃过夜孵育;PBS冲洗,加入50 μl HRP标记山羊抗小鼠抗体(1∶ 100),常温孵育50 min;PBS冲洗,加50 μl DAB溶液显色;显色完全后水洗,苏木素复染,体积分数1%盐酸乙醇分化,水洗,返蓝,脱水,透明封片。每张免疫组织化学染色切片于光学显微镜下任意选取3个视野拍照,染色结果由2位病理科医师进行双盲读片,结果不一致则共同讨论决定。采用ImageJ 1.52a图像分析软件计算α-SMA的积分吸光度(integrated absorbance,IA)值。
1.2.4透射电子显微镜下观察标本组织的超微结构 采用简单随机抽样方法选取17个(对照组2个,遮盖范围≤4 mm组、遮盖范围>4 mm~≤6 mm组、遮盖范围>6 mm组各5个)提上睑肌标本行透射电子显微镜检查。将所取组织加入0.1 mol/L PBS(pH 7.4)漂洗3次,每次15 min;0.1 mol/L PBS(pH 7.4)配置的质量分数1%锇酸固定液室温(20 ℃)固定2 h,0.1 mol/L PBS(pH 7.4)漂洗。将组织放入不同体积分数乙醇中梯度脱水,每次15 min;丙酮和812包埋剂等体积混合液渗透过夜,纯812包埋剂渗透过夜,60 ℃聚合48 h。使用切片机将组织纵向切为60~80 nm超薄切片,铀铅双染色(质量分数2%醋酸铀饱和水溶液和枸橼酸铅各染色15 min),室温干燥过夜。透射电子显微镜下观察并采集图像,由2位病理科医师进行双盲读片,结果不一致则共同讨论决定。
1.3 统计学方法
采用SPSS 21.0统计学软件进行统计分析。采用Shapiro-Wilk检验分析所有计量资料的正态性,提上睑肌肌力、上睑遮盖范围、手术缩短量、胶原纤维和骨骼肌纤维面积比、α-SMA的IA值均不符合正态分布,以M(Q1,Q3)表示。遮盖范围≤4 mm组、遮盖范围>4 mm~≤6 mm组、遮盖范围>6 mm组和对照组各检测指标总体差异比较采用Kruskal-WallisH检验,P<0.05为差异有统计学意义。组间两两比较采用Bonferroni法,调整检验水准α'=0.05/6=0.008 3。
2 结果
2.1 各组提上睑肌标本的组织病理学表现
光学显微镜下观察可见,对照组标本的肌腹部为排列整齐、连接紧密的骨骼肌纤维,肌细胞膜结构完整且有清晰的横纹,细胞核位于周边,肌细胞间结缔组织分布均匀且稀疏。观察组102个标本中共有18个标本(遮盖范围≤4 mm组10个、遮盖范围>4 mm~≤6 mm组6个、遮盖范围>6 mm组2个)检测到骨骼肌纤维,遮盖范围≤4 mm组8个标本中仅含有纤维结缔组织而无肌纤维。与对照组相比,观察组标本中肌纤维数量均明显减少,细胞间质中胶原纤维及脂肪组织增生,部分骨骼肌细胞横纹消失,肌内膜不完整(图1)。遮盖范围>6 mm组与遮盖范围>4 mm~≤6 mm组骨骼肌纤维病理改变相似。对照组、遮盖范围≤4 mm组、遮盖范围>4 mm~≤6 mm组与遮盖范围>6 mm组标本的胶原纤维面积比分别为16.03%(14.85%,17.18%)、35.87%(26.75%,45.14%)、25.33%(23.10%,29.53%)和31.37%(25.72%,34.27%),总体比较差异有统计学意义(H=37.488,P<0.05),其中遮盖范围≤4 mm组、遮盖范围>4 mm~≤6 mm组及遮盖范围>6 mm组的胶原纤维面积比明显高于对照组,遮盖范围≤4 mm组标本的胶原纤维面积比明显高于遮盖范围>4 mm~≤6 mm组标本,差异均有统计学意义(均P<0.008 3)。对照组、遮盖范围≤4 mm组、遮盖范围>4 mm~≤6 mm组和遮盖范围>6 mm组标本的骨骼肌纤维面积比分别为43.74%(40.47%,48.37%)、0.00%(0.00%,11.98%)、0.00%(0.00%,0.00%)和0.00%(0.00%,0.00%),总体比较差异有统计学意义(H=45.336,P<0.05),其中对照组标本的骨骼肌纤维面积比明显高于遮盖范围≤4 mm组、遮盖范围>4 mm~≤6 mm组及遮盖范围>6 mm组,差异均有统计学意义(均P<0.008 3),遮盖范围≤4 mm组标本骨骼肌纤维面积比高于遮盖范围>4 mm~≤6 mm组及遮盖范围>6 mm组,但3个组间两两比较差异均无统计学意义(均P≥0.008 3)(图2)。
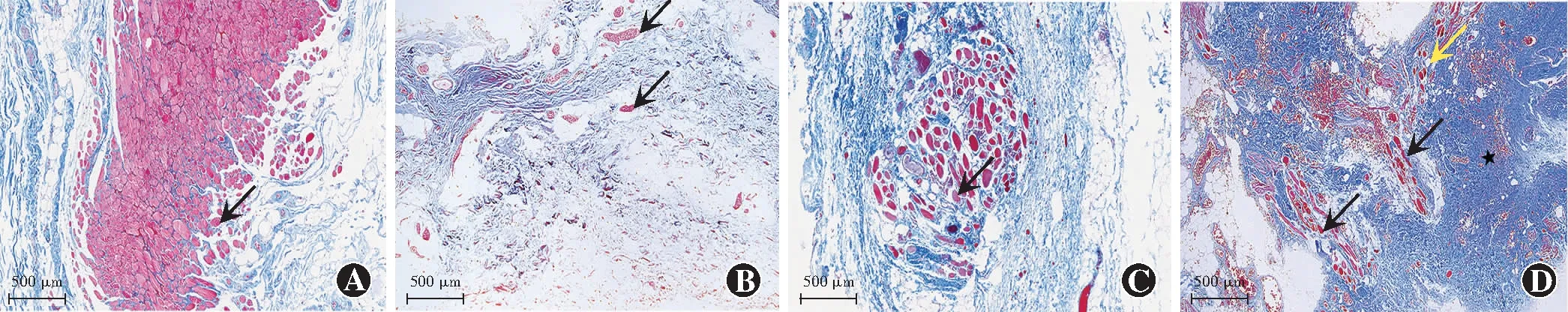
图1 各组提上睑肌标本中骨骼肌纤维的组织病理学表现(Masson ×40,标尺=500 μm) A:对照组标本的肌腹部含有丰富的骨骼肌纤维(黑色箭头) B:遮盖范围≤4 mm组标本中无肌纤维分布,仅观察到胶原纤维和血管(黑色箭头) C:遮盖范围≤4 mm组标本骨骼肌纤维数量减少,排列稀疏,部分肌纤维横纹消失,肌内膜不完整(黑色箭头) D:遮盖范围>4 mm~≤6 mm组标本中骨骼肌纤维数量减少,走行紊乱,部分肌纤维横纹消失、肌内膜不完整(黑色箭头),细胞间质中胶原纤维及脂肪组织大量增生(★),部分标本中可同时观察到梭状的平滑肌纤维(黄色箭头)Figure 1 Histopathological manifestations of skeletal muscle fibers in levator palpebrae superiors muscle specimens of each group(Masson ×40,bar=500 μm) A:The muscle belly of specimens in the control group was rich in skeletal muscle fibers (black arrow) B:No muscle fiber was found in specimens of coverage ≤4 mm group,only collagen fibers and blood vessels (black arrows) were observed C:In specimens of coverage ≤4 mm group,the skeletal muscle fibers in the specimens were reduced and sparsely arranged;the striation of some muscle fibers disappeared;the endomysium (black arrow) was incomplete D:In specimens of coverage >4 mm to ≤6 mm group,the skeletal muscle fibers were reduced and disordered;the striation of some muscle fiber disappeared,and the endomysium (black arrow) was incomplete;collagen fibers and adipose tissue (★) in the intercellular substance were proliferated;spindle-shaped smooth muscle fibers (yellow arrow) were found in some specimens
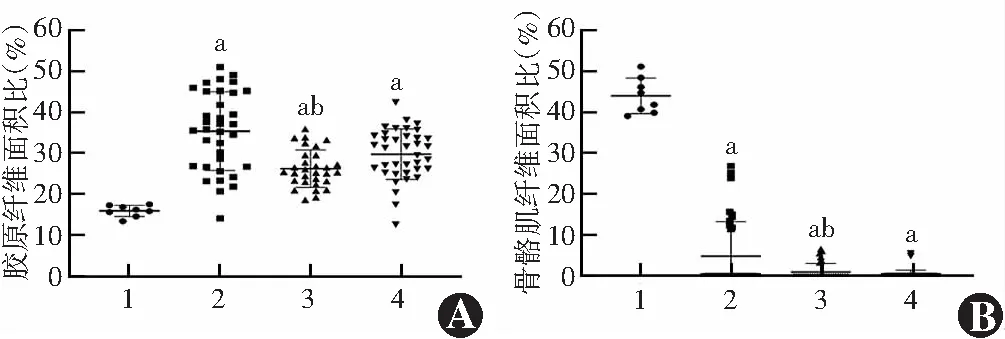
图2 各组提上睑肌中胶原纤维面积比及骨骼肌纤维面积比的比较 与对照组比较,aP<0.008 3;与遮盖范围≤4 mm组比较,bP<0.008 3(Kruskal-Wallis H检验,Bonferroni校正法,n=6) A:各组胶原纤维面积比 B:各组骨骼肌纤维面积比 1:对照组;2:遮盖范围≤4 mm组;3:遮盖范围>4 mm~≤6 mm组;4:遮盖范围>6 mm组Figure 2 Comparison of collagen fiber area ratio and skeletal muscle fiber area ratio in levator palpebrae superiors muscle specimens among various groups Compared with the control group,aP<0.008 3;compared with the coverage ≤4 mm group,bP<0.008 3 (Kruskal-Wallis H test,Bonferroni correction, n=6) A:Collagen fiber area ratio among various groups B:Skeletal muscle fiber area ratio among various groups 1:Control group;2:Coverage ≤4 mm group;3:Coverage >4 mm to ≤6 mm group;4:Coverage >6 mm group
对照组提上睑肌腱膜标本中主要为纤维结缔组织,含有少量稀疏分布的平滑肌纤维,肌纤维呈梭状,无横纹结构,单个细胞核位于中央。观察组标本中共有78个标本(遮盖范围≤4 mm组17个、遮盖范围>4 mm~≤6 mm组26个、遮盖范围>6 mm组35个)检测到平滑肌纤维,遮盖范围>4 mm~≤6 mm组有2个标本同时观察到骨骼肌和平滑肌纤维。观察组标本平滑肌纤维数量多于对照组,排列较紊乱,着色程度深浅不一,细胞间质可观察到胶原纤维和脂肪组织增生,3个组标本的平滑肌纤维数量、胶原纤维和脂肪组织的增生程度存在差异(图3)。
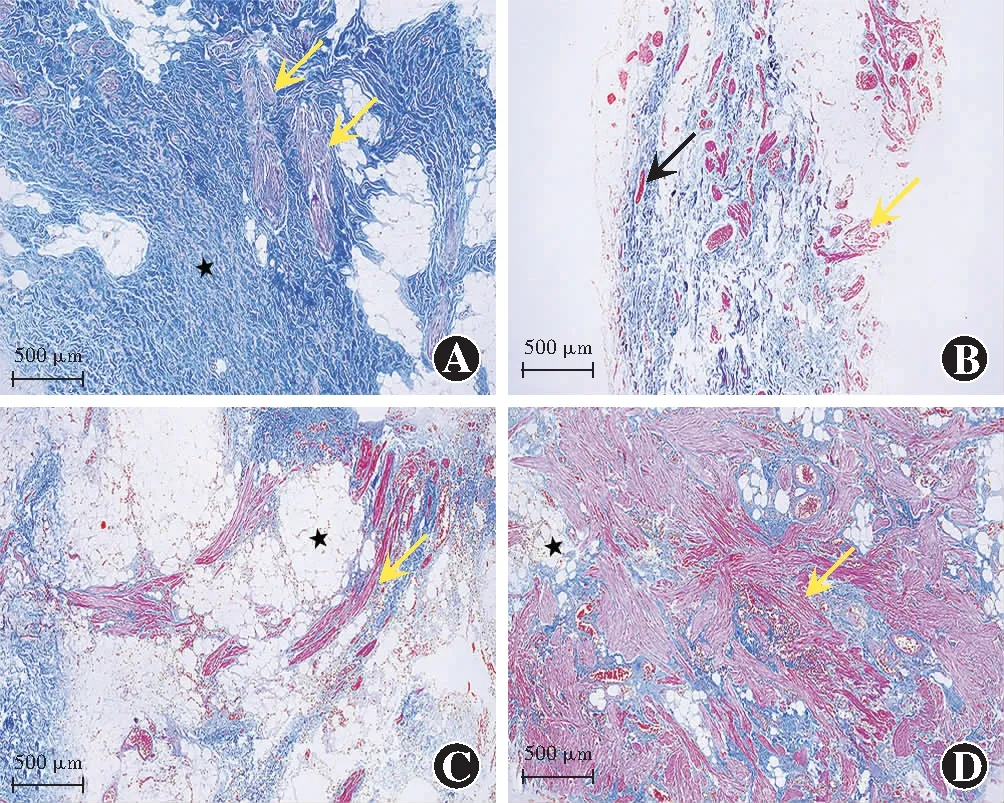
图3 各组提上睑肌中平滑肌纤维组织病理学表现(Masson ×40,标尺=500 μm) A:对照组的提上睑肌腱膜含有丰富的胶原纤维(★)和少量平滑肌纤维(黄色箭头) B:遮盖范围≤4 mm组标本中观察到稀疏分布的平滑肌纤维(黄色箭头)和血管(黑色箭头) C:遮盖范围>4 mm~≤6 mm组标本中观察到较多的平滑肌纤维(黄色箭头),细胞间质中可见较多的胶原纤维和脂肪组织增生(★) D:遮盖范围>6 mm组标本中观察到大量平滑肌纤维(黄色箭头),细胞间质中可见大量胶原纤维和脂肪组织增生(★)Figure 3 Histopathological manifestations of smooth muscle fibers in levator palpebrae superiors muscle specimens of each group(Masson ×40,bar=500 μm) A:Levator aponeurosis of the control group contained abundant collagen fibers (★) and a small amount of smooth muscle fibers (yellow arrows) B:Sparsely distributed smooth muscle fibers (yellow arrows) and blood vessels (black arrows) were found in specimens of the coverage ≤4 mm group C:More smooth muscle fibers (yellow arrows),collagen fibers and adipose tissue hyperplasia (★) were found in specimens of the coverage >4 mm to ≤6 mm group D:Abundant smooth muscle fibers (yellow arrows),collagen fibers and adipose tissue hyperplasia (★) were found in specimens of the coverage >6 mm group
2.2 各组提上睑肌标本中α-SMA表达情况比较
免疫组织化学染色结果显示,α-SMA在提上睑肌的平滑肌和血管平滑肌中均有阳性表达,对照组和遮盖范围≤4 mm组标本中可见少量的α-SMA阳性表达,遮盖范围>4 mm~≤6 mm组和遮盖范围>6 mm组标本中α-SMA阳性表达面积明显多于对照组和遮盖范围≤4 mm组(图4)。各组提上睑肌标本中α-SMA的IA值总体比较差异有统计学意义(H=60.573,P<0.05)。遮盖范围>4 mm~≤6 mm组和遮盖范围>6 mm组的IA值明显大于对照组和遮盖范围≤4 mm组,遮盖范围>6 mm组标本的IA值明显大于遮盖范围>4 mm~≤6 mm组,差异均有统计学意义(均P<0.008 3)(表2)。
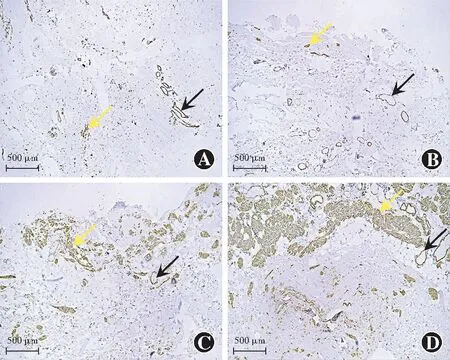
图4 各组提上睑肌标本中α-SMA的免疫组织化学染色结果(×40,标尺=500 μm) 遮盖范围>4 mm~≤6 mm组和遮盖范围>6 mm组提上睑肌的平滑肌纤维(黄色箭头)和血管平滑肌纤维(黑色箭头)中α-SMA的阳性表达面积明显多于对照组和遮盖范围≤4 mm组 A:对照组 B:遮盖范围≤4 mm组 C:遮盖范围>4 mm~≤6 mm组 D:遮盖范围>6 mm组Figure 4 Immunohistochemical staining results of α-SMA in levator palpebrae superiors muscle specimens in each group (×40,bar=500 μm) Positive expression area of α-SMA in smooth muscle fibers (yellow arrow) and vascular smooth muscle fibers (black arrow) in the coverage >4 mm to ≤6 mm group and coverage ≥6 mm group were significantly larger than that in the control group and coverage ≤4 mm group A:Control group B:Coverage ≤4 mm group C:Coverage >4 mm to ≤6 mm group D:Coverage >6 mm group

表2 各组患者提上睑肌标本中α-SMA的IA值比较[M(Q1,Q3)]Table 2 Comparison of the IA value of α-SMA in levatorpalpebrae superiors muscle specimens among the four groups[M(Q1,Q3)]组别眼数IA值对照组85 543.03(4 867.67,8 312.02)遮盖范围≤4 mm组177 195.28(5 935.69,14 058.29)遮盖范围>4 mm~≤6 mm组2655 584.18(33 861.88,80 419.32)ab遮盖范围>6 mm组35166 507.76(119 121.95,187 890.86)abcH值60.573P值<0.05 注:与对照组比较,aP<0.008 3;与遮盖范围≤4 mm组比较,bP<0.008 3;与遮盖范围>4 mm~≤6 mm组比较,cP<0.008 3(Kruskal-Wallis H检验,Bonferroni校正法) α-SMA:α-平滑肌肌动蛋白;IA:积分吸光度 Note:Compared with the control group,aP<0.008 3;compared with the coverage ≤4 mm group,bP<0.008 3;compared with the coverage >4 mmto ≤6 mm group,cP<0.008 3 (Kruskal-Wallis H test,Bonferroni correction) α-SMA:α-smooth muscle actin;IA:integrated absorbance
2.3 观察组提上睑肌标本中平滑肌细胞的超微结构观察
透射电子显微镜下观察到10个标本(遮盖范围≤4 mm组1个、遮盖范围>4 mm~≤6 mm组4个、遮盖范围>6 mm组5个)中的平滑肌细胞呈长梭状,细胞核较大,位于细胞中心,细胞质内含有丰富的细胞器,部分线粒体损伤,细胞质内可见大量排列紊乱的肌丝,未见明显的密斑及密体结构,肌细胞膜表面可见大量胶原纤维附着,细胞外基质中观察到异常细胞外物质分布(图5)。其余7个标本未见平滑肌细胞,仅观察到胶原纤维。
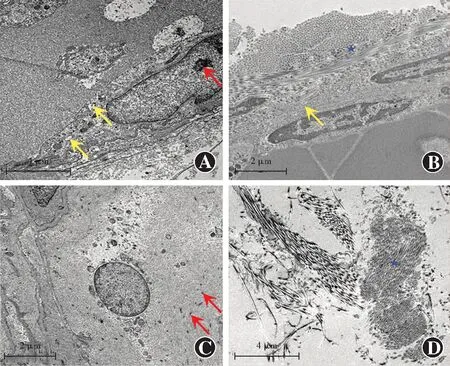
图5 SCP患者提上睑肌标本中平滑肌细胞的透射电子显微镜观察 A:视野内为纵切面的平滑肌细胞,细胞质内含有丰富的细胞器,细胞核内异染色质着色较深(红色箭头);部分线粒体损伤,线粒体脊坏死、溶解,线粒体内可见因溶解形成的空泡(黄色箭头)(×1 700,标尺=4 μm) B:视野内为纵切面的平滑肌细胞,细胞膜表面附着有胶原纤维(黄色箭头),细胞间质可见大量排列紊乱的胶原纤维(★)(×2 500,标尺=2 μm) C:视野内为横切面的平滑肌细胞,细胞质内可见大量排列紊乱的肌丝,可见异常着色物质(红色箭头)(×2 500,标尺=2 μm) D:细胞外基质中可见异常着色物质(★)(×1 700,标尺=4 μm)Figure 5 Smooth muscle cells in the levator palpebrae superiors muscle specimens of the SCP patients observed by transmission electron microscopy A:The longitudinal section of smooth muscle cells was showed.The cytoplasm contained abundant organelles.The heterochromatin staining (red arrow) in the nucleus was deep;some mitochondria were damaged with necrotic and dissolved mitochondrial ridges,and visible vacuoles (yellow arrows) caused by dissolution (×1 700,bar=4 μm) B:The longitudinal section of smooth muscle cells was presented.Collagen fibers (yellow arrows) were attached to the cell membrane surface.A large number of disordered collagen fibers (★) were found in the intercellular substance (×2 500,bar=2 μm) C:The transverse section of smooth muscle cells was displayed.Abundant and disordered myofilaments,and abnormally stained substances (red arrow) were found in the cytoplasm (×2 500,bar=2 μm) D:Abnormally stained substances (★) was found in the extracellular matrix (×1 700,bar=4 μm)
3 讨论
对SCP患者的提上睑肌标本进行病理学观察是研究其发病机制的主要方法。本研究结果显示,与对照组相比,观察组骨骼肌纤维的病理改变为肌横纹消失、数量减少及走行紊乱,并伴随有纤维组织和脂肪组织增生,与既往研究报道一致[1,7-8,10]。由于不同下垂程度患者术中的提上睑肌缩短量有较大差异,遮盖范围≤4 mm组标本仅含有少量的提上睑肌肌腹部组织,而遮盖范围>4 mm~≤6 mm组及遮盖范围>6 mm组标本中含有的肌肉组织普遍多于遮盖范围≤4 mm组,但遮盖范围>4 mm~≤6 mm组及遮盖范围>6 mm组标本的骨骼肌纤维面积比低于遮盖范围≤4 mm组,SCP患者提上睑肌中骨骼肌纤维的减少程度与上睑下垂的严重程度相关,与既往研究结果相符[7-8]。在不同程度SCP患者的提上睑肌标本中,我们观察到遮盖范围≤4 mm组标本纤维化程度最高,这可能是因为其标本中含有较多的提上睑肌腱膜组织,而腱膜组织富含胶原纤维。研究表明,提上睑肌在Whitnall韧带附近逐渐移行为腱膜组织,在显微镜下可以观察到骨骼肌纤维逐渐转变为胶原纤维[15]。本研究中遮盖范围≤4 mm组部分标本中不含肌纤维而仅含纤维结缔组织,术中提上睑肌缩短量普遍小于10 mm,这表明靠近上睑板的提上睑肌腱膜组织中不含骨骼肌纤维。此外,在SCP患者3个组标本中均未观察到再生肌纤维、萎缩性肌纤维和炎性细胞浸润等骨骼肌营养不良的特征性病理改变。从临床表现来看,SCP患者的上睑下垂症状大多自出生起即被发现,并且无明显的进行性加重,这与骨骼肌营养不良的典型临床表现不符[17],因此本研究结果支持SCP的发病机制为骨骼肌发育不全。
本研究的创新点在于观察到SCP患者的提上睑肌中含有平滑肌细胞,这类肌细胞是位于提上睑肌肌腹部而非Müller肌中。Müller肌是上眼睑的平滑肌,其从睑板上10~14 mm处、提上睑肌的下侧发出,与提上睑肌腱膜共同附着于上睑板,形成提上睑肌腱膜-Müller肌复合体[18]。在提上睑肌缩短术中获得的标本可能是该复合体[13]。因此同时观察到骨骼肌和平滑肌时,平滑肌常被视为Müller肌,然而,Müller肌位于上睑板和Whitnall韧带之间,其与提上睑肌腱膜连接疏松而与结膜连接紧密,术者沿着腱膜后间隙能够尽可能将其与提上睑肌分离[19-20]。本研究在取材时发现,遮盖范围≤4 mm组患者术中提上睑肌的分离范围大多位于Whitnall韧带之下,因此其标本可能混有少量Müller肌。但在遮盖范围>4 mm患者的手术中,提上睑肌分离的位置往往在Whitnall韧带之上,取材时基本不会截取到Müller肌,因此按照理论来说,遮盖范围>4 mm患者标本中应几乎不含有平滑肌纤维。但本研究中遮盖范围>4 mm~≤6 mm组及遮盖范围>6 mm组大部分标本中仍可观察到较多平滑肌纤维,这表明遮盖范围>4 mm患者提上睑肌中含有平滑肌细胞。Alshehri等[14]研究发现,SCP患者Müller肌中的平滑肌纤维数量减少,Müller肌呈纤维化改变,其病理特征与本研究遮盖范围>4 mm~≤6 mm组及遮盖范围>6 mm组标本中平滑肌纤维增多的病理特征并不相符,这也进一步证实了本研究的观点。
研究显示,提上睑肌中的骨骼肌细胞是由眶周间充质细胞分化而来,Müller肌中平滑肌细胞的来源尚存争议,但有研究推测其也可能来源于眶周间充质细胞,表明二者在组织学上可能具有同源性[21-23]。在正常人提上睑肌和Müller肌的连续组织切片上可以观察到骨骼肌和平滑肌细胞在一定区域内互相交织在一起,解剖学上该区域大致定位在Whitnall韧带附近[24]。正常人的这2种肌细胞为发育正常的骨骼肌与平滑肌细胞,而本研究在SCP患者Whitnall韧带以上的提上睑肌组织中观察到的平滑肌细胞不具有一般平滑肌细胞所特有的密斑、密体等结构,细胞质中肌丝排列紊乱,部分细胞器出现损伤,但免疫组织化学染色显示α-SMA在该细胞内呈阳性表达,证明了其为平滑肌源性,因此称之为异常的平滑肌细胞。胚胎学研究表明,提上睑肌、上直肌和上斜肌均由上中胚层复合体形成,提上睑肌在胚胎发育的第16周与上直肌分离后进一步发育[11,19]。提上睑肌中骨骼肌细胞的发育受肌肉神经分布和多种信号通路的调节,其在胚胎发育至分娩后6个月期间对内部因素的改变都十分敏感[21]。由于平滑肌的神经支配、分化调节因子及信号传导通路均与骨骼肌有较大差异[25-26],因此本研究认为这类异常的平滑肌细胞可能会直接或间接影响提上睑肌,尤其是提上睑肌前部的骨骼肌发育过程,与骨骼肌纤维数量减少相关,这可以解释为何其他研究在影像学上观察到患者提上睑肌前部的病理改变更加严重[27]。目前尚不清楚是何种因素导致了SCP患者的提上睑肌中平滑肌细胞异常,具体的分子病理学机制也有待进一步研究。本研究结果表明,SCP的发病机制可能不仅是提上睑肌中骨骼肌纤维的病变,还涉及到提上睑肌中平滑肌纤维的病理改变,这为SCP的基础研究提供了新的思路。
本研究仍存在一定的局限性。由于目前暂无合适的方法获取到同年龄段的正常标本进行病理观察,本研究中对照组标本均来自于遗体捐献者,人群以50岁以上的中老年人为主,与观察组年龄不匹配。SCP患者提上睑肌的病理改变与年龄的相关性目前尚存争议[8-9,11],后续的研究需选取相同下垂程度的不同年龄段患者,进一步探讨这些病理改变与年龄的相关性。尽管本研究中所有手术均由同一位经验丰富的眼整形科医生进行,并遵循靠近提上睑肌肌腹部取材的原则,然而不同下垂程度患者的取材部位仍然存在差异,故在进行病理分析时,需将病理标本的观察结果与其取材部位相结合,以便更合理地探讨SCP的发病机制。
利益冲突所有作者均声明不存在利益冲突
志谢武汉科技大学附属天佑医院病理科刘蓓、亢铭淇医师参与本研究的病理阅片,透射电子显微镜的检查结果由中国科学院武汉病毒研究所提供
作者贡献声明罗彦竹:采集数据,研究实施,参与选题、设计及资料的分析和解释,统计分析,论文撰写;黎冬平、王育红:酝酿和设计实验,分析数据,对文章的知识性内容作批判性审阅,提供经费;周娜、李俊萍:采集数据、分析数据,修改论文关键性结果和结论
