一种户外开放式微藻培养体系优化
2021-04-11
(河北农业大学生命科学学院,河北 保定 071000)
微藻生长速度快,可积累大量的碳水化合物、脂肪和蛋白质等,生物质产出效率比传统植物高,有极为重要的应用价值[1]。微藻培养可采用开放和封闭等方式,其中开放式培养是利用圆形或椭圆形的跑道培养池在户外进行,成本低,但受自然因素影响大,尤其是水分蒸发量较大,产量较低且不稳定;封闭式培养一般在密闭玻璃,或硬质透明塑料管道、平板式光生物反应器中进行,对培养参数的控制更为严格,产量和质量均较高[2],但所需设备和配套投入成本较高。微藻也可用发酵罐在无菌条件下培养,其培养条件可进行精细调控,单位体积的微藻产量较高,但发酵罐的投入及维护运行费用、培养基成本均高于开放式和封闭式培养[3]。
开放式培养是目前微藻产业化生产过程中采用的主要培养方式,多年来,学界一直试图改进开放式培养的体系。Doucha等[4]建立了一种户外高密度培养微藻的浅层装置,通过倾斜的平板及挡板提高光合作用和二氧化碳利用效率,培养的小球藻产量(干物质)达到11.1 g/(m2·d)[5-8]。Wiley等[9]推出OMEGA培养微藻系统[一种漂浮在海洋水面上的光生物反应器 (PBR)],利用岸上排放的污水和富含二氧化碳的烟气,通过涡轮叶片混合循环藻液,在沉淀室收集微藻并添加新鲜废水来补充营养,产量可达1.3 g/(m2·d)。Zhu等[10-15]用充气膜在海面上形成一个封闭式的微藻培养体系,通过碳酸盐池固定空气中的二氧化碳提供碳源,由周围水体环境调节水温,就地利用淡化海水或者养殖废水进行藻类培养,已应用于盐藻(Dunaliella salina)及螺旋藻(Spirulina) 等微藻的大规模培养试验。Yan等[16]建立一种平板光反应器(Flat-plate photobioreactor,FPPBR),在反应器内加入倾斜挡板,使藻液螺旋流动,在藻细胞生长过程中用闪光效应提高微藻产量,小球藻产量可达21.9 g/(m2·d)[17]。
受生产成本的限制,微藻产业仍处于起步阶段,需降低成本,方可扩大微藻产业规模。小球藻(Chlorella)光合效率高,繁殖速度快,对环境适应性强,应用于食品、饵料、饲料、生物能源、生物固碳、污水处理等多个领域[18]。小球藻的基础和应用已有大量研究,部分小球藻藻种已完成全基因组测序[19-21]。本研究建立一种新的微藻户外开放式培养体系,以小球藻(Chlorella sorokiniana)为模式藻种,探究该体系培养的小球藻基本特征和培养参数,为该培养体系的推广应用提供基础。
1 材料与方法
1.1 材料
小球藻藻种UTEX-1230购于美国德州大学UTEX藻种库,保存及活化藻种所用培养基为TAP(Tris-acetate-phosphate)[22]。固体培养基中加入15 g/L的琼脂。藻种采用逐级扩大培养制备,从斜面到平板活化藻种,一级藻种无菌培养从单克隆到20 mL,二级藻种无菌培养至300 mL,三级藻种非灭菌培养至10 L,生产种非灭菌培养至50 L。
1.2 微藻的浮法培养体系
在综合考虑现有培养体系的基础上,根据微藻农业化培养的理念,设计一种平面、开放和浅层(Flat,open and shallow,FOS,简称浮法)的培养体系(图1)。所用容器为农用塑料筒袋,根据所需体积裁定袋子长度,将袋子平放在台面或地面上,两端下部加上垫板,在中间形成容器,用于盛放微藻培养液。室内培养时用日光灯照射,温室或室外培养时为自然光照射。

图1 微藻浮法培养体系Fig.1 FOS system for microalgae culture
1.3 不同温度对小球藻生长的影响
液体培养基为TAP,在培养基袋外敷以冰袋或热水袋调整温度。设置温度为20、25、30、35、40 ℃,每隔10~20 min测定并调整培养基温度,确保温度基本稳定(±2 ℃)。培养液夜间自然降至室温(17~20 ℃)。起始D(750 nm)为0.5(±0.05),照度为60 μmol·m-2·s-1,光/暗周期为12 h/12 h,在0、6、12、24、36 h时取样,拍照记录小球藻表型变化,测定小球藻培养液在750 nm下的光密度 [D(750 nm)]和pH,由于D(750 nm)与小球藻生物量及细胞数呈线性关系,故采用D(750 nm)值比较不同处理的生物量。
1.4 不同照度对小球藻生长的影响
在步入式光照培养箱内(RBC-1000型,宁波江南仪器厂)通过藻液与光源的距离调节照度,设置7个照度,分别为90、45、20、10、5、2.5 μmol·m-2·s-1及暗处理。起始培养光密度为0.5(±0.05),光/暗周期为12h/12h,温度为30 ℃,培养7 d,每天取样,拍照记录表型变化,测定D(750 nm)和pH。
1.5 培养基中的碳、氮源对小球藻生长的影响
以TAP为基础培养基,分别设置缺氮(不含氯化铵),缺碳(不含醋酸)和缺碳、氮(不含氯化铵和醋酸)的培养基培养小球藻,正对照为TAP培养基,负对照为自来水,培养7 d,取样测量方式同1.4。
1.6 培养基pH值对小球藻生长的影响
以TAP为基础培养基,去除Tris(TAP-Tris)用乙酸调节pH或不调节pH处理,正负对照分别为TAP培养基和自来水,在每天取样后调pH,取样测量方式同1.4。
1.7 户外900 L浮法培养试验
900 L户外培养于2020年9月中下旬,在河北农业大学稻竹园微藻实验基地(115°46′N,38°87′E。户外试验期间日出时间平均为6:09,日落时间平均为18:08,光/暗周期约为12h/12h,日间最高气温平均为22.6 ℃)进行,试验内容主要有培养体系的建立,包括平整地面、铺设塑料筒袋、培养基配置、pH检测、温度检测等,并根据气象资料记录培养期间天气及气温。塑料筒袋宽度1 m,长度15 m。培养液的循环由水泵(WQD4-5-0.37,博洛尼)驱动,水泵日间0.5 h开机1次,每次10 min。每天测定出口处藻液的D(750 nm)、pH值,培养7 d收获,喷雾干燥后测定质量(干物质)。
1.8 数据处理
每组处理设置3个平行试验,在不同时间点测定D(750 nm)和pH值。用Microsoft Excel和IBM SPSS 21软件进行数据处理和差异显著性分析,使用邓肯氏法分析差异显著性,显著性水平α=0.05。
2 结果与分析
2.1 温度对小球藻生长的影响
从外观颜色变化、光密度及pH三方面调查温度对小球藻生长的影响(图2)。由图2_a可见,小球藻培养液颜色随培养时间延长由浅绿变深绿,低温(20、25 ℃)下肉眼可区分的颜色变化发生较晚,而高温处理(35、40 ℃)早期颜色变化更为明显。由图2_b可见,在培养0~12 h时,不同温度下培养的小球藻生长速度有差异,低温培养(20、25 ℃)下小球藻的D(750 nm)增长低于高温(35、40 ℃)培养,30、35、40 ℃培养条件下D(750 nm)差别不大,说明较高的温度适宜小球藻生长。经过12 h的黑暗过夜后,各处理的小球藻D(750 nm)基本维持不变,说明呼吸作用消耗并不明显。24 h后,30 ℃条件下D(750 nm)平均值最高,30 ℃的D(750 nm)平均值为2.481,35 ℃为2.404,25 ℃为2.312。40 ℃为2.170,20 ℃的最低,为1.926。可见,该小球藻可适应较高的培养温度,40 ℃高温对小球藻生长无明显的负影响。由pH值也受温度的影响(图2_c),总体来看,培养温度升高可降低pH波动性。

图2 温度对小球藻生长的影响Fig.2 Effects of different temperatures on the growth of Chlorella sorokiniana
2.2 光照对小球藻生长的影响
7种照度下小球藻的生长情况见图3。图3_a可见,在培养1 d时,较高照度下(90、45和20 μmol·m-2·s-1)藻液颜色发生明显变化,而较低照度下(10、5和2.5 μmol·m-2·s-1)藻液颜色加深程度较小,暗条件下,小球藻颜色几无变化。由图3_b可见,在培养1 d时,各处理组D(750 nm)均升高较为明显,其提高幅度与照度有相关性,即照度越高,光密度越高,照度90 μmol·m-2·s-1下的D(750 nm)平均值低于照度45 μmol·m-2·s-1,说明小球藻有光饱和现象。在后续培养过程中,D(750 nm)持续增加,从5 d起,照度90 μmol·m-2·s-1下D(750 nm)平均值与45 μmol·m-2·s-1持平,说明在更高细胞浓度下,光衰减加重,需更高的光照方可满足小球藻生长对光的需求。在暗条件下,小球藻D(750 nm)基本维持不变。考察各处理和各时间点的培养液的pH值(图3_c),发现藻液pH值在培养1 d时均明显提升,照度45 μmol·m-2·s-1组pH上升最快,达到7.99,在后续培养过程中,藻液pH值基本维持在8.0左右,pH上升可能与小球藻生物量增加相关,而微藻如何影响pH值是值得探究的问题。
2.3 碳源和氮源对小球藻培养的影响
缺碳和缺氮培养基对小球藻培养结果见图4。由表型照片(图4_a)可见,在TAP培养条件下,培养1 d时即可看出明显的小球藻颜色变化,而在缺碳(TAP-C)、缺氮(TAP-N)和缺碳缺氮(TAP-CN)条件下培养,小球藻颜色几无变化。图4_b可见,TAP培养呈现典型的生长曲线,培养1 d时光密度即明显上升,D(750 nm)的上升约在3 d达到峰值,而在其他培养条件下,D(750 nm)的上升均极低,甚至无上升,说明缺碳和缺氮后的培养基不足以满足小球藻生长的需求。比较几种缺素培养基可见,缺氮条件下小球藻有一定的生长,可能是由于在其他培养基成分中有少量氮源。缺碳条件下小球藻几不生长,说明在浮法的半封闭状态下直接固定空气中的二氧化碳对小球藻生长的贡献不大。
2.4 pH值对小球藻培养的影响
由图5_a可见,TAP正对照组藻液随培养时间的延长颜色加深,水培负对照组藻液颜色几无变化。TAP-T(去掉Tris)处理藻液颜色加深,但与TAP组相比,颜色略浅,TAP-T+pH处理组(去掉Tris后)用醋酸调整pH的藻液颜色会逐步加深。

图3 照度对小球藻生长的影响Fig.3 Effects of light intensity on the growth of Chlorella sorokiniana
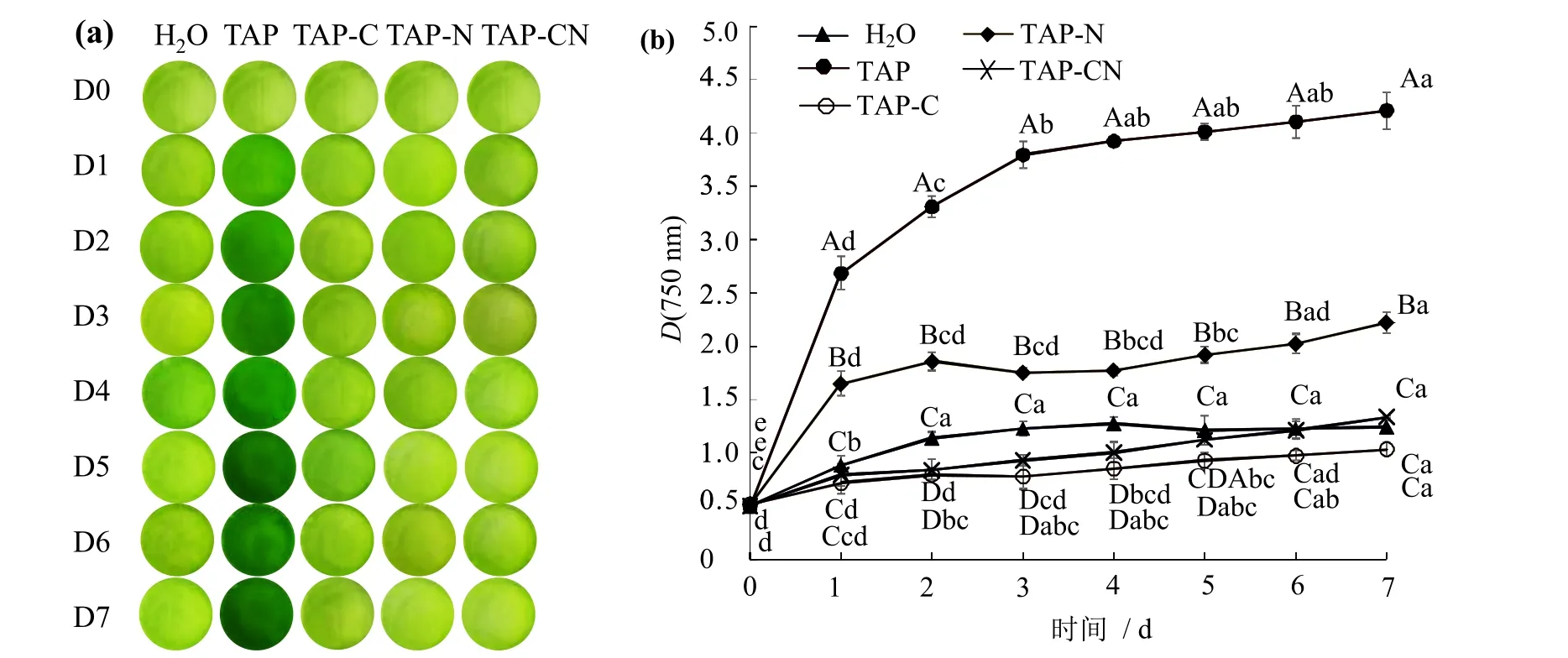
图4 培养基中碳源和氮源对小球藻生长的影响Fig.4 Effects of carbon and nitrogen source on the growth of Chlorella sorokiniana
图5 不同pH处理对小球藻生长的影响Fig.5 Effects of different pH treatment on the growth of Chlorella sorokiniana
图5_b可见,TAP对照组D(750 nm)呈典型的生长曲线,藻液D(750 nm)可达3.625左右,水培负对照组小球藻几无生长。TAP-T处理的小球藻的生长速率略低于正对照,最终D(750 nm)为2.997。TAP-T+pH在培养2 d后D(750 nm)超过正对照TAP组,随培养时间的延长稳定增长,最终D(750 nm)为6.347。与图5_a结果一致。说明适宜的pH对微藻生长有明显促进作用。图5_c可见,水培负对照 组pH在培养1 d 时陡升,pH由7.26上升到10.61,之后在10.50上下浮动。TAP对照的pH在初期也有升高,之后在8.5上下浮动。TAP-T处理的pH在培养初期快速提升,甚至超过水培处理,随培养时间的延长pH稳定在11.70上下。这是因为TAP培养基中的碳源是乙酸,乙酸的存在让培养基pH值降低,随着小球藻的生长和乙酸的消耗,培养基pH值会升高,TAP培养基中含有Tris碱,对pH有一定缓冲作用。TAP-T+pH处理组pH呈波浪式的折线,这是因为每天取样测pH后用乙酸调pH值至7.5左右,之后藻液pH则随着小球藻的生长重返高位。
2.5 户外900 L培养体系的建立及初步试验
户外900 L培养(图6)期间可观察到微藻颜色加深。起始D(750 nm)为0.686,经7 d培养,最终D(750 nm)为5.335,每天D(750 nm)增加约0.7,取部分藻液,经喷雾干燥,收获藻粉生物量(干物质)为0.15 g/(L·d)。下一步将优化户外培养体系,降低环境因素造成的不利影响,不断提高产量。
3 讨论
传统的以跑道池为代表的户外微藻培养体系易受环境因素干扰,生物学产量低,对自然资源的利用率低。为进一步降低微藻培养成本并减少环境因子干扰,本研究设计一种新的户外培养体系,并 以小球藻(C.sorokiniana)为材料,调查在该体系下进行小球藻培养的主要影响因子。

图6 户外900 L规模浮法培养试验Fig.6 Outdoor 900 L scale culture using FOS system
3.1 浮法培养体系的特点
与传统的微藻户外培养方法相比,浮法培养体系以农用塑料筒袋为主要原料,该体系投入低,受光面积增加,对光的利用率提高。浮法可在盐碱地、荒地甚至沙漠土地搭建,也可在屋顶、水面铺设,可临时搭建,随时拆除,场地恢复成本低。浮法培养体系相对封闭,藻液受环境的影响小,液体的蒸发少。整个培养体系易于操作,技术门槛低,普通人员稍加培训即可掌握。浮法培养体系的主要缺点是占地面积较大,不适合在造价高的场地应用。
3.2 环境因子对微藻培养的影响
微藻的户外培养主要受到温度、光照等环境因子的影响。本研究表明,在20~40 ℃温度范围内小球藻均可生长,在30~40 ℃时生长速率较高。一般地,微藻最适生长温度为25 ℃左右,本研究的小球藻可在40 ℃下存活并生长,可见这是耐高温藻种。本研究的浮法户外培养试验中,藻液温度会因户外阳光照射而明显提升,有时较气温提高15 ℃左右,所以筛选耐高温藻种对浮法体系有重要意义。下一步可通过不同藻种的比较及诱变处理,筛选更耐高温的藻种,便于在夏季户外培养。
本研究发现,在浮法培养过程中,试验小球藻表现有光饱和现象,Metsoviti等[23]报道,普通小球藻(Chlorella vulgaris)在照度 130~520 μmol·m-2·s-1范围内未发现明显的光饱和,也有文献报道小球藻(Chlorellasp.)的最适照度为42、90 μmol·m-2·s-1,微拟球藻的最适照度在 100 μmol·m-2·s-1左右,新绿球藻的最适照度在 60 μmol·m-2·s-1左右[24],可见不同藻种对光照的反应不同。但微藻培养的适宜照度均低于夏季中午阳光直射照度,所以在夏季户外培养过程中,可减少阳光直射的时间或强度。另外,光照周期及波长也是户外培养微藻过程中的重要参数,今后可试验不同波长的光对小球藻生长的影响。
3.3 户外微藻培养的成本分析
户外微藻培养需支付的成本包括设施、动力、土地、人工和消耗材料等。与跑道池和管道式光反应器相比,浮法培养的设施成本低,除农用塑料筒袋外,一般只需简单的管道联通即可。浮法养殖微藻可不占用耕地,尤其适合在盐碱地开展,土地占用成本低。此外,城市污水、养殖污水中含有大量的氮、磷等微藻生长所需的营养元素,从降低成本和环保角度考虑,这些污水均可用于微藻培养[25],浮法养藻提供了一个可大面积应用的方法。
3.4 户外培养小球藻的生物学产量分析
微藻的生物学产量与培养条件密切相关,用发酵罐培养小球藻的生物学产量可达24.2 g/(L·d)[26]以上,户外跑道池培养小球藻的生物学产量一般在0.1 g/(L·d)左右[27]。本研究借助浮法培养技术,初步实现0.15 g/(L·d)的产量,在产量方面还有较大的提升空间。小球藻的蛋白质含量远高于粮食作物,如进一步优化培养条件,提高单位面积产量,进而大面积推广,则有望为社会做出更大贡献。
4 结论
本研究初步建立一种新的微藻平面开放浅层培养体系,称为“浮法”。该体系有成本低、光利用率高、不易受外界环境干扰等优点,有推广的潜力。以小球藻为模式,在浮法培养体系下温度、照度、pH值及培养基营养成分等对培养效果均有影响。在河北保定秋季开展了900 L规模的户外培养试验,生物学产量(干物质)为0.15 g/(L·d)。
