光及补料条件对室内管道光反应器中三角褐指藻 生长和岩藻黄素积累的影响
2021-04-11
(华南理工大学食品科学与工程学院,广东 广州 510640)
岩藻黄素(fucoxanthin)又名岩藻黄质,分子式为C42H58O6,与其他常见类胡萝卜素(β-胡萝卜素、虾青素)不同,作为丙二烯类胡萝卜素,除含特殊的共轭双键外,还含有单环氧基、羰基和羟基等基团[1]。因此,岩藻黄素有极强的抗氧化性,在抗炎症、抗癌、抗糖尿病、减肥、护肝等方面有独特的生物活性[2],在食品、医药、化妆品行业应用价值较高。目前,商业化岩藻黄素主要从海带(Laminaria)、枝管藻(Cladosiphon)、马尾藻(Sargassum)、裙带菜(Undaria)等大型褐藻中获得,但它们的岩藻黄素含量极低,通常仅0.01~4.96 mg/g[3],厚实的细胞壁及丰富的藻胶使其岩藻黄素提取和纯化成本过高[4]。海洋硅藻三角褐指藻(Phaeodactylum tricornutum)有生长速率高、可规模化培养的优点,同时岩藻黄素含量高达15.42~16.51 mg/g,且较易提取[5],被公认为藻基岩藻黄素的新来源。
目前,开放式(跑道池)和封闭式光生物反应器(管道、柱状、平板等)已应用于三角褐指藻的人工培养[6]。但跑道池的环境因素难控制,易受敌害生物污染,生产效率低下;柱状和平板反应器大多局限于实验室规模[7],不利于规模化培养;以色列已实现三角褐指藻的户外管道光反应器规模化培养[8],但依然存在户外环境因素可控性差、生产性能不稳定的问题。与户外培养相比,室内人工光源下温度和光照易于精准调控,为保障三角褐指藻的生产效率提供了新方向。本研究以三角褐指藻为研究对象,系统探讨室内管道光反应器中不同光源和调光策略、重复补料分批培养和半连续培养条件对三角褐指藻细胞生长和岩藻黄素积累的影响,为室内可控规模化培养三角褐指藻生产岩藻黄素提供技术支撑。
1 材料与方法
1.1 藻种来源与保藏
三角褐指藻(P.tricornutumCCMP 1327)由中国科学院水生生物学研究所胡晗华研究员惠赠,藻种用f/2固体斜面培养基[9]保种,保存温度4 ℃。
1.2 材料与仪器
岩藻黄素标准品购于美国Sigma公司;海盐购自美国Marineland公司;胰蛋白胨购自广东环凯微生物科技有限公司;叔丁基甲醚、甲醇为色谱纯,丙酮、甘油、尿素等为分析纯,均购于广州卯林仪器有限公司;Accuri C6 流式细胞仪购自美国BD公司;YMC carotenoid column C30 色谱柱购自美国Phenomenon公司;ATC盐度计购自上海淋誉贸易有限公司;SevenEasy pH电极、DOG-209F溶氧电极、WK-206温度电极购自上海兆福环保科技有限公司;CH-ZTW臭氧发生器购自广州创环臭氧电器有限公司;KCTF-100超滤膜系统购自仕必纯贸易上海有限公司;Modulyod冷冻干燥机购自美国热电公司;AWY-18W日光灯管购自中山市奥文照明电器有限公司;HS-5730-60LED LED灯管购自深圳华盛照明有限公司。
1.3 方法
1.3.1室内管道光生物反应器构建 室内管道光反应器如图1所示,由150 L PVC集气桶、PMMA有机玻璃管(直径10 cm,装有比丘射流管)、光源(日光灯或LED灯)、循环水泵等组成,总体积470 L(授权中国实用新型发明专利CN201820049703.7)。藻液的超滤采收装置由多个孔径0.3 μm的中空纤维超滤膜组件并联构成。

图1 室内470 L管道光生物反应器实物图和示意图Fig.1 Physical drawing and schematic diagram of 470-L indoor tubular photobioreactor
1.3.2培养条件与系统控制 三角褐指藻种子液培养采用改良的兼养f/2人工海水培养基[9],配方:海盐20 g/L,甘油9.20 g/L,胰蛋白胨1.17 g/L,尿素0.30 g/L,NaH2PO4·H2O 10 mg/L,Na2SiO3·9H2O 30 mg/L,FeCl3·6H2O 3.15 mg/L,Na2EDTA·2H2O 4.36 mg/L,CuSO4·5H2O 9.80 μg/L,Na2MoO4·2H2O 6.30 μg/L,ZnSO4·7H2O 22 μg/L,CoCl2·6H2O 10 μg/L,MnCl2·4H2O 180 μg/L。一级种子液在250 mL锥形瓶中制备(兼养培养基装液量为100 mL),接入斜面藻苔1环培养至对数期。二级种子液是将一级种子液由250 mL锥形瓶转移到2 L锥形瓶中培养(装液量1 L,接种量为10%)。培养条件:温度(20±1)℃,照度(3 000 ± 500)lx,摇床转速160 r/min。
在室内管道光反应器中,采用f/2人工海水培养基[9]进行自养培养(氮源为 1.76 mmol/L NH4HCO3)。对培养基及整个培养系统进行臭氧消毒后,接入二级种子液,接种密度为4.00×106mL-1。培养过程中温度由温度电极检测并与空调开关相连,当温度超过24 ℃,开启空调降温;当温度降至20 ℃,空调自动停止。培养过程中pH由工业pH电极检测,并通过减压阀和CO2钢瓶相连,当pH超过8.10,减压阀开启通入CO2;当pH降至7.90,减压阀关闭停止通入CO2。培养过程中溶氧由溶氧电极检测(在饱和亚硫酸钠溶液中校零,设置20℃、空气通气量150 L/min条件下f/2培养基溶解氧为100%),并通过变频器和水泵相连,当溶氧超过200%,调节变频器加大泵的流速,加速溶解氧释放。
1.3.3室内日光灯为光源的调光-分批培养 非调光组全程维持照度800 lx,调光组照度前3 d为800 lx,后5 d为3 500 lx。培养过程中每天取样,并记录pH、溶氧、温度的变化,及时检测细胞密度、NH3-N浓度、生物量,镜检三角褐指藻生长情况。藻液经离心、洗涤3次得到藻泥,真空冷冻干燥后得到藻粉,用于测定岩藻黄素。
1.3.4室内LED灯为光源的阶段式调光-重复补料分批培养 日光灯和LED灯光谱数据如图2及表1所示。比较冷白光日光灯和全光谱LED灯的光谱差异可见,二者均为白光,所以主波长较为接近,但LED灯中红光占比较高(表1)。在自养条件下红光占比更高的光源可促进三角褐指藻生物量的积累[10]。而LED灯光谱分布较为均匀,在藻类主要光合作用范围(420~450、630~690 nm)[11]内均有较高的绝对光谱值;日光灯光谱分布不均,并在绿光波长范围内拥有较高的绝对光谱值,不利于三角褐指藻中岩藻黄素的积累[12]。此外,LED灯发热较少[11],比日光灯节省约75%的输入功率[13]。因此,用LED光源代替日光灯光源,通过适当调光并配合补充氮源进行分批培养。
培养过程中阶段式调节照度:10 000 lx(0~0.5 d)、3 300 lx(0.5~3 d)、6 000 lx(3~4.5 d)、5 000 lx(4.5~6 d)、10 700 lx(6~7 d)、13 000 lx (7~17 d)、5 500 lx(17~19 d)。当NH3-N浓度低于0.88 mmol/L时补料,分别在3、7、13 d时补料,共3次。第1次补NH4HCO3至NH3-N浓度为1.76 mmol/L,第2次补氨水至NH3-N浓度为1.76 mmol/L,第3次补氨水至NH3-N浓度为2.64 mmol/L。其余培养条件同1.3.2。

图2 冷白光日光灯和全光谱LED灯的光谱曲线Fig.2 Spectral curves of cold white fluorescent light and full-spectrum LED light

表1 不同光源的光谱分析Table 1 Spectral analysis of different light sources
1.3.5室内LED灯为光源的梯度调光-重复补料半连续培养 采用LED灯为光源,培养过程中梯度调节照度:2 000 lx(0~2 d)、5 000 lx(2~4 d)、8000 lx(4~6 d)、11 000 lx(6~9 d)、14 000 lx(9~13 d)、4 000 lx(13~18 d)、7 000 lx(18~23 d)、10 000 lx(23~25 d)、14 000 lx(25~29 d)。分别在3、6、12 d时共补氨水3次,前2次补氨水到NH3-N浓度为1.76 mmol/L,第3次补氨水到NH3-N浓度为2.64 mmol/L。当生物量超过1.57 g/L后,采收部分藻液,回用上清液,使生物量回到初始状态,并补充氨水至NH3-N浓度为2.64 mmol/L,同时补充铁、硅、磷等微量元素,含量达f/2培养基初始浓度后继续培养直到采收。其余培养条件同1.3.2。
1.4 分析测试
各指标分析时,每个样品均设3个平行,取平均值并计算标准差。
1.4.1生物量[14]三角褐指藻生物量B(g/L)采用干重法测定。吸取2 mL藻液,装于已烘干称重的2 mL离心管中,离心,洗涤,所得藻泥放入80 ℃恒温烘箱烘至恒重。分析天平称量并计算差值。
1.4.2细胞密度和比生长速率[15]细胞密度(mL-1)采用流式细胞仪测定。吸取2 mL藻液于2 mL离心管中,离心、超纯水洗涤,所得藻泥用超纯水重悬至上机浓度,用流式细胞仪测定。
比生长速率μ(d-1)计算公式:

其中,N2和N1是时间点t2和t1的细胞密度(mL-1)。
1.4.3NH3-N浓度[14]NH3-N质量浓度(mg/L)采用意大利HANNA HI 83200多参数水质分析仪测定,专用试剂为HI93715。取待测上清液稀释NH3-N至0~10 mg/L,先后滴加试剂HI93715A、HI93715B反应后进行分析。
1.4.4岩藻黄素的提取及测定[15]称量冻干藻粉10 mg,置入装有适量陶瓷珠的冻存管中,加入1 mL预冷的提取液 [V(甲醇)∶V(丙酮)=1∶1)],震荡器震荡30 s后,用液氮迅速冷冻,离心,收集上清液至15 mL离心管。反复多次提取直至藻粉变白。合并上清液,用氮气吹干有机溶剂,加入定容剂[V(甲醇)∶V(叔丁基甲醚)=1∶1,含质量分数0.1%的二丁基羟基甲苯]定容至1 mL,经0.22 μm微滤孔膜过滤至棕色样品瓶中,用于后续岩藻黄素检测。
藻粉岩藻黄素含量采用高效液相色谱法(HPLC)法检测,全程在无光或弱光下进行。HPLC系统采用美国Waters双1525泵和2996二极管阵列检测器,YMC carotenoid column C30柱(4.6 mm × 150 mm,3 μm)。流动相由甲醇(A)和叔丁基甲醚(B)组成,梯度(体积分数)洗脱:0~6 min,95%→80% A、5%→20% B;6~12 min,80%→60% A、20%→40% B;12~19 min,60%→55% A、40%→45% B;19~20 min,55%→95% A、45%→5% B;20~23 min,95% A、5% B。流速0.80 mL/min,进样量20 μL,440 nm下测定岩藻黄素含量。依据上述条件,按照文献[15]建立岩藻黄素标准曲线,分析藻粉岩藻黄素含量F(质量分数,mg/g)、藻液岩藻黄素质量浓度ρ(mg/L)及岩藻黄素产率R[mg/(L·d)]。算式:

其中,F和B是t时刻的岩藻黄素含量和生物量,F0和B0是t0时刻的岩藻黄素含量和生物量。
1.4.5数据分析 采用 Microcal Origin 8.5 Software对数据进行处理和统计学分析;采用t检验确定各组间差异,P< 0.05为显著差异,P< 0.01为极显著差异。
2 结果与讨论
2.1 室内日光灯光源的调光-分批培养三角褐指藻生长及岩藻黄素累积效率
室内日光灯光源下三角褐指藻生长及过程参数变化见图3。
由图3_a可知,3 d时提高照度后,调光组细胞增长显著提高,平台期缩短,氨氮消耗加速。培养结束时,细胞密度和平均比生长速率分别达1.29×107mL-1和0.16 d-1(表2),分别是对照组的1.14倍和1.23倍(P< 0.05);氨氮平均消耗速率为2.09 mg/(L·d),是非调光组的1.14倍(P< 0.05)。研究表明,随着细胞密度升高,细胞间的光遮蔽作用增强,导致单个细胞的照度下降[16]。因此,适当提高照度可缓解光遮蔽,促进三角褐指藻生长[17],加速营养盐消耗。

表2 日光灯光源自养培养三角褐指藻的生产性能Table 2 Production capacity of P.tricornutum using fluorescent light as light source under autotrophic growth
三角褐指藻的适宜生长温度和pH分别为15~25 ℃[18]和8.00[15]。图3_b表明,在培养过程中除个别时间点外,两培养组温度基本维持在23~27 ℃,较利于三角褐指藻生长。图3_c可见,培养过程中两培养组pH基本维持在7.50~8.20;提高照度后(3 d时),调光组氨氮快速消耗,导致pH下降至7.57;6 d后氨氮消耗减慢,pH基本稳定在8.00左右。图3_d可见,培养过程中非调光组的溶解氧水平较低;而调光组溶解氧在调光后急剧增加,并5 d时达到最高值202%,5 d后,随着细胞密度的增加,溶解氧持续下降,表明随着光遮蔽效应加剧,导致细胞内光合放氧作用降低[19]。
室内日光灯下,调光对三角褐指藻生物量和岩藻黄素积累的影响见图4。提高照度可显著提高细胞密度,但培养结束时两组生物量之间并无显著性差异(图4_a)。WANG等[20]在自养条件下发现,适当提高照度可显著增加三角褐指藻生物量,与本研究结果有所差异,这可能是因为本研究中培养后期氨氮含量过低,限制了三角褐指藻生物量的进一步积累[21]。图4_b表明,培养结束时调光组藻粉岩藻黄素含量、藻液岩藻黄素质量浓度和岩藻黄素产率分别可达17.35 mg/g、9.42 mg/L和0.91 mg/(L·d),分别比非调光组提高17.15%、17.90%和13.75%(P< 0.05)。研究发现,当照度从弱光提升至中等弱光时,三角褐指藻岩藻黄素含量提高42.86%[22],与本研究结果类似。因此,在室内日光灯光源下,提升照度可显著促进三角褐指藻的细胞生长及岩藻黄素积累(P< 0.05)。

图4 室内日光灯阶段调光对三角褐指藻生物量及藻粉岩藻黄素含量、藻液岩藻黄素浓度和岩藻黄素产率的影响Fig.4 Effects of the staged increase of light intensity on biomass and fucoxanthin content in alga powder,concentration in alga suspension of Phaeodactylum tricornutum and fucoxanthin productivity under indoor fluorescent light
2.2 室内LED灯为光源的阶段式调光-重复补料分批培养三角褐指藻生长及岩藻黄素累积效率
调光-重复补料分批培养的三角褐指藻生长和参数变化见图5。由图5_a可知,0~11 d时细胞稳定增长,但两次补料后氨氮消耗速率逐渐下降;11~13 d时细胞进入平台期,此时补料,在富氮条件下积累岩藻黄素[20];13~19 d时,细胞密度先下降后增加。培养结束时细胞密度和平均氨氮消耗速率分别达3.34 × 107mL-1和4.04 mg/(L·d)(表3),分别是日光灯调光组的2.60倍和1.93倍(P< 0.01)。
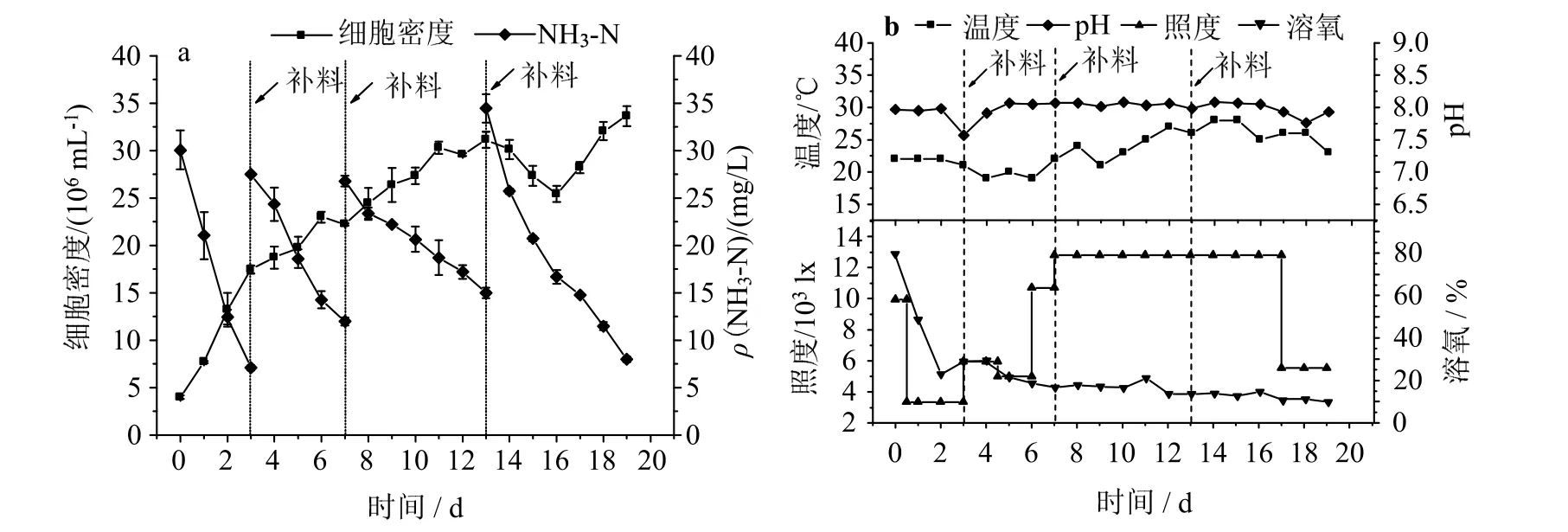
图5 室内LED灯下阶段式调光-重复补料分批培养下细胞密度和NH3-N浓度及温度、pH、照度和溶氧的变化Fig.5 Changes of cell density and NH3-N concentration,temperature,pH,light intensity and dissolved oxygen with the staged increase of light intensity and repeated fed-batch culture under indoor LED light

表3 LED灯下三角褐指藻的生产性能Table 3 Production capability of P.tricornutum under LED light
图5_b可见,pH在培养过程中基本维持在7.60~8.10。前7 d温度基本维持在19~22 ℃,7 d时照度升至13 000 lx后,温度逐步升至28 ℃,导致细胞增长和氨氮消耗放缓(图5_a),17 d时照度降至5 500 lx后,温度逐渐降到23 ℃,细胞开始增长。研究表明,温度会影响微藻酶活性及营养吸收[23],因此,温度高于25 ℃时,三角褐指藻细胞增长受抑制,甚至凋亡[18]。此外,初始照度为10 000 lx,导致初始溶氧高达80%。在1~3 d时,随着照度降至3 300 lx,溶氧降至30%以下;随着培养过程中照度阶梯式提高,溶氧持续降低,可能因为照度提升幅度过大,使三角褐指藻受光抑制,导致细胞放氧活性和光合效率下降[24]。由图6_a可知,培养结束时三角褐指藻的生物量和产率分别可达1.57 g/L和63.48 mg/(L·d)(表3),分别是日光灯调光组的2.91倍和1.31倍(P< 0.05)。由图6_b可知,岩藻黄素含量在培养过程中呈现波动式变化。随着前2 d细胞分裂加速而导致的快速生长,岩藻黄素含量急剧下降;3 d时补料后,岩藻黄素含量短暂上升;11 d时细胞进入平台期(图5_a),岩藻黄素含量快速提高,并在15 d时岩藻黄素含量最高,为17.36 mg/g,比接种时提高14.89%(P< 0.05);16 d后,随着细胞密度再次增加,岩藻黄素含量逐渐降低,但生物量快速提高,并在17 d时岩藻黄素浓度及产率最高,分别为24.37 mg/L、1.17 mg/(L·d),分别是日光灯调光组的2.52倍(P< 0.01)和1.08倍(P> 0.05)。

图6 室内LED灯阶段调光-重复补料分批培养对三角褐指藻生物量、藻粉岩藻黄素含量和藻液岩藻黄素浓度的影响Fig.6 Effects of the staged increase of light intensity and repeated fed-batch culture on biomass,fucoxanthin content in alga powder and concentration in alga suspension of Phaeodactylum tricornutum under indoor LED light
由此可见,与日光灯调光组相比,以LED灯为光源进行调光-重复补料分批培养,可极显著强化三角褐指藻生物量和岩藻黄素含量(P< 0.01)。
2.3 室内LED灯梯度调光-重复补料半连续培养中三角褐指藻生长及岩藻黄素累积效率
由于阶段式调光条件下,照度提升幅度过大使三角褐指藻受光抑制,以及在半连续培养条件下,培养基回用可减少培养中养分和水损失,降低成本,节约资源[25],因此,进行LED灯梯度调光-重复补料半连续培养的实验。
由图7_a可知,第一阶段内细胞密度稳定增长,在13 d时最大,为3.16×107mL-1。藻液采收及培养基回用进入第二阶段,出现3 d的延滞期;随后细胞密度开始缓慢增长,27 d后细胞进入平台期,最终细胞密度仅为1.78×107mL-1,显著低于第一阶段(P< 0.05)。研究表明,在培养过程中三角褐指藻会产生大量胞外多糖分泌物[26],而超过100 ku的胞外多糖会抑制微藻生长[27],推测回用培养基中可能存在的胞外分泌物抑制了三角褐指藻的生长。此外,在第一阶段,随着细胞密度快速增加,氨氮快速消耗,其平均氨氮消耗速率可达4.38 mg/(L·d)(表3)。在第二阶段前3 d,细胞处于延滞期,氨氮几乎不消耗;随着细胞密度的增长,氨氮开始消耗,但其平均氨氮消耗速率仅为1.74 mg/(L·d)(表3),极显著低于第一阶段(P< 0.01)。
图7_b可见,培养过程中温度基本在25 ℃以下,pH值基本维持在7.80~8.20,较利于三角褐指藻生长[11,14]。此外,溶氧基本维持在200%以上,可能是因为细胞可及时适应照度梯度式增强,未受光损 伤[24],从而使胞内光合作用加强,溶氧不断上升。

图7 室内LED灯梯度调光-重复补料半连续培养下细胞密度和NH3-N浓度以及温度、pH、光照强度和溶氧的变化Fig.7 Changes of cell density and NH3-N concentration,temperature,pH,light intensity and dissolved oxygen with the gradient increase of light intensity and semi-continuous culture on under indoor LED light
三角褐指藻生物量和岩藻黄素含量及藻液岩藻黄素浓度见图8。图8_a表明,三角褐指藻在第一阶段培养结束时(13 d)生物量和产率分别可达到1.64 g/L和105.83 mg/(L·d)。第二阶段最终生物量仅为0.73 g/L,极显著低于第一阶段(P< 0.01)。如图8_b所示,在两个阶段中,藻体岩藻黄素含量(干基)均先降后升。第一阶段初期,随着细胞的快速分裂,岩藻黄素含量逐渐下降;3~10 d时,岩藻黄素含量基本不变;10~12 d时,细胞进入稳定期,岩藻黄素含量逐渐提升,并在补料后急剧上升,13 d时达到最大值17.56 mg/g,此时三角褐指藻的岩藻黄素质量浓度和产率分别为28.76 mg/L(图8_b)和1.90 mg/(L·d)(表3),分别比LED调光-重复补料分批培养的最高岩藻黄素浓度和产率提高18.01%(P< 0.05)和62.39%(P< 0.01)。第二阶段培养初期,氮含量充足,但细胞处于延滞期,岩藻黄素含量不断上升;15~26 d时,随着细胞持续增长,岩藻黄素含量不断下降;27 d后,细胞生长进入稳定期,岩藻黄素含量急剧增加,培养结束时达到16.34 mg/g,与第一阶段无显著性差异,但岩藻黄素产率极显著低于第一阶段(P< 0.01)。因此,梯度调光有利于三角褐指藻生物量的积累;但培养基回用后,细胞生长受抑制且延滞期过长,导致三角褐指藻生长和岩藻黄素积累的总体效率显著降低(P< 0.05)。

图8 室内LED灯梯度调光-重复补料半连续培养对三角褐指藻生物量、藻粉岩藻黄素质量分数及藻液质量浓度的影响Fig.8 Effects of the gradient increase of light intensity and semi-continuous culture on biomass,and fucoxanthin content in alga powder,and concentration in alga suspension of Phaeodactylum tricornutum under indoor LED light
综上所述,在优化后的LED梯度调光-重复补料半连续培养模式下,三角褐指藻细胞密度、生物量,岩藻黄素质量分数和产率分别达3.16×107mL-1、1.64 g/L、17.29 mg/g、1.90 mg/(L·d),分别是初始日光灯非调光条件下的2.77倍、3.09倍、1.17倍和2.38倍(P< 0.01)。目前,三角褐指藻规模化培养主要是在户外跑道池中进行,宋培钦等[15]在户外跑道池中分别获得22.71 mg/(L·d)和0.53 mg/(L·d)的生物量产率和岩藻黄素产率,均明显低于本研究;在室内平板反应器中,Guler等[28]自养培养三角褐指藻的最高岩藻黄素产率为1.10 mg/(L·d),也明显低于本研究的最高岩藻黄素产率。目前有关管道光反应器中规模化培养三角褐指藻的研究基本集中在油脂积累[8,29]方面,有关岩藻黄素积累的报道较少。因此,本研究开发的室内管道培养积累岩藻黄素的操作工艺有创新性,可显著强化三角褐指藻的生物量和岩藻黄素积累,为室内管道反应器规模化培养三角褐指藻生产岩藻黄素提供重要技术支持。
3 结语
本研究表明,在室内管道光反应器自养体系下,采用LED灯、梯度提升照度及重复补料半连续培养模式,可显著促进三角褐指藻生物量和岩藻黄素产率,对开发建立管道反应器中生产岩藻黄素的规模化培养技术有重要指导意义。在后续研究中,需进一步探讨不同光质(红光、蓝光、绿光)及其组合对三角褐指藻生长和岩藻黄素产率的影响,有利于继续提升规模化生产岩藻黄素的效率和降低生产成本。
