Gd2O3∶Eu@mSiO2核壳双功能纳米棒的制备及性质
2021-04-10吴燕利徐贤柱
吴燕利 徐贤柱 肖 强*,
(1江西科技师范大学有机功能分子研究所,南昌 330013)
(2江西师范大学生命学院,南昌 330022)
0 引 言
近年来,纳米药物载体受到了科学家们的广泛关注,这主要是由于它们能有效地提高小分子药物在人体内的循环时间、减小其毒副作用,提高疗效[1-3]。介孔SiO2是一种具有规则孔结构的无机纳米材料,由于其比表面积较大、孔径可调且分布均一、孔体积较大、表面易于修饰、稳定性高、生物相容性好等特性,在药物释放领域获得了广泛的应用[4-7]。目前,纳米药物载体的研发主要集中在纳米粒子表面修饰靶向性分子,以保证其精准识别肿瘤细胞[8-9]和开发新型多功能纳米材料[10-12],将化疗药物分子、热疗试剂、光动力治疗试剂以及成像造影剂整合在同一材料上。
稀土离子拥有丰富的能级结构和独特的4f跃迁特性,稀土掺杂纳米发光材料[13-17]由于发光效率高、稳定性好、对生物体的毒性低、荧光寿命长,是目前普遍看好的生物标记材料之一。稀土氧化物具有良好的化学稳定性和热稳定性,是非常好的发光基质。以稀土离子Eu3+、Tb3+、Yb3+/Er3+等为激活离子和以氧化稀土为基质的纳米材料的研究十分活跃。近年来,陆续有研究者将这种传统发光材料用于生物标记[18-25]。以介孔SiO2和稀土氧化物为结构单元的多功能核壳结构纳米粒子将介孔SiO2与稀土氧化物纳米粒子融合在同一材料中,拥有稀土氧化物荧光纳米粒子的优良光学性能和介孔SiO2的高孔容率以及生物相容性好的特质,并有效降低了稀土氧化物本身可能产生的细胞毒性,在药物输送和荧光成像方面展现出独特的优势[26-32]。Yang等[30]将Gd2O3∶Yb/Tm纳米粒子包裹在空心SiO2的表面制备SiO2@Gd2O3∶Yb/Tm空心胶囊,该空心胶囊既可以用于药物缓释又可以用于荧光成像。Song等[31]制备了介孔SiO2包裹的Gd2O3纳米粒子并将其成功用于肿瘤细胞的标记和盐酸阿霉素的负载和缓释。Dai等[32]将长余辉 ZnGa2O4∶Cr3+,Bi3+包裹在 Gd2O3@mSiO2核壳纳米粒子的表面制备出长余辉Gd2O3@mSiO2@ZnGa2O4∶Cr3+,Bi3+纳米复合材料,并将其应用于药物缓释和监测。
综上所述,将介孔SiO2与稀土氧化物荧光纳米粒子2种功能基元有效结合,可以充分发挥2种材料的优势,在药物输送、跟踪以及肿瘤细胞荧光标记等方面有潜在应用价值。目前,这方面的研究主要集中在球形核壳粒子的制备,对于棒状Gd2O3与介孔SiO2复合材料的研究,目前还未见报道。然而,有研究表明[33-34],相对于球形粒子,棒状结构的纳米粒子在细胞吞噬实验中,能更快、更大程度地进入细胞内部。我们采用水热法制备Gd(OH)3∶Eu纳米棒,利用十六烷基三甲基溴化铵(CTAB)作为模板,通过正硅酸乙酯(TEOS)水解将介孔SiO2包裹在纳米棒的表面,煅烧后得到以Gd2O3∶Eu纳米棒为内核,以介孔SiO2为外壳的多功能核壳纳米棒。
1 实验部分
1.1 仪器和药品
所用药品有稀土氯化物(由99.99%的氧化稀土经分析纯盐酸溶解,蒸去多余的酸后用蒸馏水配制)、浓氨水(25%)、TEOS(AR)、CTAB(AR)。实验用水为去离子水。
采用FEI公司Quanta200F场发射扫描电镜(SEM,15 kV)和TecnaiG20场发射高分辨透射电镜(TEM,200 kV)观察产物的形貌;利用BRUKER D8 Focous X射线衍射仪表征产物的晶体结构,Cu Kα辐射,λ=0.154 06 nm,电压40 kV,电流30.0 mA,扫描范围2θ=10°~80°;通过Perkin-Elmer C99957红外光谱仪用溴化钾压片对样品进行成分分析,测试范围500~4 000 cm-1;采用Microtrac NPA152粒度分析仪测量样品的粒径分布;采用BELSORP-mini Ⅱ型比表面积及微孔孔隙仪分析样品的孔性能,并通过Brunauer-Emmett-Teller(BET)方法计算表面积;采用Hitachi F4600荧光光谱仪测试样品的激发和发射光谱;采用NM120-Analyst磁共振成像测试仪对样品进行磁共振成像表征;采用Olympus FV1000共聚焦显微镜观察细胞的荧光成像;采用ELX-800型酶标仪测定MTT(四甲基偶氮唑蓝)吸光值。
1.2 Gd2O3∶Eu@mSiO2多功能核壳纳米棒的制备
核壳复合物的制备流程图如图1所示。

图1 Gd2O3∶Eu@mSiO2合成流程图Fig.1 Fabrication process of Gd2O3∶Eu@mSiO2
1.2.1 Gd(OH)3∶Eu纳米棒的制备
采用水热法制备Gd(OH)3∶Eu纳米棒。在烧杯中加入 GdCl3(0.05 mol·L-1,38 mL)和 EuCl3(0.05 mol·L-1,2 mL),边搅拌边加入氨水至 pH=9,将得到的混合物搅拌均匀,转移至水热反应釜中,然后置于180℃烘箱中保温10 h,自然冷却至室温,最后得到白色浑浊溶液。离心分离得到白色沉淀物Gd(OH)3∶Eu,用乙醇和水反复洗涤沉淀,产品放入80℃烘箱中烘干。
1.2.2 Gd(OH)3∶Eu@SiO2-CTAB的制备
在250 mL圆底烧瓶中加入100 mg的Gd(OH)3∶Eu纳米棒,80 mL乙醇、10 mL水和100 mg CTAB,超声分散10 min后,边搅拌边逐滴加入200µL TEOS和0.5 mL浓氨水,继续搅拌12 h。将混合物离心分离,得到白色沉淀物。用无水乙醇和去离子水反复洗涤、沉淀3次后置于80℃烘箱中干燥。
1.2.3 Gd2O3∶Eu@mSiO2的制备
将干燥的Gd(OH)3∶Eu@SiO2-CTAB样品转移到坩埚中,在马弗炉中800℃下煅烧3 h,冷却后得到Gd2O3∶Eu@mSiO2样品。
1.3 细胞荧光成像
在无菌条件下,将NCI-H460肺癌细胞接种于共聚焦专用的培养皿中,待细胞贴壁后弃去培养液,用PBS缓冲液(pH=7.4)洗涤细胞3次,再加入培养基稀释的Gd2O3∶Eu@mSiO2溶液(100 µg·mL-1,100µL),继续孵育4 h,用PBS缓冲液洗掉未结合的Gd2O3∶Eu@mSiO2核壳纳米棒,于共聚焦显微镜下观察细胞的荧光图像。
1.4 细胞活力测试
用NCI-H460肺癌细胞测定样品的细胞毒性。NCI-H460以5×104mL-1的细胞浓度接种于96孔板上,每孔100µL,在体积分数5%的CO2、37℃中孵育24 h,待细胞贴壁后,弃去原有培养基,向孔中加入200 µL不同浓度(0、25、50、100、200 µg·mL-1)的Gd2O3∶Eu@mSiO2培养基分散液,每个浓度样本设平行的8个副孔。再将96孔板放入培养箱中孵育24 h,然后向每孔中加入现配的MTT溶液(5 mg·mL-1,20µL),培养4 h,待MTT还原为蓝紫色结晶甲臜,移去上清液,然后向每个孔中加入200µL DMSO(二甲基亚砜),使蓝紫色甲臜完全溶解,摇匀后使用酶标仪测定溶液在490 nm的吸光度(A)值,细胞的存活率按如下公式计算:Cell viability=(Asample/Acontrol)×100%,其中Asample为各孔在490 nm的吸光度,Acontrol为空白对照组在490 nm的吸光度。
1.5 布洛芬的吸附和释放实验
100 mg Gd2O3∶Eu3+@mSiO2样品加入到布洛芬(IBU)的正己烷溶液(10 mL,50 mg·mL-1)中,将此混合液在密封条件下30℃搅拌24 h,之后离心分离装载了IBU的样品,用正己烷清洗3次,洗去样品表面吸附的IBU(只保留样品孔道中的IBU),之后在60℃干燥12 h,装载了IBU的样品命名为IBU-Gd2O3∶Eu3+@mSiO2,采用热重(TG)分析来确定IBU的负载量。
将IBU-Gd2O3∶Eu3+@mSiO2样品转移至锥形瓶中,浸泡于10 mL PBS缓冲溶液中(pH=7.4),37℃缓慢振荡,每隔一定的时间离心一次,用移液枪移取1 mL上层清液,立即用等量的新鲜PBS代替。用紫外可见分光光度计测定上清液在221 nm处的吸光度,计算IBU的释放量。
2 结果与讨论
2.1 SEM及TEM的表征
采用SEM和TEM对粒子的形貌进行观察,如图2和图3所示。Gd(OH)3∶Eu由尺寸均匀、分散性良好的纳米棒组成,纳米棒的长度~400 nm,直径~100 nm(图 2)。

图2 Gd(OH)3∶Eu的SEM图Fig.2 SEM images of Gd(OH)3∶Eu
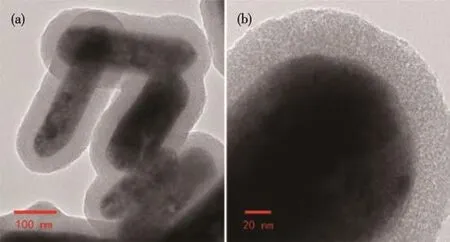
图3 Gd2O3∶Eu@mSiO2核壳纳米棒的TEM图Fig.3 TEM images of Gd2O3∶Eu@mSiO2
由图3可知,制备的Gd2O3∶Eu@mSiO2为典型的核壳结构,核层Gd2O3∶Eu继承了其前驱体Gd(OH)3∶Eu的棒状形貌,尺寸也基本保持一致,壳层的厚度大约是30 nm,介孔均匀地分布在壳层表面。
2.2 XRD分析
分别对前驱物和经过800℃煅烧后的产物进行XRD分析,如图4所示。由图4a可见,前驱体样品XRD图和Gd(OH)3的标准图(PDF No.38-1042)完全一致,而且没有杂质峰,说明所得到的样品为六方相的Gd(OH)3∶Eu。经过800℃煅烧后得到的样品XRD图和Gd2O3标准卡片(PDF No.12-0797)基本一致,未观察到SiO2的峰(图4b),说明介孔硅为无定形结构,煅烧后所得样品为Gd2O3∶Eu@mSiO2。

图4 (a)Gd(OH)3∶Eu和(b)Gd2O3∶Eu@mSiO2的XRD图Fig.4 XRD patterns of(a)Gd(OH)3∶Eu and(b)Gd2O3∶Eu@mSiO2
2.3 FTIR分析
为了进一步证实IBU分子已成功负载到Gd2O3∶Eu@mSiO2核壳纳米棒中,对样品进行了详细的FTIR光谱研究(图5),包括对纯IBU分子(曲线a)和IBU负载产物(曲线b)的谱图分析。在曲线a中,1 720、2 965(2 884)、1 516(1 450)和1 421 cm-1处的吸收带归属于IBU分子的—COOH、C—Hx键、四元碳原子和—OH的弯曲振动,可以确定为IBU的结构。在曲线b中,除了在1 720~1 421 cm-1处的几个吸收峰(图中星号处)可以归属于IBU分子外,1 080和796 cm-1处的强吸收峰分别归属于Si—O—Si的不对称拉伸和对称拉伸弯曲,965 cm-1处的峰值对应于Si—OH对称拉伸弯曲,这些峰值表明IBU分子已成功负载在Gd2O3∶Eu@mSiO2中。

图5 (a)IBU和(b)IBU-Gd2O3∶Eu@mSiO2的FTIR谱图Fig.5 FTIR spectra of(a)IBU and(b)IBU-Gd2O3∶Eu@mSiO2
2.4 BET比表面积
Gd2O3∶Eu@mSiO2的N2吸附-脱附等温线如图6所示,为典型的Ⅵ型吸附-解吸等温线,表明Gd2O3∶Eu@mSiO2拥有介孔结构,孔径主要分布在1.74 nm左右,这与TEM中观察到的结果是一致的。通过BET方法计算得到其表面积为192 m2·g-1。

图6 Gd2O3∶Eu@mSiO2样品的N2吸附-脱附等温线及孔径分布图(插图)Fig.6 N2adsorption-desorption isotherm and pore size distribution(inset)of Gd2O3∶Eu@mSiO2
2.5 荧光性质
图7为Gd2O3∶Eu@mSiO2在室温下测得的激发(左)和发射(右)光谱,以613 nm为监测波长,测得的激发光谱中的最强激发峰位于254 nm,然后以254 nm为激发光波长测得其发射光谱,其591 nm处的发射峰对应于5D0→7F1跃迁,613和627 nm处2个强峰都对应Eu3+的5D0→7F2的磁偶极跃迁,654 nm处发射峰对应5D0→7F3跃迁发射的红光。其中613 nm处的发射峰最强,显示出以橙红色为主的发光特征。
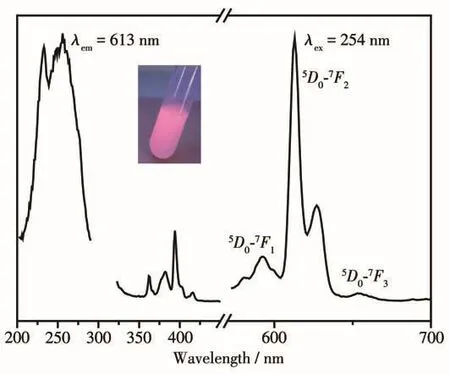
图7 Gd2O3∶Eu@mSiO2样品的激发(左)和发射(右)光谱Fig.7 Excitation(left)and emission(right)spectra of Gd2O3∶Eu@mSiO2
对IBU-Gd2O3∶Eu@mSiO2的发光强度与IBU释放量的相关性进行研究发现,其发光强度与释放量有很强的相关性。如图8所示,对比负载前后的发射光谱曲线可知,负载的IBU严重淬灭了Eu3+的发光,药物中具有高频声子振动的有机基团对药物的发光有明显的抑制作用。图9为Eu3+的发光强度与IBU-Gd2O3∶Eu@mSiO2样品中IBU的释放量之间的关系曲线,随着IBU的不断释放,样品发光强度逐渐增大。IBU的释放会减弱淬灭效应,进而增强药物载体体系的发光强度[35-36]。这一趋势表明,该功能材料在释放过程中可通过光致发光强度跟踪或监测。

图8 (a)IBU-Gd2O3∶Eu@mSiO2 和(b)Gd2O3∶Eu@mSiO2的发射光谱Fig.8 Emission spectra of(a)IBU-Gd2O3∶Eu@mSiO2and(b)Gd2O3∶Eu@SiO2

图9 IBU-Gd2O3∶Eu@mSiO2样品的发光强度与IBU释放量的关系Fig.9 Emission intensity of Eu3+in IBU-Gd2O3∶Eu@mSiO2 as a function of the cumulatively released IBU
为了研究Gd2O3∶Eu@mSiO2核壳纳米棒对细胞的荧光标记效果,我们将核壳纳米棒与NCI-H460肺癌细胞共孵。图10为质量浓度为100µg·mL-1的Gd2O3∶Eu@mSiO2核壳纳米棒的培养基分散液作用NCI-H460肺癌细胞4 h后,在405 nm激发下的荧光显微照片。结合明场和暗场中的成像,可以看出红色荧光是由Gd2O3Eu@mSiO2核壳纳米棒发出的,这表明Gd2O3∶Eu@mSiO2核壳纳米棒能穿透细胞膜,成功标记NCI-H460肺癌细胞。

图10 Gd2O3∶Eu@mSiO2核壳纳米棒与肺癌细胞共孵后的共聚焦荧光显微照片Fig.10 Confocal fluorescence photomicrographs of NCI-H460 cell incubated with Gd2O3∶Eu@mSiO2core-shell nanorods
2.6 药物负载和缓释
选择IBU作为模型药物研究Gd2O3∶Eu@mSiO2体系的药物负载和缓释行为,首先通过TG分析来确定样品对IBU的负载量,如图11所示,负载前和负载后的失重相差10.25%,可知IBU的负载量为10.25%。
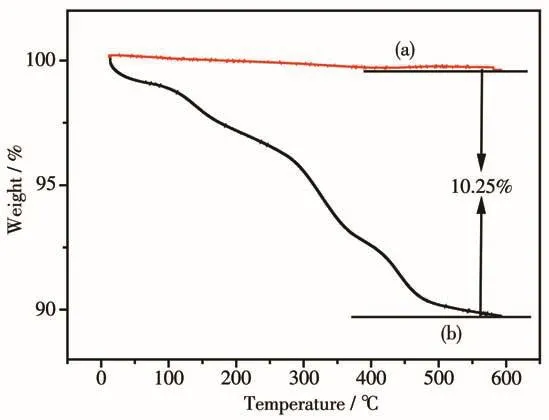
图11 (a)Gd2O3∶Eu@mSiO2 和(b)IBU-Gd2O3∶Eu@mSiO2的TG曲线Fig.11 TG curves of(a)Gd2O3∶Eu@mSiO2and(b)IBU-Gd2O3∶Eu@mSiO2
图12为IBU-Gd2O3∶Eu@mSiO2在pH=7.4的PBS缓冲溶液中的累积药物释放行为,由图可知,该系统中的IBU在刚开始时被较迅速地释放,这可能是核壳纳米棒表面吸附的IBU被快速释放,在12 h内释放达到了54.8%,接下来更缓慢的释放行为可能是由于介孔SiO2孔道中的IBU被缓慢地释放。结果表明,该Gd2O3∶Eu@mSiO2核壳纳米棒具有明显的缓释功能。
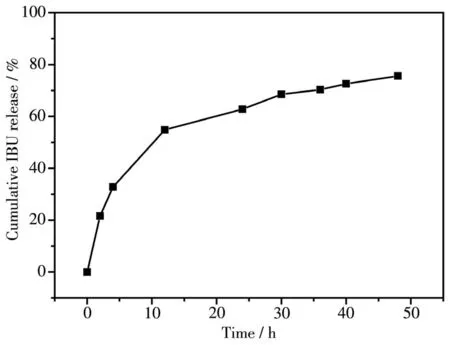
图12 IBU-Gd2O3∶Eu@mSiO2在PBS缓冲体系中的释放曲线Fig.12 Cumulative IBU release profile of IBU-Gd2O3∶Eu@mSiO2in PBS buffer solution
2.7 Gd2O3∶Eu@mSiO2核壳纳米棒的生物相容性
材料的生物相容性对于其在生物医学领域的应用非常重要。采用MTT法研究Gd2O3∶Eu@mSiO2核壳纳米棒对NCI-H460肺癌细胞的毒性,其结果如图 13 所示。在 0~200 µg·mL-1范围内,将 Gd2O3∶Eu@mSiO2核壳纳米棒与肺癌细胞共孵育24 h,发现核壳纳米棒对吸光度值的影响很小,在所有剂量下,NCI-H460细胞都保持较高的活性(>90%)。结果表明,合成的Gd2O3∶Eu@mSiO2核壳纳米棒具有良好的生物相容性。本研究中提出的核壳双功能纳米棒是未来生物医学工程中潜在的多功能生物材料。
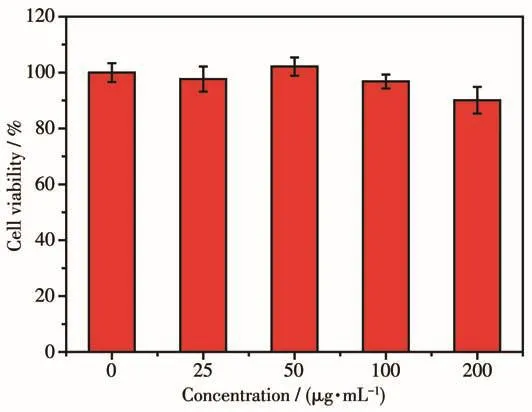
图13 不同浓度Gd2O3∶Eu@mSiO2核壳纳米棒作用于NCI-H460肺癌细胞24 h后的细胞相对活力图Fig.13 In vitro cells relative viabilities of NCI-H460 lung cancer cells after incubating with different concentrations of Gd2O3∶Eu@mSiO2 core-shell nanorods for 24 h
3 结 论
综上所述,我们通过简单的水热法和正硅酸乙酯水解法制备了一种新颖的Gd2O3∶Eu@mSiO2核壳双功能(荧光和介孔)纳米棒。结果表明,Gd2O3∶Eu@mSiO2具有明确的棒状核壳结构和优异的发光性能。以IBU作为模型药物研究其药物释放行为,结果证明可以根据Gd2O3∶Eu@mSiO2药物传输体系的发光强度的变化来跟踪和监测药物的释放过程。载药量和释放度研究表明,该体系具有良好的吸附和持续释放性能。因此,合成的Gd2O3∶Eu@mSiO2在荧光成像、药物缓释和药物追踪等领域具有潜在的应用价值。
