5 个观赏雷竹变型对低温胁迫的生理响应
2021-04-10杨振亚赵建诚袁金玲周本智
杨振亚,赵建诚,袁金玲,王 波,李 琴*,周本智
(1. 浙江省林业科学研究院,浙江省竹类研究重点实验室,浙江 杭州 310023;2. 中国林业科学研究院亚热带林业研究所,浙江 杭州 311400)
低温是限制植物生长发育和影响植物地理分布的主要环境因素之一[1]。由于纬度和地形的差异,低温限制成为优良林木品种引种和培育迫切需要解决的难题[2-3]。植物通过自身的生理和形态的可塑性来提高在低温条件下的适应性[1,4],如抗氧化酶系统(超氧物歧化酶、过氧化物酶、过氧化氢酶)将在低温条件下被激活以抵御超氧自由基的毒害[5-6];植物组织中可溶性蛋白、非结构性碳水化合物以及游离脯氨酸含量的增加也可提高细胞液渗透势,降低冰点,从而有效地避免细胞液结冰[7-8]。由于树种对低温的耐受能力不同,了解目标树种的耐寒极限在林木培育和良种引进过程中尤为重要。当植物受到低温胁迫时,电解质因细胞膜被破坏而大量外渗,通过测定组织电导率可判定植物受低温伤害程度[9-11]。然而,判断引进树种是否适合引种地栽培仍然需要根据生理指标进行综合判定[12]。
雷竹(Phyllostachys praecoxC. D. Chu et C. S.Chao ‘Prevernalis’)隶属禾本科(Gramineae)刚竹属(PhyllostachysSieb. et Zucc.),是早竹的栽培变型。雷竹易栽培、产量高、竹笋品质好,是我国长江以南地区重要的笋用竹种,具有较高的经济价值和生态服务价值[13];同时,具有特殊的秆形、叶形、秆色的雷竹变型也极具观赏价值;但选育优良观赏雷竹品种并推广栽培需要对雷竹的生长习性、抗逆能力进行综合评价。目前,关于观赏竹对环境因子的适应性研究主要包括温度[14-15]、水分[16-17]、养分[18-19]等方面,通过综合评价的方法筛选出一些抗逆性较好的观赏竹品种,如耐旱性较好的黄秆京竹(Ph. aureosulcataMcClure ‘Aureocarlis’),耐寒性较好的平安竹(Pseudosasa japonicavar.tsusumianaYanagita)和金镶玉竹(Ph. aureosulcataMcClure‘Spectabilis’)等。关于雷竹适应性的研究主要包括经营措施[20]、养分[21]、水分[22]、土壤盐碱度[23]等方面,而针对观赏雷竹品种耐寒性的研究还相对匮乏。因此,本研究对5 个具有良好观赏性表型的雷竹变型进行低温胁迫试验,采用Logistic 方程拟合、主成分分析等方法对其耐寒性进行综合评价,以期为观赏性雷竹的引种和培育提供参考。
1 材料与方法
1.1 试验材料
试验材料取自浙江省杭州临安太湖源观赏竹种园有限公司竹种园(119°95′ E,29°48′ N),该地地处浙江省西北部,亚热带季风气候区南缘,温暖湿润,光照充足,年均降水量1 613.9 mm,年均气温13~22℃,无霜期平均为237 d,受台风、寒潮和冰雹等灾害性天气影响。本研究的5 个观赏雷竹变型均于2016 年引种栽培,基本信息见表1。每个品种以同样的种植密度定植于20 m2的样地内。采用同样的田间管理方式(灌溉、除草等),以保证各品种生长条件基本一致。
1.2 试验方法
于2019 年9 月随机采集5 个观赏雷竹变型标准木的功能叶10 g,置于0~2℃冰盒中带回实验室。将叶片用清水洗净并用吸水纸擦干表面水分备用。试验设置0、-5、-10、-15、-20、-25、-30℃ 7 个温度梯度,将等量的叶片分为 7 个试验组分别进行不同温度处理,处理时间24 h,每个试验组3 次重复。用超低温冷冻循环仪(DX-4015,北京长流科学仪器有限公司)以5℃·h-1逐渐降温到设置温度,处理完毕后,以5℃·h-1逐渐升温至0℃,然后在0℃冰箱内保存待测,待测时间小于1 h。

表1 5 个雷竹品种基本信息Table 1 Basic information of 5 varieties
叶片细胞膜损害程度测定:(1)相对电导率(REC):取待测叶片用打孔器制成大小相同的圆片,随机选取形状完整的20 片,放置于试管底部,加入20 mL 去离子水,然后将试管放入真空干燥箱中用真空抽气3 次,每次20 min,常温下放置6 h,期间每30 min 振荡一次试管,用电导率仪(STARTER3000C,浙江纳德科学仪器有限公司)测定电导率值S1,再将试管置于水浴锅中沸水浴40 min 后冷却,在常温下稳定30 min 后测定电导率值S2。以去离子水电导率值S0作为对照。根据公式REC=(S1-S0)/(S2-S0)计算相对电导率。(2)丙二醛(MDA)含量用硫代巴比妥酸(TBA)显色法测定。
叶片抗氧化酶活性测定:超氧化物歧化酶(SOD)采用氮蓝四唑法(NBT 法)测定;超氧化物酶(POD)的活性采用愈创木酚法测定;过氧化氢酶(CAT)采用紫外吸收法测定。
渗透调节物质测定:分别测定可溶性蛋白和脯氨酸含量分析雷竹在低温条件下的生理可塑性。可溶性蛋白含量采用考马斯亮蓝染色法测定;脯氨酸含量采用酸性茚三酮比色法测定。以上生理指标均参照李合生的植物生理试验方法[24]。
1.3 数据处理
1.3.1 Logistic 方程的建立和LT50确定 运用SPSS17.0 软件将相对电导率拟合Logistic 方程y=k/(1+ae-bx),后将获得的参数计算后得出低温半致死温度(LT50)。公式中x为处理温度,y代表相对电导率,k、a、b为参数,k为y的最大极限值,b反映了x与y 之间的对应关系,a表示曲线对原点的相对位置,如果y为累计频率,则常数k为1[25]。当方程曲线出现拐点时的温度即为引起膜不可逆伤害的临界点,可用来确定植物组织的LT50,从而定量判断5 个雷竹变型的抗寒能力[26]。为了方便对a、b求解,对原拟合方程进行线性化:令y1= ln[(k-y)/y],则y1= -bx+lna,从而将Logistic 方程转化为y1与处理温度x之间的直线方程,再运用SPSS 17.0 软件进行线性拟合可求出a、b值以及相关系数R,而LT50=(lna)/b[27]。
1.3.2 隶属函数值的计算 根据模糊数学的隶属函数法计算5 个雷竹变型耐寒性的隶属函数值,从而得到综合排名。隶属函数值可根据公式求出:当指标与耐寒性呈正相关时(如抗氧化酶活性、可溶性蛋白和脯氨酸含量),Uijk= (Xijk-Xmin)/(Xmax-Xmin);而指标与耐寒性呈负相关时(如相对电导率和MDA 含量),Uijk= 1-(Xijk-Xmin)/(Xmax-Xmin),其中,i代表竹种,j代表温度,k代表指标,Uijk为第i个竹种在第j个温度处理下第k项指标的隶属函数值,Xmin表示所有竹种所有温度下第k项指标的最小值,Xmax表示第k项指标的最大值[2]。
1.3.3 差异性分析(ANOVA)及主成分分析(PCA) 对所有生理指标用SPSS 17.0 软件进行双因素方差分析(ANOVA),采用Canoco 5.0 软件进行主成分分析(PCA)和冗余分析(RDA),确定生理指标变化的主分量,计算其载荷值,并分析各生理指标与温度间的相关性。根据主成分分析结果计算生理参数的主成分载荷量,从而确定影响雷竹耐寒性的主要生理参数。运用Origin 9.0 软件进行图表绘制。

图1 低温胁迫对5 个雷竹变型相对电导率的影响Fig. 1 Effect of low temperature on relative conductivity of 5 varieties
2 结果与分析
2.1 低温胁迫对5 个雷竹变型叶片相对电导率的影响
由图1 可知:5 个雷竹变型叶片相对电导率(REC)均随着温度的降低呈先上升后下降的趋势;但弯秆雷竹叶片相对电导率在-20℃达到峰值,而其余4 种雷竹则均在-25℃达到峰值。另外,5 个雷竹变型相对电导率的峰值差异显著,其中,花秆雷竹相对电导率最高,而细叶乌头雷竹相对电导率最低。根据相对电导率的结果拟合Logistic方程,曲线的拟合效果均达到极显著水平(P<0.01)。根据a、b值分别计算出5 个雷竹变型的半致死温度(LT50)。结果显示:弯秆雷竹的LT50最低(-18.73℃),而花秆雷竹的LT50最高(-14.57℃)(表2)。
2.2 低温胁迫对5 个雷竹变型叶片抗氧化酶活性的影响
由图2 可知:5 个雷竹变型叶片超氧化物歧化酶(SOD)活性随处理温度的降低均呈先上升后下降的趋势。花秆雷竹SOD 活性在-10℃时达到峰值,而其余4 种雷竹均在-15℃时达到峰值。5 个雷竹变型SOD 活性上升幅度为:黄条雷竹(590.72)> 黄皮雷竹(548.52)> 弯秆雷竹(471.17)> 细叶雷竹(428.97)> 花秆雷竹(393.81)。双因素方差分析发现,SOD 活性在不同温度间和不同变种间差异极显著(P< 0.01)(表3)。

表2 5 个雷竹变型在低温处理下相对电导率的回归方程和半致死温度Table 2 Regression equation of conductivity under low temperature treatment and LT50 of 5 varieties

图2 低温胁迫对5 个雷竹变型SOD 活性的影响Fig. 2 Effect of low temperature stress on SOD activity of 5 varieties
超氧化物酶(POD)和过氧化氢酶(CAT)活性随温度变化的趋势与SOD 的类似。花秆雷竹的POD活性在-10℃时达到极值,而其余4 种雷竹均在-15℃时达到峰值。5 个雷竹变型POD 活性上升幅度为:黄皮雷竹(2 577.78)> 黄条雷竹(2 266.67)>细叶乌头雷竹(2 155.56)> 弯秆雷竹(2 133.33)>花秆雷竹(1 555.56)(图3)。5 个雷竹变型CAT活性均在-15℃时达到峰值,其上升幅度为:弯秆雷竹(540.74)> 黄条雷竹(511.11)> 细叶乌头雷竹(488.89)> 黄皮雷竹(481.48)> 花秆雷竹(437.04)(图4)。

表3 变种和温度处理的双因素方差分析Table 3 Two-way variance analysis on varieties and temperatures

图3 低温胁迫对5 个雷竹变型POD 活性的影响Fig. 3 Effect of low temperature stress on POD activity of 5 varieties
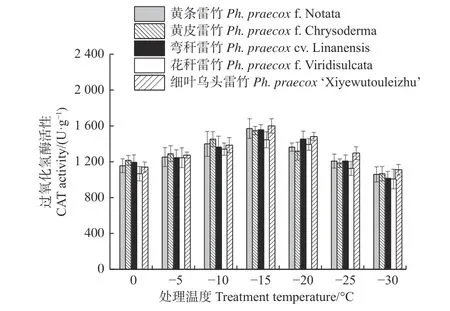
图4 低温胁迫对5 个雷竹变型CAT 活性的影响Fig. 4 Effect of low temperature stress on CAT activity of 5 varieties
2.3 低温胁迫对5 个雷竹变型叶片丙二醛含量的影响
由图5 可知:5 个雷竹变型叶片中丙二醛(MDA)含量随处理温度的降低均呈先上升后下降的趋势。花秆雷竹的MDA 含量在-15℃时达到峰值,而其余4 种雷竹均在-20℃时达到峰值。5 个雷竹变型MDA 含量上升幅度为:花秆雷竹(28.71)> 黄条雷竹(24.9)> 细叶乌头雷竹(24.8 ) > 弯 秆 雷 竹(24.27 ) > 黄 皮 雷 竹(23.59)。双因素方差分析发现,MDA 含量在不同温度间和不同变种间差异极显著(P< 0.01),但5 个雷竹变型叶片MDA 含量在达到峰值后的下降程度很小,其在-30℃时的含量仍远高于0℃时的含量。

图5 低温胁迫对5 个雷竹变型MDA 含量的影响Fig. 5 Effect of low temperature stress on MDA contents of 5 varieties
2.4 低温胁迫对5 个雷竹变型叶片可溶性蛋白及脯氨酸含量的影响
由图6 可知:5 个雷竹变型叶片中可溶性蛋白含量均随处理温度的降低均呈先上升后下降的趋势。弯秆雷竹可溶性蛋白含量在-20℃时达到峰值,而其余4 种雷竹均在-15℃时达到峰值。5 个雷竹变型可溶性蛋白含量的上升幅度为:黄皮雷竹(0.236)> 细叶乌头雷竹(0.229)> 弯秆黄皮雷竹(0.221)> 黄条雷竹(0.219)> 花秆雷竹(0.179)。双因素方差分析发现,可溶性蛋白含量在不同温度间和不同变种间差异极显著(P<0.01)。
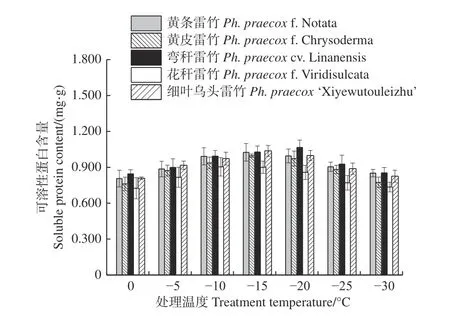
图6 低温胁迫对5 个雷竹变型可溶性蛋白含量的影响Fig. 6 Effect of low temperature stress on soluble protein contents of 5 varieties
由图7 可知:5 个雷竹变型叶片中脯氨酸含量均随处理温度的降低均呈先上升后下降的趋势,且均在-15℃时达到峰值。5 个雷竹变型脯氨酸含量的上升幅度为:弯秆雷竹(56.08)> 黄条雷竹(55.35)> 黄皮雷竹(54.35)> 细叶乌头雷竹(50.56)> 花秆雷竹(47.09)。双因素方差分析发现,可溶性蛋白含量在不同温度间和不同变种间差异极显著(P< 0.01)。
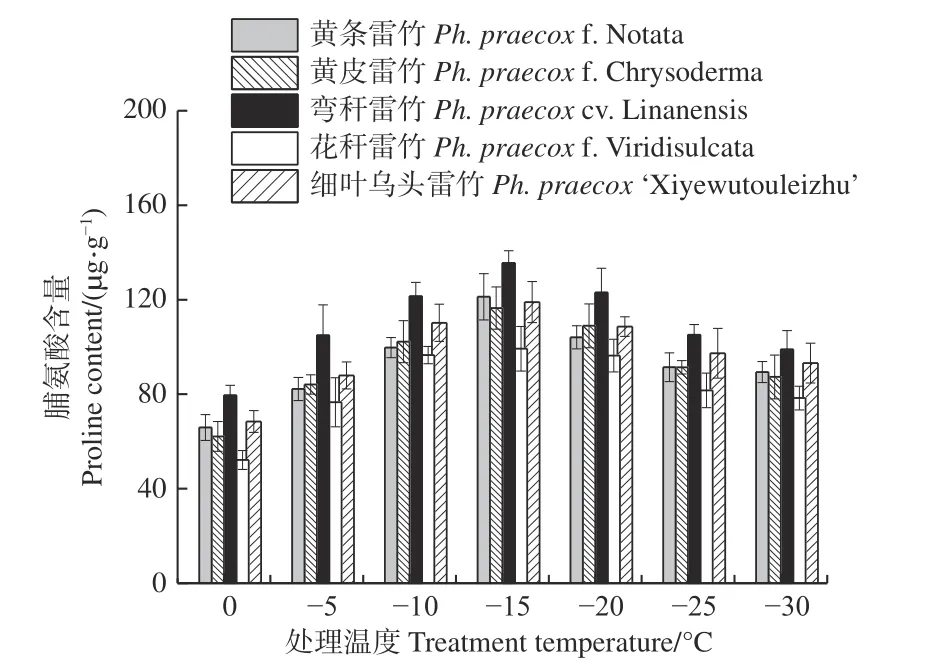
图7 低温胁迫对5 个雷竹变型脯氨酸含量的影响Fig. 7 Effect of low temperature stress on proline contents of 5 varieties
2.5 低温胁迫对5 个雷竹变型生理指标影响的主效应分析和冗余分析
对低温胁迫下的5 个雷竹变型生理特征的主效应分析(PCA)结果(表4)显示:第1 主成分可反映生理指标变化59.38%的贡献率,其中,可溶性蛋白和脯氨酸这两个体现细胞渗透调节响应的指标载荷量较高;第2 主成分可解释约27.8%的信息量,其中,体现细胞抗氧化酶调节能力的指标SOD 和POD 载荷量较高。从温度对生理指标的影响看,可将0℃、-5℃归为一类,-10℃、-15℃和-20℃归为一类,-25℃和-30℃归为一类,同类的处理对生理指标产生的影响相近(图8)。冗余分析(RDA)结果(图9)表明:3 种抗氧化酶活性、可溶性蛋白以及脯氨酸间表现出显著正相关关系,而MDA 和相对电导率间表现出显著正相关关系。温度的改变对相对电导率、脯氨酸、MDA以及抗氧化酶活性的影响较大,而对可溶性蛋白的影响相对较小。运用隶属函数法将与耐寒性相关(正相关和负相关)的生理指标综合分析比单独分析一个或一类指标更具科学性。根据隶属函数值得到5 个雷竹变型耐寒性综合排名为:弯秆雷竹 >细叶乌头雷竹 > 黄皮雷竹 > 黄条雷竹 > 花秆雷竹(表5)。

表4 生理指标的主分量载荷Table 4 Component matrix of physiological indices

图8 不同温度处理下5 个雷竹变型生理参数的主成分分析(PCA)Fig. 8 Principal component analysis(PCA)of physiological parameters of 5 varieties under different treatments
3 讨论
3.1 抗氧化酶系统对低温的响应
低温条件下植物体内会积累大量可破坏植物生物膜系统的超氧自由基[28],而抗氧化酶系统可有效清除超氧自由基。植物通过超氧化物歧化酶(SOD)将组织中的O2-转化为H2O2和O2,再由超氧化物酶(POD)、过氧化氢酶(CAT)将H2O2转化成H2O 和O2,从而使植物膜系统在低温条件下免受伤害[27]。本研究中,5 个雷竹变型抗氧化酶活性随着温度的降低呈先上升后下降的趋势,说明抗氧化酶系统在雷竹耐受低温的过程中发挥积极的作用,但当温度低于雷竹的耐受极限时,会引起抗氧化酶系统紊乱,从而导致活性降低。这与娜塔栎(Quercus nuttalliiPalmer.)[28]、元宝枫(Acer truncatumBunge)[29]、黄条金刚竹(Pleioblastus kongosanensisf.aureostriatusMuroi et Yuk.Tanaka)[30]等植物上的研究结果一致。结合5 个雷竹变型的半致死温度发现,抗氧酶活性随着温度变化曲线的峰值均发生在半致死温度之前,说明通过叶片电导率获得的树种半致死温度同样是抗氧化酶活性的拐点温度;另外也说明酶活性的降低间接导致了细胞膜的损害,进而引起植物细胞内电解质的外渗。主成分分析结果发现,SOD 和POD 活性在第2 主成分中载荷量最高,说明SOD 和POD 在雷竹耐寒过程中起到关键作用。从生理指标对低温的响应看,可将温度分为3 类,即0℃、-5℃归为一类,-10℃、-15℃和-20℃归为一类,-25℃和-30℃归为一类。结合各指标的变化趋势得出,雷竹可耐受高于-5℃的低温,而当温度低于-10℃时则通过改变生理活性和物质含量提高对低温的抗性,当温度低于-20℃后则达到雷竹的低温耐受极限。研究表明,敏感的生理可塑性有助于植物在逆境环境下生存[31],从本研究中抗氧化酶活性的上升幅度看,花秆雷竹上升幅度均最小,说明花秆雷竹的抗氧化酶系统对低温的响应最不敏感,这可能是导致花秆雷竹耐寒性表现不佳的原因之一。相反,耐寒性表现良好的弯秆雷竹和黄条雷竹等抗氧化酶活性的上升幅度更大。

图9 雷竹生理指标对温度响应的冗余分析(RDA)Fig. 9 Redundant analysis of temperature response by physiological indexes of Ph. praecox ‘Prevernalis’
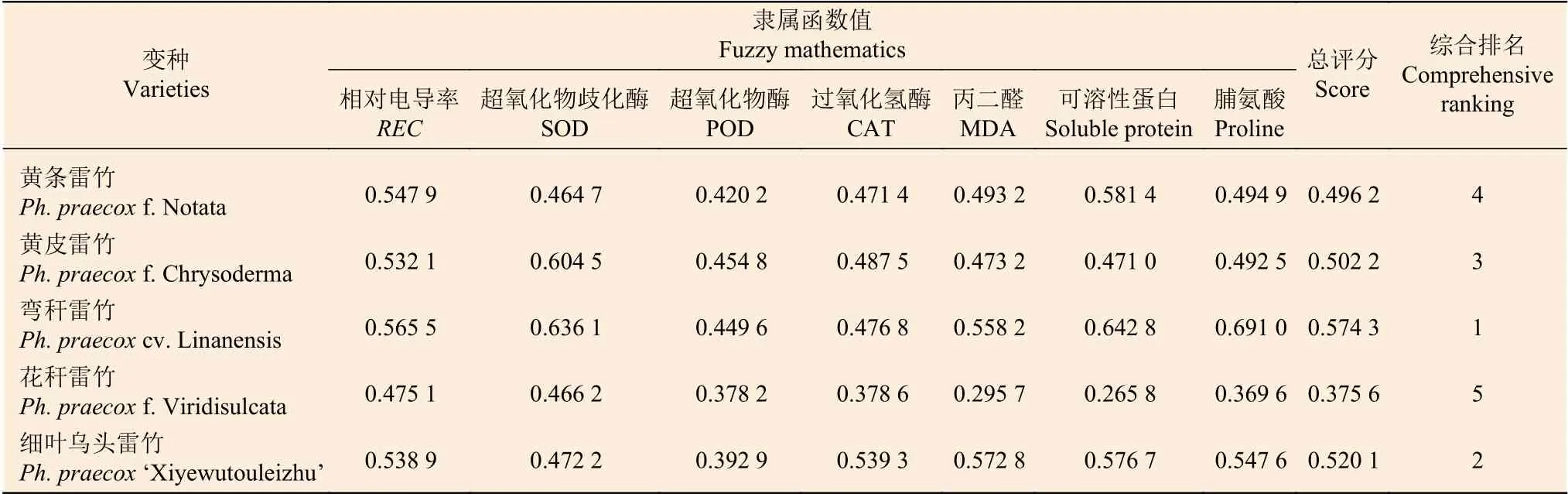
表5 5 个雷竹变型的隶属函数值及耐寒性综合排名Table 5 The membership function and the comprehensive ranking on cold tolerance of 5 varieties
3.2 膜系统的低温受损
相对电导率的大小可以最直接的反映膜系统的损伤程度。本研究中,5 个雷竹变型相对电导率随着温度下降的变化曲线均为典型的“S”型曲线。这种变化趋势与鹅毛竹(Shibataea chinensisNakai)、铺地竹(Arundinaria argenteostriataE. G. Camus)等观赏竹的低温胁迫试验结果基本一致[12];但也有研究发现,阔叶箬竹(Indocalamus latifolius(Keng)McClure)、茶秆竹(Pseudosasa amabilis(McClure)Keng f.)等观赏竹的电导率曲线在半致死温度之前上升平缓随后陡然上升[32]。从5 个雷竹变型电导率的最大值看,弯秆雷竹最小而花秆雷竹最大,说明弯秆雷竹细胞膜受损最低而花秆雷竹最大。这同样符合半致死温度以及耐寒性综合评价结果。比较发现,虽然5 个雷竹变型半致死温度相对于金镶玉竹(Phyllostachys aureosulacataf. Spectabilis)和金丝毛竹(Phyllostachys heterocycla(Carr.) Mitford cv.Gracilis)等刚竹属竹种总体偏高[15],即耐寒性较弱,但与铺地竹和鹅毛竹等常见观赏性竹种相比耐寒性较强[30]。
丙二醛(MDA)是植物脂膜过氧化的重要产物之一,其在植物组织中的积累会使脂膜在的逆境中的损伤加剧[33]。耐寒性较差的树种低温条件下往往发生更早更严重的细胞膜氧化现象,这就导致其MDA 含量的显著增加[27]。5 个雷竹变型MDA 含量均随着温度的降低呈先上升后下降的趋势,这与张玮等关于麻竹(Dendrocalamus latiflorusMunro)低温胁迫试验结果一致[34]。通过比较MDA 含量及其变化程度,可以反映出5 个雷竹变型在低温中的受损程度。本研究中,花秆雷竹MDA 含量上升幅度显著高于其它4 种雷竹,说明在同样的温度胁迫下花秆雷竹细胞膜氧化程度更大。
3.3 渗透调节物质对低温胁迫的响应
可溶性蛋白是植物在低温条件下重要的渗透调节和信息传递物质。植物通过提高细胞中可溶性蛋白含量,增加细胞内的束缚水与自由水的比值,从而避免因细胞液结冰而产生的机械伤害[35]。本研究中,5 个雷竹变型可溶性蛋白含量均随着温度降低而呈先上升后下降的趋势,这与徐传宝等关于竹子低温胁迫的结论基本一致[36]。但从相关性分析结果发现,可溶性蛋白含量与温度的相关性相对于脯氨酸和MDA 较小,同样的现象也出现在POD 的结果中,这可能是由于这两个指标在低温下相对增长率较小引起的。也有研究认为,可溶性蛋白的含量与低温不存在明显的关联[37],甚至有研究发现,可溶性蛋白的含量随着低温胁迫程度的增加呈先降低后上升的趋势[38]。脯氨酸同样是一种重要的渗透调节物质,有研究发现,植物通过提高细胞中脯氨酸含量来提高原生质的保水能力,从而平衡在低温条件下的细胞代谢[39]。另外,脯氨酸还是一种自由基的清除剂,可在逆境条件下稳定蛋白质和核酸[40]。本研究中,不同程度的脯氨酸含量升高同样是5 个雷竹变型在低温条件下的适应性策略。综合评分较高的弯秆雷竹脯氨酸含量上升幅度最大,而花秆雷竹最小。结合主成分分析发现,可溶性蛋白和脯氨酸是占有主分量载荷最高的两个指标,而这两个指标均是重要的渗透调节物质。可见,细胞的渗透调节是雷竹耐寒过程中的主要策略。从5 个雷竹变型的可溶性蛋白和脯氨酸的极值(最小值和最大值)看,抗寒性较好的雷竹含有相对高的物质含量,这或许造成雷竹变型间耐寒能力的差异。
本研究中,适当的低温可以增加雷竹叶片中渗透调节物质的含量。在雷竹栽培过程中,幼苗期进行适当的低温锻炼或许可以有效提高雷竹的御寒能力。本试验仅选择5 个观赏雷竹变型叶片作为试验材料,并没有涉及竹笋、竹秆、根系等重要的器官,利用叶片进行24 h 低温处理的试验方法与自然低温条件也存在一定的差距。但本研究得出的雷竹半致死温度与前人有关雷竹在自然低温条件下生长的结论基本相符。如郭子武等调查浙江北部雷竹在经历较长时间(15 d 左右)严重低温寒害天气(局部低温达-15℃)后的生长状况发现,部分雷竹林出现叶片大量枯黄,竹秆皱缩变色,甚至立竹死亡的情况,严重影响雷竹生长和竹笋产出[41]。同时,本研究结果也为在我国不同气候区进行雷竹变型的栽培和推广提供参考依据。5 个雷竹变型均不适宜在我国东北、华北和西北的严寒或寒冷地区进行推广栽培;在中南、华东、西南地区的偏北部,最低温度低于-15℃的地区则应避免种植如花秆雷竹等耐寒能力较弱的雷竹变型;而其余地区均可栽培推广本试验的5 个雷竹变型。雷竹越冬是一个长期的抗逆过程,本试验结果仅初步揭示雷竹变型间的耐寒性差异,对雷竹的耐寒机理还有待更深入的研究。后续试验中将综合考虑雷竹多个器官对低温的响应,并将大田观赏性雷竹越冬生长表现和生理响应纳入到耐寒性综合评价中。
4 结论
本研究阐明了5 个雷竹变型在低温条件下的生理响应策略,并对5 个雷竹变型的耐寒性进行综合评价,获得了雷竹在低温下的半致死温度,为观赏性雷竹引种和栽培提供了技术依据。5 个雷竹变型在低温条件下耐寒性综合排名为:弯秆雷竹 > 细叶乌头雷竹 > 黄皮雷竹 > 黄条雷竹 > 花秆雷竹。渗透调节物质(可溶性蛋白和脯氨酸)以及抗氧化酶(SOD 和POD)在雷竹耐寒过程中发挥主要作用。半致死温度的确定给雷竹引种提供了温度的定量参考。在雷竹引种和栽培过程中可根据5 个雷竹变型的半致死温度来确定引种地是否宜林。由于雷竹在其生活史的不同阶段对低温环境的适应性存在差异。因此,在后续试验中将进一步研究雷竹其它生长阶段对低温环境的适应情况。
