RNA 干扰细胞分裂周期蛋白6基因表达对结直肠癌细胞增殖、凋亡、侵袭和迁移的影响及其机制研究
2021-04-10王雁军王富强王青兵沈志玲韩朋
王雁军,王富强,王青兵,沈志玲,韩朋
安阳市肿瘤医院1外科,2实验室,河南 安阳 455000
结直肠癌是全球范围内发病率居第3位、病死率居第2位的恶性肿瘤,据统计,2018年全球共180多万例结直肠癌新发病例和881 000例结直肠癌死亡病例,已经成为全球癌症负担。人一生中患结直肠癌的概率为4%~5%,患病风险与个人特征或习惯有关,如年龄、慢性病史和生活方式。肿瘤的高转移率是结直肠癌治疗的障碍,它由一系列不同的细胞过程组成,如肿瘤细胞局部侵袭周围组织、肿瘤细胞的血管内渗或外渗和远处器官的定植。结直肠癌的发生与多种因素有关,其发病机制复杂,目前主要治疗方法为手术切除病灶、化疗联合放疗等姑息治疗。然而,这些方法都具有局限性。因此,迫切需要了解与结直肠癌转移相关的分子机制,寻找生物标志物,为结直肠癌的诊断和治疗提供理论依据。细胞分裂周期蛋白6(cell division cycle 6,CDC6)是真核细胞中DNA复制的中心调节因子。研究表明,CDC6在结直肠癌中高表达,敲低CDC6的表达可抑制结直肠癌细胞生长、DNA合成、上皮-间充质转化(epithelial-mesenchymal transition,EMT)、细胞迁移和侵袭等恶性行为以及奥沙利铂(oxaliplatin,L-OHP)耐药,而人抗原R(human antigen R,HuR)调控CDC6是驱动结直肠癌发生和L-OHP耐药的重要机制。基于癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库的生存分析发现,CDC6低表达与结直肠癌患者预后不良有关,可能成为结直肠癌的预后标志物。CDC6 在宫颈癌、肺腺癌、前列腺癌等多种恶性肿瘤中高表达,提示靶向CDC6是一种很有前途的肿瘤治疗策略。RNA干扰疗法已显示出治疗肿瘤的巨大潜力,如结直肠癌、前列腺癌等。本研究利用RNA干扰技术分析抑制CDC6基因表达对结直肠癌细胞增殖、凋亡、侵袭和迁移的影响,并探索其作用机制,现报道如下。
1 材料与方法
1.1 试剂与仪器
永生化结直肠细胞株(FHC)和结直肠癌细胞株(SW620、LOVO、HT29)均购自美国模式菌种收集中心(American Type Culture Collection,ATCC),RPMI-1640培养基购自美国Gibco公司,胰蛋白酶、RIPA裂解液、噻唑蓝(methyl thiazolyl tetrazolium,MTT)均购自美国Sigma公司,Lipofectamine 2000购自美国Invitrogen公司,β肌动蛋白(β-actin)、CDC6、Janus激酶2(Janus kinase 2,JAK2)、磷酸化-JAK2(phosphorylated JAK2,p-JAK2)、信号转导及转录激活因子3(signal transduction and activator of transcription 3,STAT3)、磷酸化-STAT3(phosphorylated STAT3,p-STAT3)均购自美国 Cell Signaling Technology公司,辣根过氧化物酶标记的二抗购自武汉博士德生物工程有限公司,si-con、si-CDC6均购自上海吉玛制药技术有限公司,异硫氰酸荧光素标记的膜联蛋白V/碘化丙啶(Annexin V-fluorescein isothiocyanate/propidium iodide,Annexin VFITC/PI)细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司,Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司。细胞培养箱购自美国Thermo公司,酶标仪购自德国Eppendorf公司,倒置显微镜购自日本Olympus公司,FACSCalibur流式细胞仪购自美国BD公司。
1.2 细胞培养
在RPMI-1640培养基中培养FHC、SW620、LOVO、HT29细胞,其中包含10%的胎牛血清,于5% CO、37℃培养箱中培养,当细胞融合至80%时,采用胰蛋白酶消化,进行接种传代。
1.3 蛋白质印迹法(Western blot)检测CDC6、p-JAK2、JAK2、p-STAT3、STAT3蛋白表达
采用RIPA裂解液提取FHC、SW620、LOVO、HT29细胞总蛋白,用于检测CDC6蛋白表达;采用RIPA裂解液提取转染si-CDC6或si-con的SW620细胞总蛋白,用于检测 p-JAK2、JAK2、p-STAT3、STAT3蛋白表达。提取蛋白后,加入上样缓冲液,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),将其转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,经脱脂奶粉封闭,4℃条件下与相应一抗(CDC6、p-JAK2、JAK2、p-STAT3、STAT3抗体稀释度均为1∶1000)孵育过夜,Tris-HCl-Tween缓冲盐溶液(Tris buffered saline with Tween,TBST)漂洗 3次,每次 10 min。室温条件下与二抗孵育1 h,TBST漂洗3次,每次10 min,置于化学发光液中显色、显影,以β-actin蛋白作为内参,计算目的蛋白的相对表达量。
1.4 RNA干扰
收集生长状态良好的SW620细胞,以5×10/ml的密度接种于6孔板中,待细胞融合度约为75%时,严格按照Lipofectamine 2000试剂说明书,将si-CDC6转染至SW620细胞(si-CDC6组),其中si-CDC6序列参考陈三三的文献,同时以转染si-con的SW620细胞作为阴性对照(si-con组),转染4~6 h后,更换为含10%胎牛血清的新鲜培养基继续培养。采用Western blot检测si-CDC6组和si-con组SW620细胞中CDC6蛋白的相对表达量,分析转染效果。分析转染CDC6 siRNA对SW620细胞增殖、凋亡、侵袭和迁移的影响。此外,采用JAK2/STAT3信号通路激活剂colivelin处理转染后的SW620细胞(si-CDC6+colivelin组),并检测细胞增殖、凋亡、迁移和侵袭情况。
1.5 MTT法检测SW620细胞的增殖情况
调整转染后的SW620细胞密度为5×10/ml,接种于96孔板中,在培养箱中分别培养24、48、72 h,之后每孔加入100 μl MTT溶液(5 mg/ml),培养4 h,弃去孔内液体,加入200 μl二甲基亚砜,振荡孵育10 min充分溶解结晶,酶标仪读取490 nm波长下各孔的光密度(optical density,OD)值。
1.6 流式细胞术检测SW620细胞的凋亡情况
根据Annexin V-FITC/PI细胞凋亡检测试剂盒的步骤检测SW620细胞的凋亡情况,收集转染后的SW620细胞1×10个,使用500 μl Binding Buffer悬浮细胞,加入5 μl Annexin V-FITC,混匀,加入5 μl PI,混匀,避光反应15 min,采用流式细胞仪进行检测。
1.7 Transwell 小室实验检测SW620细胞的侵袭和迁移情况
SW620细胞侵袭能力检测:首先按照1∶5的比例将Matrigel胶和无血清培养基混匀,包被Transwell上室。收集转染后的SW620细胞,于无血清培养基中调整细胞密度为5×10/ml,在上室中加入100 μl细胞,下室中加入含10%胎牛血清的培养基,于37℃、5% CO培养箱中孵育24 h,采用棉签擦除多余的SW620细胞和Matrigel胶,甲醛固定20 min,结晶紫染色20 min,显微镜观察,计数。
SW620细胞迁移能力检测:Transwell上室中不加Matrigel胶,其余步骤同SW620细胞侵袭能力检测。
1.8 统计学分析
2 结果
2.1 不同细胞株中CDC6蛋白相对表达量的比较
永生化结直肠细胞株FHC及结直肠癌细胞株SW620、LOVO、HT29中CDC6蛋白的相对表达量比较,差异有统计学意义(P
<0.01)。其中永生化结直肠细胞株FHC中CDC6蛋白的相对表达量低于结直肠癌细胞株SW620、LOVO、HT29,差异均有统计学意义(P
<0.05)(图1、表1)。选择CDC6蛋白相对表达量最高的SW620细胞株进行后续研究。
表1 不同细胞株中CDC6蛋白相对表达量的比较(±s)

图1 Western blot 检测不同细胞株中CDC6蛋白的表达情况
2.2 转染CDC6siRNA对SW620细胞增殖的影响
Western blot检测结果显示,si-CDC6组SW620细胞中CDC6蛋白的相对表达量为(0.31±0.04),低于si-con组的(1.00±0.15),差异有统计学意义(t
=13.334,P
<0.05)(图2),说明转染有效。MTT法检测结果显示,培养 24、48、72 h后,si-CDC6组SW620细胞的OD值均明显低于si-con组,差异均有统计学意义(P
<0.01)(表2)。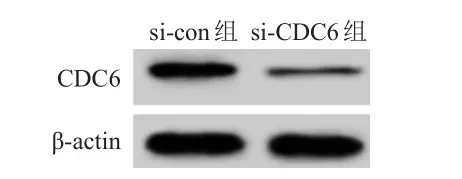
图2 Western blot 检测不同组别SW620细胞中CDC6蛋白的表达情况
表2 不同组别SW620细胞转染后OD值的比较(±s)
2.3 转染CDC6siRNA对SW620细胞凋亡的影响
流式细胞术检测结果显示,si-CDC6组SW620细胞的凋亡率为(33.12±3.86)%,高于si-con组的(3.27±0.34)%,差异有统计学意义(t
=23.110,P
<0.05)。(图3)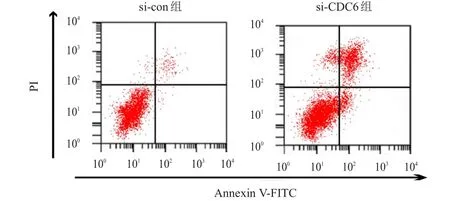
图3 流式细胞术检测不同组别SW620细胞的凋亡情况
2.4 转染CDC6siRNA对SW620细胞侵袭和迁移的影响
Transwell小室实验结果显示,si-CDC6组的侵袭细胞数目和迁移细胞数目均明显少于si-con组,差异均有统计学意义(P
<0.01)。(表3)
表3 不同组别SW620细胞中侵袭和迁移细胞数目的比较(±s)
2.5 转染CDC6siRNA对SW620细胞JAK2/STAT3信号通路相关蛋白表达的影响
Western blot检测结果显示,si-CDC6组SW620细胞中p-JAK2、p-STAT3蛋白的相对表达量均明显低于si-con组,差异均有统计学意义(P
<0.01);si-CDC6组和si-con组SW620细胞中JAK2、STAT3蛋白的相对表达量比较,差异均无统计学意义(P
>0.05)。(图4、表4)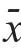
表4 不同组别SW620细胞中JAK2/STAT3信号通路相关蛋白相对表达量的比较(±s)
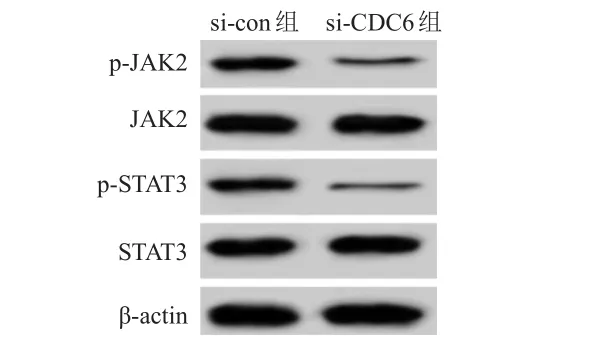
图4 Western blot 检测不同组别SW620细胞中JAK2/STAT3信号通路相关蛋白的表达情况
2.6 激活JAK2/STAT3信号通路逆转CDC6siRNA对SW620细胞增殖、凋亡、侵袭和迁移的影响
培养 24、48、72 h后,si-CDC6+colivelin组SW620细胞的OD值均明显高于si-CDC6组,差异均有统计学意义(P
<0.01)(表5)。si-CDC6+colivelin组SW620细胞的凋亡率为(7.16±0.73)%,低于si-CDC6组的(35.09±3.24)%,差异有统计学意义(t
=25.229,P
<0.05)(图 5)。si-CDC6+colivelin 组的侵袭细胞数目和迁移细胞数目分别为(36.72±3.96)个和(56.41±5.67)个,分别高于si-CDC6组的(20.13±2.58)个和(29.14±3.05)个,差异均有统计学意义(t
=10.530、12.707,P
<0.05)。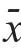
表5 si-CDC6组和si-CDC6+colivelin组SW620细胞转染后OD值的比较(±s)
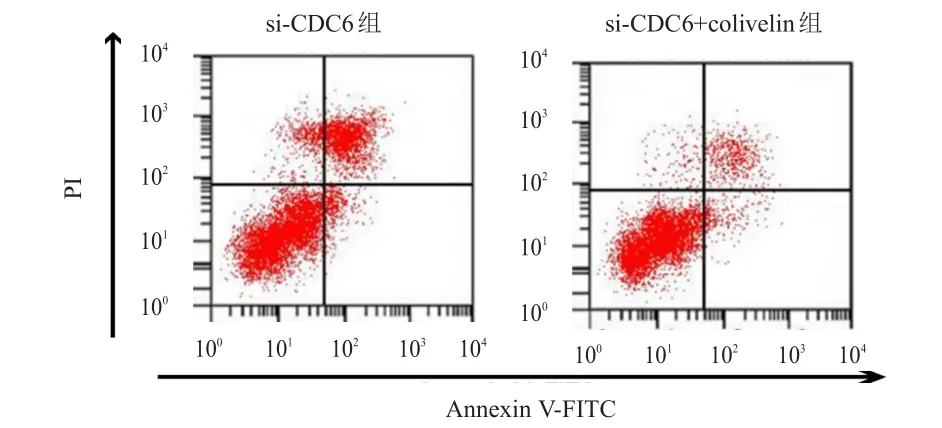
图5 流式细胞术检测si-CDC6组和si-CDC6+colivelin组SW620细胞的凋亡情况
3 讨论
目前结直肠癌已成为中国第四大常见的恶性肿瘤,也是男性和女性恶性肿瘤相关死亡的第五大和第四大原因。早期检测分子标志物是预防结直肠癌的最有效方法。然而,结直肠癌发生发展的分子机制尚未得到很好的表征。因此,深入了解结直肠癌发生发展中涉及的分子机制,将为结直肠癌的诊断和治疗提供依据。
CDC6是一种多功能分子开关,是DNA复制的重要调控因子,在细胞周期中具有激活和维持检查点机制的重要作用。CDC6也是复制前复合物的一个组成部分,在G早期DNA复制的起点形成,在S期开始参与DNA复制。既往研究表明,CDC6的异常表达在多种人类恶性肿瘤中扮演着重要角色。CDC6在结直肠癌、卵巢癌、乳腺癌、膀胱癌等多种恶性肿瘤中高表达,参与肿瘤细胞的增殖、凋亡、DNA复制、转移、放疗抵抗等过程。Yu等通过分析TCGA数据库,发现CDC6低表达与结直肠癌患者预后不良相关。但多项研究证明,CDC6在肿瘤中过表达,并表明它可能是致癌靶标。例如Kim等研究发现,前列腺癌组织中CDC6
mRNA的表达水平明显高于前列腺增生组织,且CDC6高表达与临床分期较晚显著相关,CDC6表达可能是前列腺癌侵袭性的新指标。Zhang等研究指出,与正常骨髓单核细胞相比,慢性髓系白血病细胞系K562中CDC6的表达明显上调,小干扰RNA沉默CDC6
基因表达可有效抑制K562细胞的增殖,促进细胞凋亡,并诱导细胞周期停滞,CDC6过表达可能涉及慢性粒细胞白血病的致癌活性。Deng等探讨了CDC6对上皮性卵巢癌细胞增殖的影响,结果发现,与正常卵巢组织相比,上皮性卵巢癌组织中CDC6蛋白表达水平升高,下调卵巢癌细胞HO8910中CDC6的表达可抑制细胞增殖和集落形成。本研究中,CDC6在结直肠癌细胞SW620、LOVO、HT29中的表达明显上调,同前述研究结果一致。本研究结果还显示,转染CDC6
siRNA可显著抑制SW620细胞增殖,诱导细胞凋亡,并降低细胞的侵袭和迁移能力,表现出一定的抗肿瘤活性,与Zhao等的研究结果相符。这些结果提示,CDC6是结直肠癌潜在的预后标志物和治疗靶点。研究表明,JAK2/STAT3信号通路在肺癌、口腔鳞状细胞癌、甲状腺癌等肿瘤的进展中发挥着重要作用。资料显示,JAK2/STAT3信号通路参与结直肠癌SW620细胞的增殖、迁移和侵袭。JAK2和STAT3磷酸化水平的增加会增强SW620细胞的抗凋亡作用。JAK2/STAT3信号通路的激活需要磷酸化,JAK2/STAT3信号通路的激活与肺癌细胞的生长、迁移和侵袭有关,且可促进肾细胞癌细胞的增殖和迁移并抑制细胞凋亡。本研究中,转染CDC6 siRNA可抑制p-JAK2、p-STAT3蛋白表达,而对JAK2、STAT3蛋白表达无显著影响,表明转染CDC6 siRNA通过降低p-JAK2、p-STAT3蛋白的表达,抑制JAK2/STAT3信号通路活性。此外,激活JAK2/STAT3信号通路逆转了CDC6 siRNA对SW620细胞增殖、侵袭和迁移的抑制作用,并逆转了其对细胞凋亡的促进作用。这些结果提示抑制JAK2/STAT3信号通路活性可能是转染CDC6 siRNA抗结直肠癌作用的重要途径之一。
综上所述,CDC6在结直肠癌细胞中的表达明显上调,RNA干扰抑制CDC6基因表达后可以抑制结直肠癌细胞的增殖、侵袭和迁移,并促进其凋亡,调控JAK2/STAT3信号通路活性可能解释了其抗结直肠癌的作用机制,这为结直肠癌提供了一个潜在的治疗靶标。
