荜茇酰胺的合成、抗肿瘤机制及结构修饰的研究进展
2021-04-08谭丽娟刘雅倩闫洁邹瑜
谭丽娟 刘雅倩 闫洁 邹瑜
摘 要 目的:探讨荜茇酰胺及相关衍生物抗肿瘤作用研究进展,为其临床开发及应用奠定基础。方法:以“荜茇酰胺”“抗肿瘤”“构效关系”“Piperlongumine”“Antitumor”“QSAR”等为关键词,在中国知网、万方数据库、维普网、Sci-hub、PubMed等数据库中组合查询2012年1月-2020年6月发表的相关文献,对荜茇酰胺及相关衍生物抗肿瘤作用研究进行综述。结果与结论:荜茇酰胺的制备方法主要包括从植物中提取和化学合成两种。荜茇酰胺可诱导多种肿瘤细胞系的氧化应激,或可通过升高细胞中活性氧水平来选择性杀伤肿瘤细胞;也可以通过抑制转化生长因子β来诱导上皮-间质转化,从而抑制癌细胞迁移和侵袭;还可通过诱导细胞G2/M期阻滞和凋亡来发挥抗肿瘤活性;荜茇酰胺还可以作为辐射增敏剂,增加肿瘤细胞对放疗的敏感性。荜茇酰胺的结构修饰位点主要包括C1酮羰基、C2与C3位双键、C7与C8位双键、芳香环等,此外,还有研究将荜茇酰胺与其他化合物结构进行缀合改造,或在不改变荜茇酰胺关键活性位点的基础上在其结构内引入其他化合物结构,经过改造所得到的衍生物可在一定程度上增强抗肿瘤活性。荜茇酰胺是一种极具潜力的抗肿瘤化合物,能从多方面抑制和杀死肿瘤细胞,而对正常细胞的毒性非常小,且其具有良好的结构修饰前景,应开展进一步研究以获得活性更好、靶向性更强、毒副作用更小的荜茇酰胺衍生物类抗肿瘤药物。
关键词 荜茇酰胺;衍生物;抗肿瘤;构效关系
荜茇酰胺(Piperlongumine)又称荜茇明碱,属生物碱类化合物,最初分离自胡椒科植物荜茇Piper longum L.的根部[1]。1968年,荜茇酰胺的结构被确认,其分子式为C17H19NO5,分子量为317.34,具有顺式和反式两种异构体(图1),其中反式荜茇酰胺是荜茇酰胺在自然界存在的主要形式,也是其活性形式[2]。荜茇酰胺具有抗肿瘤、抗血小板聚集、抗炎、抗真菌、抗抑郁、抗焦虑等多种药理活性[3]。在荜茇酰胺的所有生物活性中,抗肿瘤活性尤为突出,其可显著抑制肿瘤细胞的生长和转移,且对正常细胞、组织和器官没有明显的毒副作用,具有一定的选择性[4]。为总结荜茇酰胺及相关衍生物在抗肿瘤作用方面的研究进展,笔者以“荜茇酰胺”“抗肿瘤”“构效关系”“Piperlongumine”“Antitumor”“QSAR”等为关键词,在中国知网、万方数据、维普网、Sci-hub、PubMed等数据库中组合查询2012年1月-2020年6月发表的相关文献,对荜茇酰胺及其相关衍生物在抗肿瘤作用方面的研究进行了综述,为其临床开发及应用奠定基础。
1 荜茇酰胺的合成方法
荜茇酰胺的制备方法主要有两种:一是从植物中进行提取,二是化学合成[5]。目前常采用化学合成的方法来获得荜茇酰胺[6]。荜茇酰胺的化学合成方法由Boll 等[7]于1984年首次提出。荜茇酰胺的化学合成常用的方法是以3,4,5-三甲氧基苯甲醛为原料,进行羰基烯化反应,经水解得到中间体3,4,5-三甲氧基肉桂酸,之后再与5,6-二氢-2(1H)-吡啶酮缩合得到荜茇酰胺[8-10],其合成路线见图2(线路1)。此外,还有一种产率比较高的化学合成方法,是将3,4,5-三甲基肉桂酸转化为酰氯后与2-哌啶酮发生反应合成荜茇酰胺衍生物,再经二异丙基氨基锂低温锂化后与苯硒基氯反应得到α-苯基硒酰亚胺,最后通过氧化反应得到荜茇酰胺[11],其合成路线见图2(线路2)。
2 荜茇酰胺的抗肿瘤作用机制
2.1 影响细胞内活性氧(ROS)水平
荜茇酰胺可诱导多种细胞系的氧化应激反应,在多种恶性肿瘤细胞中可通过升高其ROS水平来选择性杀伤肿瘤细胞,但其具体作用机制目前尚不清楚[12-13]。研究发现,荜茇酰胺可作用于蛋白TrxR1而导致细胞内ROS积累,并引发氧化应激反应[12]。在人胶质瘤细胞中,荜茇酰胺能通过上调过氧化物酶(PRDX)家族中PRDX4的表达来升高细胞中的ROS水平,从而介导胶质瘤细胞的凋亡,但对正常神经细胞无明显影响[13]。此外,荜茇酰胺还能抑制人胃癌MKN45细胞增殖,诱导细胞凋亡,作用机制可能为荜茇酰胺升高了肿瘤细胞内ROS水平,进而激活p53和胱天蛋白酶依赖性凋亡途径[14]。
2.2 抑制上皮-间质转化(EMT)
EMT被认为是肿瘤细胞迁移的早期阶段;在肿瘤进展阶段,肿瘤细胞可通过血液和淋巴系统从病灶部位向其他部位转移,肿瘤转移是导致大部分肿瘤患者死亡的主要原因[15-16]。相关研究表明,荜茇酰胺可能通过抑制转化生长因子β(TGF-β)诱导EMT,从而抑制肿瘤细胞的迁移和侵袭[17]。此外,在人膀胱癌的研究中发现,荜茇酰胺可显著降低EMT相关蛋白锌指转录因子Snail2、β-連环蛋白、锌指增强子结合蛋白、神经型钙黏附蛋白等的表达水平,从而发挥抗肿瘤作用[18]。
2.3 诱导细胞G2/M期阻滞和凋亡
将肿瘤细胞阻滞于某一时相,从而抑制肿瘤细胞的增殖是抗癌药物的研发方向之一,G2期到M期是肿瘤细胞增殖的一个重要阶段,研究发现,荜茇酰胺可降低人膀胱癌细胞系活性,使处于G2/M期的细胞百分比升高、G1/G0期的细胞百分比降低[18]。在对人胆管癌的相关研究发现,荜茇酰胺可显著增加胆管癌细胞中G2/M期的细胞周期停滞而显著抑制肿瘤细胞的增殖,并通过抑制其生长迁移和诱导其凋亡来发挥抗肿瘤活性[19-20]。此外,Somchai等[21]的研究表明,荜茇酰胺对雌激素受体阳性和阴性乳腺癌细胞都具有细胞毒作用,可诱导乳腺癌细胞凋亡和G2/M期阻滞。
2.4 提高肿瘤细胞对辐射的敏感性
肿瘤细胞受到辐射后发生凋亡是其主要的死亡方式,而肿瘤对放疗抵抗的原因之一是肿瘤细胞对凋亡产生了抵抗性,故肿瘤细胞的辐射敏感性与其凋亡以及在增殖周期各时相的分布密切相关[22]。相关研究表明,荜茇酰胺能使人乳腺癌A549细胞阻滞于凋亡最敏感的G0/G1期,并降低S期细胞比例,从而增加辐射介导的细胞凋亡,发挥辐射增敏效应[23]。此外,在人口腔癌方面的研究也提示荜茇酰胺可作为辐射增敏剂,有利于提高放疗疗效[24]。
3 荜茇酰胺的修饰改造及相关衍生物
荜茇酰胺作为一种极具潜力的中药单体,对多种肿瘤细胞具有特异性的细胞毒作用,而对正常细胞的毒性非常小[4]。荜茇酰胺虽具有较好的抗肿瘤增殖活性和选择性,但其抗肿瘤活性和选择性还有待进一步提高。此外,荜茇酰胺本身也存在一些理化缺点,例如其水溶性较差,直接影响了其在体内的吸收和生物利用度,制约了其成药性研究和临床开发[25]。为更好地利用这一天然产物,研究人员从荜茇酰胺结构方面也进行了相应的研究,以进一步提高该化合物的抗肿瘤活性和选择性。目前,对荜茇酰胺的修饰主要是在C1酮羰基、C2与C3位双键、C7与C8位双键、芳香环等位点。
3.1 C1位酮羰基的修饰改造及相关衍生物
Lad等[26]描述了一系列荜茇酰胺类似物的合成和生物活性评价,将荜茇酰胺的C1位酮羰基用砜基取代,并在芳香环位置也进行了相应的修饰,得到的衍生物具有较好的抗肿瘤活性,且以衍生物1~3的生物活性为最优。因此,用砜基取代C1位酮羰基似乎可使化合物性质发生显著变化,可在一定程度上增强化合物的抗肿瘤活性,这部分的改造可能会成为抗肿瘤药物新衍生物研发的一个方向。衍生物1~3的化学结构见图3。
3.2 C2和C3位的修饰改造及相关衍生物
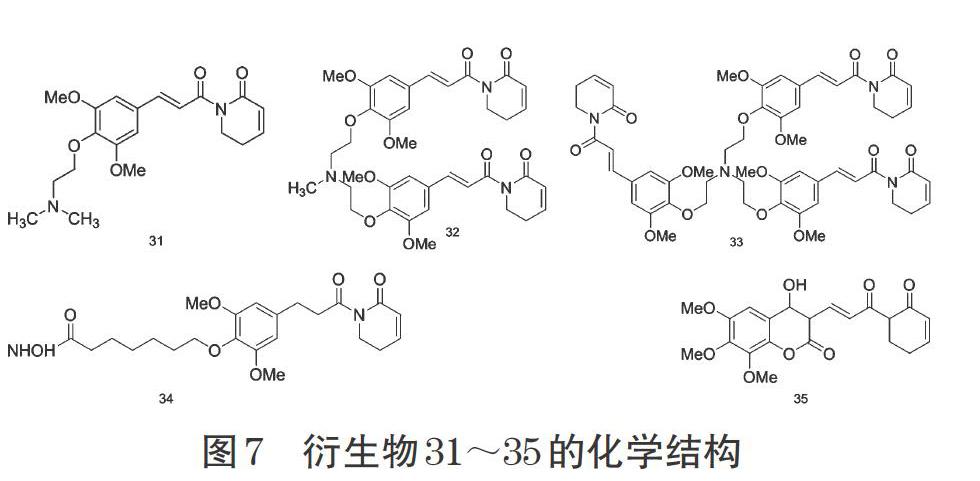
Adams等[27]对荜茇酰胺的C2、C3位进行了修饰改造,使双键饱和得到衍生物4,但这种改造会使化合物对肿瘤细胞的细胞毒作用降低,且对谷胱甘肽S-转移酶的抑制活性也较弱。目前,荜茇酰胺C2位取代的化合物还有衍生物5~11,其中衍生物5、6的细胞毒性较弱;衍生物11的改造方式也会使化合物的抗肿瘤活性降低;而荜茇酰胺C2位上由卤素取代得到的衍生物7和8,以及分别由2-环苯基-1-炔和2-(2-氟苯基)-1-炔取代得到的衍生物9和衍生物10的抗肿瘤活性均优于荜茇酰胺,其中衍生物7的抗肿瘤活性最优,可使肿瘤细胞内ROS水平升高,从而抑制硫氧蛋白还原酶,诱导细胞凋亡[28]。Zhang等[29]的研究也发现,当荜茇酰胺C2位上为卤素取代时,得到的大多数衍生物的抗肿瘤活性优于荜茇酰胺。衍生物4~11的化学结构见图4。
3.3 C7和C8位的修饰改造及相关衍生物
有研究运用两种人肿瘤细胞系H1703细胞和HeLa细胞探讨了荜茇酰胺的构效关系,发现将荜茇酰胺C7、C8位双键还原得到的衍生物12对肿瘤细胞的毒性显著降低,但其对细胞内的ROS水平无影响[27,30]。Adams等[27]研究發现,衍生物12的生物活性比荜茇酰胺更低。Punganuru等[31]根据一种微管靶向药的结构对荜茇酰胺进行了修饰改造,将荜茇酰胺C7位的氢用苯基取代,并在该苯环上进行了修饰,获得了一系列的荜茇酰胺衍生物14~19,其中衍生物15的生物活性最优,对大多数肿瘤细胞具有细胞毒作用;此外,衍生物15具有与荜茇酰胺类似的恢复突变体p53蛋白功能的能力,并能使其微管不稳定,让细胞周期停滞在G2/M期并诱导细胞凋亡。Wu等[32]在荜茇酰胺的C7位引入相应的烷基得到了一系列荜茇酰胺衍生物,这些衍生物的生物活性与荜茇酰胺相比无显著变化,只有衍生物20表现出优于荜茇酰胺的细胞毒作用。衍生物12~20的化学结构见图5。
3.4 芳香环上的修饰改造及相关衍生物
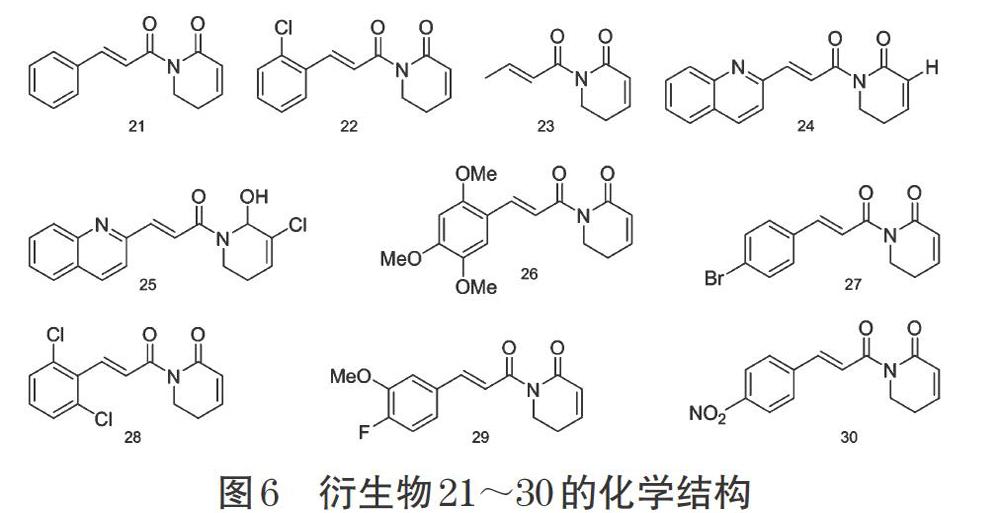
Adams等[27]对荜茇酰胺结构中的芳香环进行了修饰改造得到衍生物21~22,并发现衍生物21对肿瘤细胞的毒性和对细胞内ROS水平的影响并没有发生实质性的变化,而衍生物22的活性略微降低。有研究将荜茇酰胺结构进行改造得到了不含芳香环的衍生物23,并发现该衍生物对谷胱甘肽S-转移酶的抑制活性降低,对肿瘤细胞的毒性作用也有所降低[28]。Zou等[25]描述了几种荜茇酰胺类似物的合成及生物活性评价,将荜茇酰胺的芳香环分别用吡啶、吡嗪和喹诺酮等结构进行替换,发现得到的衍生物24和衍生物25对人结直肠癌细胞的抗增殖活性优于荜茇酰胺,且具有更好的水溶性。Meegan等[33]在荜茇酰胺芳香环上的不同位置分别用1~3个甲氧基进行取代得到一系列衍生物,发现衍生物26对乳腺癌细胞的毒性最强,且有轻微的选择性,但不及荜茇酰胺,表明荜茇酰胺苯环上的甲氧基取代对于增加其抗肿瘤活性并不理想。该研究进一步尝试用一些其他基团在芳香环上进行取代,并发现荜茇酰胺C12位用溴取代得到的衍生物27和将C10和C13位用氯取代得到的衍生物28显示出比荜茇酰胺更低的生物活性,而C12位氟取代和C11位甲氧基取代得到的衍生物29的活性有所增加,C12位硝基取代得到的衍生物30的活性也有略微增加。衍生物21~30的化学结构见图6。
3.5 其他方面的缀合改造及相关衍生物
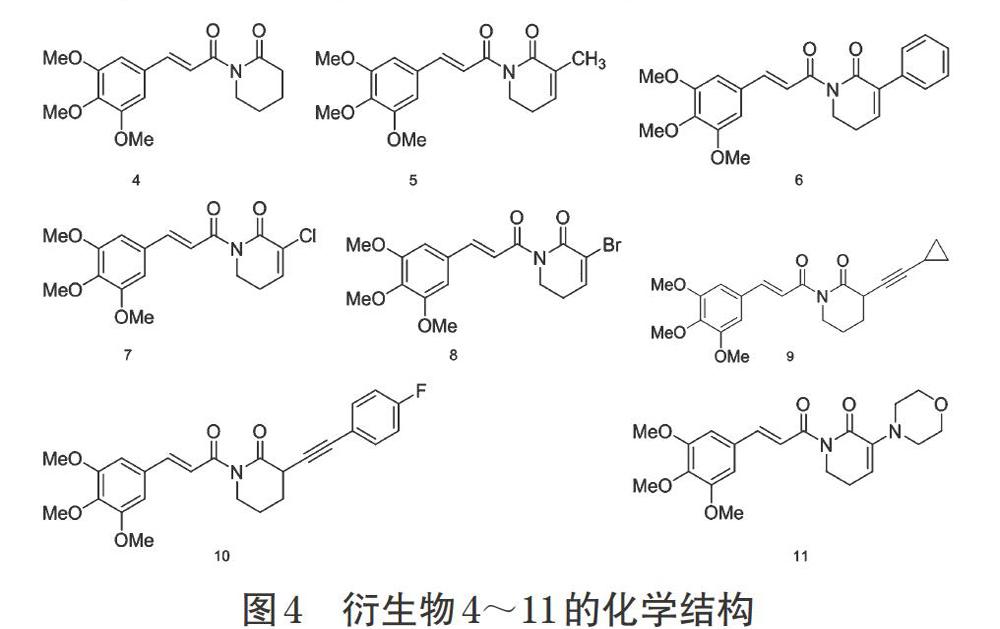
Adams等[27]运用Mitsunobu反应在衍生物31的基础上合成了含多个荜茇酰胺结构的衍生物32和衍生物33,生物活性研究表明衍生物31具有优于荜茇酰胺的抗肿瘤活性,且衍生物32和衍生物33的抗肿瘤活性高于衍生物31。Liao等[34]利用化学方法将伏立诺他的结构连接到荜茇酰胺芳香环上的甲氧基上,获得了具有荜茇酰胺和伏立诺他两者结构特性的衍生物34,并发现该衍生物可诱导肿瘤细胞凋亡和DNA损伤,具有较好抗白血病作用。Xu等[35]将具有抗肿瘤活性的双香豆素结构引入到荜茇酰胺的结构中,并保留荜茇酰胺的关键活性位点,合成了含双香豆素和荜茇酰胺两者结构特性的衍生物35,发现经过这种改造得到的衍生物35能升高肿瘤细胞内ROS水平,在体内具有优于荜茇酰胺的抗肿瘤活性。衍生物31~35的化学结构见图7。
4 结语
综上,荜茇酰胺是一种极具潜力的抗肿瘤化合物,能通过多方面机制抑制和杀死肿瘤细胞,且对正常细胞的毒性非常小。随着研究的深入,荜茇酰胺的抗肿瘤作用机制包括:可诱导多种肿瘤细胞系的氧化应激,或可通过升高细胞中ROS水平来选择性杀伤肿瘤细胞;也可以通过抑制TGF-β来诱导EMT,从而抑制肿瘤细胞的迁移和侵袭;还可以通过诱导细胞G2/M期阻滞和凋亡来发挥抗肿瘤活性;此外,荜茇酰胺还可以作为辐射增敏剂来提高放疗疗效。
荜茇酰胺虽具有较好的抗肿瘤活性和选择性,但还需要对其进行深入的研究。同时,为获得靶向性更好、抗肿瘤活性更强的抗肿瘤药物,近年来对荜茇酰胺这一天然产物的结构修饰的研究也较多,其抗肿瘤方面的结构修饰位点主要包括C1酮羰基、C2与C3位双键、C7与C8位双键、芳香环等;此外,还有研究将荜茇酰胺与其他化合物的结构进行缀合改造,或在不改变荜茇酰胺关键活性位点的基础上在其结构内引入其他化合物的结构,通过这种修饰方法可在一定程度上提高荜茇酰胺的抗肿瘤活性。鉴于荜茇酰胺具有良好的结构修饰前景,未来可进一步开展研究,以期在此基础上获得活性更好、靶向性更强、毒副作用更低的荜茇酰胺衍生物类抗肿瘤药物。
参考文献
[ 1 ] 麻春杰,哈斯阿古拉,张立全,等.荜茇宁对高脂血症大鼠血症代谢及相关基因表达的影响[J].中草药,2008,39(7):1039-1043.
[ 2 ] JOSHI BS,KAMAT YN,SAKSENA AK. The structure of piplartine and a synthesis of dihydropiplartine[J]. Tetrahedron Lett,1968,9(20):2395-2400.
[ 3 ] RAWAT L,HEGDE H,HOTI SL,et al. Piperlongumine induces ROS mediated cell death and synergizes paclitaxel in human intestinal cancer cells[J]. Biomed Pharmacother,2020. DOI:10.1016/j.biopha.2020.110243.
[ 4 ] RAJ L,IDE T,GURKAR AU,et al. Selective killing of cancer cells by a small molecule targeting the stress response to ROS[J]. Nature,2011,475(7355):231-234.
[ 5 ] 吴岳林.天然产物荜拔酰胺的结构优化、合成和抗肿瘤活性评价[D].南京:南京理工大学,2014.
[ 6 ] PISKA K,KRZYZAK AG,KOCZURKIEWICZ P,et al. Piperlongumine (piplartine) as a lead compound for anticancer agents-synthesis and properties of analogues:a mini-review[J]. Eur J Med Chem,2018,156:13-20.
[ 7 ] BOLL PM,HANSEN J,SIMONSEN O,et al. Synthesis and molecular structure of piplartine (=piperlongumine)- ScienceDirect[J]. Tetrahedron,1984,40(1):171-175.
[ 8 ] PARK BS,SON DJ,CHOI WS,et al. Antiplatelet activities of newly synthesized derivatives of piperlongumine[J].Phytother Res,2008,22(9):1195-1199.
[ 9 ] RAO VR,MUTHENA P,HANKAPAIAHG S,et al. Synthesis and biological evaluation of new piplartineanalongues as potental dosereduct aseinhibitors(ARIs)[J].Eur J Med Chem,2012,57:344-361.
[10] PENG S,ZHANG B,MENG X,et al.Synthesis of piperlongumine analogues and discovery of nuclear factor erythroid 2-related factor 2 (Nrf2) activators as potential neuroprotective agents[J]. J Med Chem,2015,58(13):5242- 5255.
[11] SEO YH,KIM JK,JUN JG. Synthesis and biological evaluation of piperlongumine derivatives as potent anti-inflammatory agents[J]. Bioorg Med Chem Lett,2014,24(24):5727-5730.
[12] KARKI K,HEDRICK E,KASIAPPAN R,et al. Piperlongumine induces reactive oxygen species (ROS)-dependent downregulation of specificity protein transcription factors[J]. Cancer Prev Res,2017,10(8):467- 477.
[13] 張倩,徐文茂.荜茇酰胺对胶质瘤细胞的影响[J/OL].临床检验杂志:电子版,2017,6(1):61-64.
[14] 段超勤,邓超,邹晓平.荜茇酰胺对人胃癌细胞株MKN45增殖、凋亡的影响及其机制研究[J].胃肠病学,2016,21(2):69-74.
[15] MARCUCCI F,STASSI G,RUGGERO DM. Epithelial- mesenchymal transition:a new target in anticancer drug discovery[J]. Nat Rev Drug Discov,2016,15(5):311- 325.
[16] DIEPNBRUCK M,CHRISTOFORI G. Epithelial-mesenchymal transition (EMT) and metastasis:yes,no,maybe? [J]. Current Opinion in Cell Biology,2016,43:7-13.
[17] PARK MJ,LEE DE,SHIM MK,et al. Piperlongumine inhibits TGF-β-induced epithelial-to-mesenchymal transition by modulating the expression of E-cadherin,Snail1,and Twist1[J]. Eur J Pharmacol,2017. DOI:10.1016/j.ejphar.2017.07.036.
[18] LIU D,QIU XY,WU X,et al. Piperlongumine suppresses bladder cancer invasion via inhibiting epithelial mesenchymal transition and F-actin reorganization[J]. Biochem Biophys Res Commun,2018,494(1/2):165-172.
[19] THONGSOM S,SUGINTA W,LEE KJ,et al. Piperlongumine induces G2/M phase arrest and apoptosis in cholangiocarcinoma cells through the ROS-JNK-ERK signaling pathway[J]. Apoptosis,2017,22(11):1473-1484.
[20] 陳宙,陈春雷,林晖,等.荜茇酰胺对人胆管癌HCCC- 9810细胞增殖和凋亡的影响[J].广东医学院学报,2016,34(5):484-486、490.
[21] SOMCHAI S,YONOWAPA S,THEERA S,et al. (-)-Kusunokinin and piperloguminine from piper nigrum:an alternative option to treat breast cancer[J]. Biomed Pharmacother,2017. DOI:10.1016/j.biopha.2017.05.130.
[22] 肖楠,姚建新,徐党辉,等.荜茇酰胺对人肺腺癌A549细胞的增殖及其辐射敏感性的影响[J].山西医药杂志,2017,46(11):1259-1262.
[23] 肖楠,徐党辉,潘志尧,等.荜茇酰胺对人肺腺癌A549细胞辐射敏感性的影响[J].山东医药,2017,57(6):13-16.
[24] CHEN YJ,KUO CC,TING LL,et al. Pipeilongumine inhibits cancer stem cell properties and regulates multiple malignant phenotypes in oral cancer[J]. Oncol Lett,2018,15(2):1789-1798.
[25] ZOU Y,YAN C,ZHANG H,et al. Synthesis and evaluation of N-heteroaromatic ring-based analogs of piperlongumine as potent anticancer agents[J]. Eur J Med Chem,2017. DOI:10.1016/j.ejmech.2017.06.046.
[26] LAD NP,KULKARNI S,SHARMA R,et al. Piperlongumine derived cyclic sulfonamides(sultams):synthesis and in vitro exploration for therapeutic potential against Hela cancer cell lines[J]. Eur J Med Chem,2017. DOI:10.1016/j.ejmech.2016.12.022.
[27] ADAMS DJ,DAI M,PELLEGRINO G,et al. Synthesis,cellular evaluation,and mechanism of action of piperlongumine analogs[J]. Proc Natl Acad Sci U S A,2012,109(38):15115-15120.
[28] YAN WJ,WANG Q,YUAN CH,et al. Designing piperlongumine-directed anticancer agents by an electrophilicity-based prooxidant strategy:a mechanistic investigation[J]. Free Radic Biol Med,2016. DOI:10.1016/j.freeradbiomed.2016.05.021.
[29] ZHANG Y,MA H,WU Y,et al. Novel non-trimethoxylphenyl piperlongumine derivatives selectively kill cancer cells[J]. Bioorg Med Chem Lett,2017,27(11):2308- 2312.
[30] GONG LH,CHEN XX,WANG H,et al. Piperlongumine induces apoptosis and synergizes with cisplatin or paclitaxel in human ovarian cancer cells[J]. Oxid Med Cell Longev,2014. DOI:10.1155/2014/906804.
[31] PUNGANURU SR,MADALA HR,VENUGOPAL SN, et al. Design and synthesis of a C7-aryl piperlongumine derivative with potent antimicrotubule and mutant p53-reactivating properties[J]. Eur J Med Chem,2016. DOI:10.1016/j.ejmech.2015.10.052.
[32] WU Y,MIN X,ZHUANG H,et al. Design,synthesis and biological activity of piperlongumine derivatives as selective anticancer agents[J]. Eur J Med Chem,2014. DOI:10.1016/j.ejmech.2014.05.070.
[33] MEEGAN MJ,NATHWANI S,TWAMLEY B,et al. Piperlongumine (piplartine) and analogues:antiproliferative microtubule-destabilising agents[J]. Eur J Med Chem,2017,125:453-463.
[34] LIAO Y,NIU X,CHEN B,et al. Synthesis and antileukemic activities of piperlongumine and HDAC inhibitor hybrids against acute myeloid leukemia cells[J]. J Med Chem,2016,59(17):7974-7990.
[35] XU X,FANG X,WANG J,et al. Identification of novel ROS induce by merging the fragments of piperlongumine and dicoumarol[J]. Bioorg Med Chem Lett,2017,27(5):1325-1328.
(收稿日期:2020-10-14 修回日期:2020-12-30)
(編辑:罗 瑞)
